При взаимодействии известковой почвы с почвенной и дождевой водой, насыщенной атмосферным диоксидом углерода (IV);
2. при взаимодействии карбонатов с природными кислотами;
3. при растворении гипса в воде;
4. при химических реакциях, происходящих в почве.
38. В результате превращений
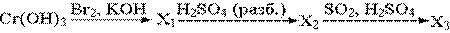
образуется конечный продукт (X3) состава
1. KCrO2;
2. K2CrO4;
3. K2Cr2O7;
4. Cr2(SO4)3 .
39. Одну из двух одинаковых порций гидрокарбоната натрия NaHCO3 прокалили, а затем обе порции раздельно обработали избытком хлороводородной кислоты. В каком случае и во сколько раз объем газа, образовавшегося при действии кислоты, больше? Правильным утверждением является следующее:
1. в случае обработки кислотой прокаленной порции - в 2 раза;
В случае обработки кислотой непрокаленной порции - в 2 раза;
3. в обоих случаях выделится одинаковый объем газа.
40. Подберите коэффициенты в уравнении окислительно-восстановительной реакции
K2SO3 + H2SO4 + KMnO4 ® MnSO4 + K2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов ___21____.
41. Подберите коэффициенты в уравнении окислительно-восстановительной реакции Na2Cr2O7 + H2SO4 + NaBr ® Cr2(SO4)3 + Br2 + Na2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов ___29______.
42.Подберите коэффициенты в уравнении окислительно-восстановительной реакции FeCl2 + HCl + KMnO4 -® FeCl3 + Cl2 + MnCl2 + KCl + H2O. В ответе укажите в уравнении сумму коэффициентов ___60___.
43. Уравнение окислительно-восстановительной реакции, в котором правильно подобраны коэффициенты:
1. H2SO4 + H2S = 2H2O + SO2 + S;
2. 4H2SO4 + 2H2S = 6H2O + 5SO2 + S;
3. 2H2SO4 + 4 H2S = 6H2O + SO2 + 5S.
44. При полном электролизе раствора хлорида натрия с платиновыми электродами получится раствор, содержащий
1. PtCl2;
NaOH;
3. HCl;
4. H2O.
45. В процессе электролиза водного раствора NaClO4 на электродах выделятся следующие продукты:
1. Na, Cl2;
2. H2, Cl2, O2;
3. H2, O2;
4. H2, O2, Na.
46. При электролизе расплава хлорида натрия на аноде выделилось 56 л хлора. Масса образовавшегося металлического натрия равна
Г;
2. 100 г;
3. 120 г;
4. 2 моль.
47. Имеется раствор смеси солей: Na2SO4 и CuSO4. При электролизе этого раствора на катоде будут выделяться следующие вещества в указанной последовательности:
1. Cu, H2;
2. Cu, Na;
3. H2, Na;
4. Cu, O2.
48. Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л (н.у.) газа. Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Массовая доля (%) меди в сплаве составляет
1. 69%;
2. 74%;
3. 61%;
4. 25%.
49. При взаимодействии смеси железных и медных опилок с разбавленной серной кислотой выделилось 8,96 л газа (н.у.). При обработке такого же образца концентрированной азотной кислотой образовалась соль, при термическом разложении которой выделилось 11,2 л газа (н.у.). Процентное содержание меди в сплаве составляет
1. 46,8%;
2. 36,4%;
3. 57,6%;
4. 18,2%.
50.При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. Химическая формула металла ___Ca___.
51. Растворимость хлорида натрия при 25° С составляет 36,0 г в 100 г воды. Массовая доля соли в насыщенном растворе при этой температуре равна
1. 9,5%;
2. 5,0% ;
3. 26,47% ;
4. 36%.
52. Смешали 100 г 10%-ного раствора хлороводородной кислоты и 100 г 10%-ного раствора гидроксида натрия. Массовая доля хлорида натрия в образовавшемся растворе составляет
1. 7,31%;
2. 16,21%;
3. 14,62%;
4. 10%.
53. Какова должна быть массовая доля хлороводорода в соляной кислоте, чтобы в ней на 10 моль воды приходился 1 моль хлороводорода?
1. 10%;
2. 16,86%;
3. 25%;
4. 8,43%.
54. В воде растворили 11,2 г гидроксида калия. Объем раствора довели до 257 мл. Какова молярная концентрация раствора?
1. 0,78 моль/л;
2. 4,4 моль/л;
3. 0,5 моль/л;
4. 0,2 моль/л.
55. Какую массу медного купороса CuSO4 · 5H2O и воды надо взять для приготовления 40 кг 20%-ного раствора сульфата меди (II)?
1. 8 кг CuSO4 · 5 H2O, 32 кг H2O;
2. 10 кг CuSO4 · 5 H2O, 30 кг H2O;
3. 12,5 кг CuSO4 · 5 H2O, 27,5 кг H2O.
