Растворы электролитов отличаются от растворов неэлектролитов:
температура кипения р-ров электролитов выше расчетной для эквимолярного раствора неэлектролитов
температура замерзания р-ров электролитов ниже расчетной
осмотическое давление р-ров электролитов выше расчетного
причина в большем количестве активных частиц в-ва в р-ре электролита за счет образования ионов
326)изотонический коэффициент
для расчетов свойств растворов электролитов вводится коэффициент Вант-Гоффа или изотонический коэффициент,
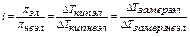 который равен отношению параметров р-ра электролита и параметров эквимолярного раствора неэлектролита
который равен отношению параметров р-ра электролита и параметров эквимолярного раствора неэлектролита
Зависимость изотонического коэффициента от разбавления р-ра.330)Расчет степени диссоциации по изотон коэф-у.
изотонический коэффициент увеличивается при разбавлении р-ра электролита
изотонический коэффициент максимальный при max разбавлении р-ра
при этом изотонический коэффициент равен числу ионов, на которые диссоциирует 1 молекула электролита
ПР: для NaCl максимальный изотонический коэффициент равен 2
коэффициент Вант-Гоффа рассчитывают по формуле
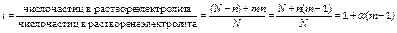 |
,
где N – число молекул электролита или число молекул эквимолярного раствора неэлектролита,
n – число молекул, распавшихся на ионы,
m – число ионов, образующихся из одной молекулы электролита,
mn – число ионов
(N - n) + mn – число молекул и ионов в растворе электролита,
a - степень электролитической диссоциации, которая равна a = n / N
анализ уравнения:
чем больше число ионов, образующихся из одной молекулы электролита, тем больше коэффициент
чем больше степень электролитической диссоциации, тем больше коэффициент
в связи с тем, что природа в-в-концентрация-температура-посторонние ионы влияют на степень диссоциации,
эти факторы влияют на изотонический коэффициент
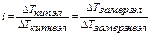 изотонический коэффициент определяют опытным путем по уравнению
изотонический коэффициент определяют опытным путем по уравнению
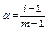 изотонический коэффициент используют
изотонический коэффициент используют
- для расчета степени электролитической диссоциации по уравнению
- для расчёта коллигативных свойств электролитов
Dр = iKx DТзамерз = iKС DТкип = iЕС
p = iСRT
растворы электролитов изотоничны при равной концентрации молекул-ионов и равной температуре
Эффект Доннана
эффект Гиббса-Доннана - неравномерное распределение электролитов между клеткой и межклеточным в-вом
- межклеточное в-во и цитоплазма клетки - растворы электролитов,
при этом в цитоплазме есть белки в виде анионов, и белков, практически, нет в межклеточном в-ве
- эти растворы разделены полупроницаемой клеточной мембраной
- мембрана проницаема для ионов Сl- и непроницаема для белков
- межклеточное в-во и цитоплазма клетки - электронейтраленые растворы
- подвижные анионы Сl- уравновешивают заряд катионов в клетке и в межклеточном в-ве
например, равновесие зарядов в межклеточном в-ве и цитоплазме клетки описывается уравнениями
[К+e] = [Сl -e] [К+i]= [Сl -i] + [Prot-]
в клетке заряд недиффундирующих белков-анионов должен быть уравновешен
большей концентрацией катионов К+ и меньшей концентрацией анионов Сl-
биологическое значение доннановского равновесия:
в результате неравномерного распределения ионов К+ и Сl- возникает мембранный потенциал.
