Вопрос 42. Химическое равновесие и факторы, влияющие на равновесие. Прямая и обратная реакции, их скорости. Закон давления масс. Константа равновесия химической реакции.
Химическое равновесие - это состояние системы реакции, при которой скорость прямой реакции равна скорости обратной. А влияют на нее концентрация, температура и наличие катализатора или ингибитора.
Применяется принцип для того, чтобы предсказать в какую сторону пойдет химическая реакция в случае изменения какого-либо из параметров. Так при повышении температуры равновесие смещается в сторону экзотермической реакции, а при повышении давления в сторону большего числа газообразных молекул.
Можно нагревать смесь газообразных водорода и йода, а можно взять для опыта чистый HI – результат будет одним и тем же: образуется равновесная смесь трех веществ (H2, I2, HI) одного и того же состава. Для внешнего наблюдателя в такой системе химические превращения не происходят, но на самом деле здесь постоянно идут прямая и обратная реакции. Рассмотрим эту систему с точки зрения химической кинетики.
Допустим, для опыта взяли газообразные водород и йод. В первый момент времени еще нет HI, поэтому идет только прямая реакция, скорость которой (vпр) выражается кинетическим уравнением:
vпр = k1[H2][I2]
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. В данном конкретном случае кинетические уравнения соответствуют химическим уравнениям прямого и обратного процессов. Скорость обратной реакции (vобр) выражается кинетическим уравнением с константой скорости k2:
vобр = k2[HI]2
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
vпр = vобр
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
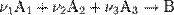
закон действующих масс может быть записан в виде кинетического уравнения вида:
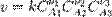
где 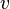 — скорость химической реакции,
— скорость химической реакции, 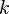 — константа скорости реакции.
— константа скорости реакции.
Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Вопрос 43. Влияние внешних условий на химическое равновесие системы. Принцип ЛеШателье.
Принцип ЛеШателье - Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому.
Если внешние условия изменяются, это приводит к изменению равновесных концентраций веществ. В этом случае говорят о нарушении или смещении химического равновесия.
Химическое равновесие смещается в ту или иную сторону при изменении любого из следующих параметров:
1) температуры системы, т. е. при её нагревании или охлаждении
2) давления в системе, т. е. при её сжатии или расширении
3) концентрации одного из участников обратимой реакции
Влияние концентрации:
Концентрация влияет на состояние равновесия следующим образом:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
CO + 2 H2 ⇌ CH3OH
В данной реакции выход метилового спирта будет больше при увеличении концентрации CO. Эффективность реакции также возрастёт при непрерывном удалении продуктов реакции.
Влияние температуры:
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. Для примера рассмотрим реакцию взаимодействия азота с водородом с образованием аммиака:
N2 + 3 H2 ⇌ 2 NH3 + Q,
где Q = 92 кДж на 1 моль.
Прямая реакция — экзотермическая, идущая с выделением тепла а обратная реакция — эндотермическая, требующая поглощения тепла.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции;
При понижении температуры химическое равновесие смещается в направлении экзотермической реакции.
Следовательно, в приведённой реакции по мере выделения тепла растёт температура, что снижает выход аммиака.
Влияние давления:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов реакции) с меньшим объемом;
При понижении давления равновесие сдвигается в направлении образования веществ с большим объемом;
При равенстве объёмов исходных веществ и продуктов реакции давление не влияет на равновесие реакции.
Рассмотрим снова реакцию азота с водородом:
N2 + 3 H2 ⇌ 2 NH3
Считая, что каждый моль газа при стандартных условиях занимает один и тот же объём, в левой части равенства имеем 4 объёма, а в правой части – два объёма. Таким образом, при переходе от исходных веществ к продукту реакции (аммиаку) объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3.
Влияние инертных газов:
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества моль газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
