Основные термины и положения термодинамики
Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от окружающей среды.
В зависимости от характера взаимодействия с окружающей средой термодинамические системы делятся на три типа:
1) изолированная – система, которая не обменивается с окружающей средой ни веществом, ни энергией;
2) замкнутая – система, которая может обмениваться с окружающей средой лишь энергией и не может обмениваться веществом;
3) открытая – система, которая обменивается с окружающей средой и энергией, и веществом.
Живые организмы являются открытыми системами: организм человека за 40 лет жизни потребляет в среднем 40 т воды, 6 т пищи и около 12 млн л кислорода.
Состояние любой термодинамической системы характеризуется двумя группами параметров:
Интенсивными термодинамическими параметрами (давление, температура и др.), не зависящими от массы или числа частиц в системе;
Экстенсивными термодинамическими параметрами (общая энергия, энтропия, внутренняя энергия), зависящими от массы или числа частиц в системе.
Изменение параметров термодинамической системы называется термодинамическим процессом.
Различают изотермические, изобарные, изохорные и адиабатические процессы.
Многие химические реакции протекают без каких-либо внешних воздействий, т.е. без поступления энергии извне. Такое течение реакций называют самопроизвольным, но есть реакции, которые без внешнего энергетического воздействия не протекают (обжиг известняка, синтез углеводов в хлоропластах листьев растений, разложение воды), такие реакции называют несамопроизвольными – вынужденными. Для любой системы переход из любого произвольно выбранного состояния в другое в одном направлении будет самопроизвольным, а в противоположном – вынужденным. Вопрос о том, в каком направлении процесс будет протекать самопроизвольно, а в каком нет – один из основных вопросов прикладной химии (например, биологической химии).
Энергиюсистемы (W) можно представить как совокупность двух частей: зависящую от движения и положения системы как целого (Wц) и не зависящую от этих факторов (U).
| W=Wц+ U | (1.1) |
Вторую составляющую этой совокупности U называют внутренней энергией системы.
Она включает энергию теплового движения частиц, а также химическую и ядерную энергию, определяющую поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов.
Внутренняя энергия в свою очередь разделяется на свободную энергию и связанную энергию.
Свободная энергия (G) – та часть внутренней энергии, которая может быть использована для совершения работы.
Связанная энергия (Wсв) – та часть энергии, которую нельзя превратить в работу.
| U = G + Wсв | (1.2) |
Потоки и Термодинамические силы.В термодинамических системах, в которых имеются градиенты температуры, концентраций компонентов, химических потенциалов, возникают необратимые процессы теплопроводности, диффузии, химических реакций.
Эти процессы характеризуются тепловыми и диффузионными потоками, скоростями химических реакций и т.д.
Они называются общим термином «потоки» и обозначаются Ji, а вызывающие их причины (отклонения термодинамических параметров от равновесных значений) — термодинамическими силами (Хк).
Связь между Ji и Хк, если термодинамические силы малы, записывают в виде линейных уравнений:
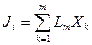 | (1.3) |
где i = 1, 2, …, m
