Кристаллическое строение металлов. Все твердые тела делятся на аморфные и кристаллические
Все твердые тела делятся на аморфные и кристаллические. В аморфных телах атомы расположены хаотично, т. е. в беспорядке, без всякой системы (например, стекло, клей, воск, канифоль и др.). Все металлы и сплавы имеют кристаллическое строение, т. е. атомы расположены в строго определенном порядке, с определенной геометрической закономерностью. (К кристаллическим телам относятся также поваренная соль, кварц, сахарный песок и др.)
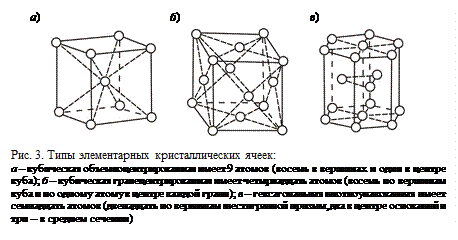 Если атомы металла мысленно соединить прямыми линиями, то получится правильная геометрическая система, называемая пространственной кристаллической решеткой. Из кристаллической решетки можно выделить элементарную кристаллическую ячейку, представляющую наименьший комплекс атомов, повторением которого в трех измерениях можно построить всю решетку.
Если атомы металла мысленно соединить прямыми линиями, то получится правильная геометрическая система, называемая пространственной кристаллической решеткой. Из кристаллической решетки можно выделить элементарную кристаллическую ячейку, представляющую наименьший комплекс атомов, повторением которого в трех измерениях можно построить всю решетку.
Наиболее распространены три типа элементарных кристаллических ячеек металлов (рис. 3): кубическая объемноцентрированная (хром, вольфрам, молибден, железо (до 910° и от 1400 до 1539°С), титан (при температурах свыше 882°С)), кубическая гранецентрированная (алюминий, медь, никель, свинец, золото, серебро, железо (при 910–1400°С)) и гексагональная (цинк, магний, бериллий, титан (до 882°С)).
Атомы металлов образуют кристаллические решетки благодаря наличию особой металлической связи. В узлах кристаллических решеток металлов расположены положительно заряженные ионы, удерживаемые на определенном расстоянии друг от друга свободными электронами. Такое внутреннее строение обусловливает характерные признаки металлов, такие, как электро- и теплопроводность, пластичность. Свойства металлов зависят не только от типа кристаллической решетки, но и от расстояния между атомами.
Геометрическая правильность расположения атомов в кристаллических решетках придает металлам особенности, которых нет у аморфных тел.
Первой особенностью металлов является анизотропия свойств кристаллов, т. е. различие свойств кристаллов в разных направлениях. Анизотропия объясняется неодинаковой плотностью атомов в разных плоскостях кристаллической решетки, так как расстояния между атомами в решетках в разных направлениях неодинаковы. В отличие от кристаллических тел аморфные тела изотропны, т. е. их свойства не зависят от направления.
У металлических тел анизотропия свойств не выражена так резко, как у отдельных кристаллов. Металлы являются поликристаллическими телами, т. е. они состоят не из одного, а из бесчисленного множества кристаллов, по-разному ориентированных. Произвольность ориентировки каждого кристалла приводит к тому, что в любом направлении располагается приблизительно одинаковое количество различно ориентированных кристаллов. В результате получается, что свойства поликристаллических тел будут в среднем одинаковы во всех направлениях. Это явление называется квазиизотропией (ложной изотропией).
Второй особенностью металлов как тел кристаллического строения является наличие у них плоскостей скольжения (спайности). По этим плоскостям происходит сдвиг или отрыв (разрушение) частиц кристаллов под действием внешних усилий. У аморфных тел смещение частиц происходит не по определенным плоскостям, а беспорядочно. Излом аморфного тела всегда имеет неправильную, искривленную форму.
Третьей особенностью металлов как тел кристаллического строения является то, что процесс перехода их из твердого состояния в жидкое и наоборот происходит при определенной температуре, называемой температурой плавления (затвердевания). Аморфные тела переходят в жидкое состояние постепенно и не имеют определенной температуры плавления.
