A) активтендіру энергиясының шамасын кемітеді
Теріс катализ қай шаманы қалай өзгертеді:
A) активтендіру энергиясының шамасын арттырады
Жылдамдық константасы қай шамаға тәуелсіз:
A) концентрация
Жылдамдыққа жанасу бетінің ауданы әсер ететін реакция:
A) ABC3(к) + 2DP(c) → AP2(c) + ↑BC2 + D2C(c)
Жылдамдыққа жанасу бетінің ауданы әсер ететін реакция:
A) Mg(OH)2↓ + H2SO4(с) ↔ MgSO4(с) + H2O(с)
∆t2/∆t1=32 ∆t=50o
A) 2
Мына реакция теңдеуіне әрекеттесуші массалар заңы бойынша жазылған жылдамдықтың теңдеуі қандай болады ?
2NaOH (c) + H2SO4 (c ) ↔ Na2 SO4 (c ) + 2 H2O (c)
A) V= KC2 (NaOH) ∙ C (H2SO4)
γ = 4 t1 = 20 t2 = 50 - ?
A) 64
γ = 3 t1 = 10 t2 = 40 - ?
A) 27
Әрекеттесуші массалар заңы бойынша жазылған жылдамдық формуласының қайсысы дұрыс:
Zn(қ) + 2H2SO4(конц.) = ZnSO4(c) + SO2(г) + H2O(c)
A) V = K C2 (H2SO4)
γ = 3 t2 = 500 t1 = 900, Vt1/Vt2 - ?
A) 81
Қай реакция қайтымды:
A) N2 + O2 →
Қай реакция аяғына дейін жүрмейді:
A) KCI + Na2SO4 →
Қысымның артуы қай тепе-теңдікті оңға ығыстырады:
A) 2SO2 + O2 ↔ 2SO3
Қай реакцияға қысымның өзгерісі әсер етпейді:
A) H2 + I2 ↔ 2HI (г)
Қай тепе теңдікті солға ығыстыру үшін қысымды арттыру қажет:
A) 2H2O(бу) ↔ 2H2 + O2
Қысымды кеміту қай тепе-теңдікті оңға ығыстырады:
A) 2Fe + H2O ↔ Fе2O3 + 4H2
Қысымды кеміту қай тепе теңдікті солға ығыстырады:
A) N2 + 3H2 ↔ 2NH3
1308. Тепе- теңдікті оңға ығыстыру үшін қай факторлар әсер етеді:
СаО + СO2 ↔ CaCO3 ∆Н < О
A) Температураны арттыру, қысымды төмендету t ↓ Р↓
B) Р↑ t ↓
Тепе- теңдікті солға ығыстыру үшін қай факторлар әсер етеді:N2O4(г) ↔ 2NO2 ∆Н > О
A) T↓P↑
Қысымды екі есе аррттырғанда тура реакция жылдамдығы кері реакцияныкінен неше есе артық болады:N2 + 3H2 ↔ 2NH3
A) 4
Қысымды үш есе арттырғанда тура реакция жылдамдығы кері реакцияныкінен неше есе кем болады:N2O4↔ 2NO2
A) 3
Егер жүйенің көлемін 2 есе кемітсек мына реакция үшін 2SO2 + O2 ↔ 2SO3
A) VT/VK = 2
Егер жүйенің көлемін арттырсақ мына реакция үшін:4HCI(г) + O2 ↔ 2H2O(г) + 2CI2
A) VK/VT = 3
Тепе-теңдікті оңға ығыстыру үшін қай факторлар әсер етеді:A(г) + B2C(с) ↔ 2B(г) +AC(с) - Q
A) C(A)↑(B2C)↑↑↑
Тепе-теңдікті оңға ығыстыру үшін қай факторлар әсер етеді:2A(г) + 3B(г) ↔ A2B3 (г) + Q
A) P↑T↓
Тепе - теңдікті оңға ығыстыру үшін қай факторлар әсер етеді:A2(г +) 2B2(г) ↔ 2AB2 + Q
A) C(B2)↑T↓
Тепе - теңдікті оңға ығыстыру үшін қай факторлар әсер етеді:ABD3(қ) ↔ AD(қ) + BD2(г) - Q
A) T↑P↓ 2А (г) + 3В (с)↔ 2Д (г) + Q
[А]=[B]=[D]=2 моль/л Кт-т-?
A) 0,125
Тепе - теңдікті константасының қайсысы дұрыс жазылған:C + H2O(г) ↔ CO + H2
A) 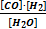
Тепе - теңдікті константасының қайсысы дұрыс жазылған:2SO2 + H2O(г) ↔ SO + H2
A) R = 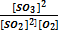
Vt2/Vt1=32 ∆t=50o
A) 2
Тепе-теңдік орнағанда концентрациялары белгілі болса, А2 затының бастапқы концентрациясын есептеңдер. A2(г) + B2(г) ↔ 2AB(г)
[A2] = 0,075 моль\л [B2] = 0,005моль\л [AB] = 0,08 моль\л
A) 0,115
Тепе-теңдік орнағанда концентрациялары белгілі болса, О2 затының бастапқы концентрациясын есептеңдер. A2(г) + B2(г) ↔ 2AB(г)
[SO2] = 3 моль\л [O2] = 3 моль\л [SO3] = 5 моль\л
A) 5,5
А2B2 - затының 20% жұмсалғаннан кейін тепе-теңдік орнаса, C0 (A3B2) = 0,4 моль/л болса тепе - теңдік константасын есепте. A3B2 ↔ 3А + 2В
A) 1,1 ∙ 10-8
A(c) + B(c) ↔ D(c) + P(c) Реакцияның тепе - теңдік константасы 1- ге тең C0(A) = 6 моль, Co(B) = 8 моль/л болса, В – затынан қанша пайызы жұмсалған?
A) 31,25
Ерітіндідегі заттың эквивалентінің молярлы концентрациясының формуласы:
A) 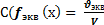
Ерітіндідегі заттың массалық үлесін анықтайтын формула:
A) W(х) → 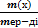
Ерітіндідегі заттың моляльды концентрациясының формуласы:
A) Cm = 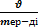
Ерітіндідегі заттың молярлы концентрациясының формуласы:
A) C(х) = 
Ерітіндінің тығыздығын анықтайтын формула:
A) 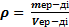
Ерітіндінің титрін анықтайтын формула:
A) T = 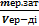
Ерігіштіктің мәні бойынша қандай ерітінді анықтауға болады:
A) қаныққан
Қанықпаған ерітіндіні қанықтыру үшін не істеуге болады:
A) зат салу
Қаныққан ерітіндіні қанықпаған ерітіндіге айналдыру үшін не істеуге болады:
A) зат салу
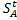 = 30гА/100 г Н2О. Массасы 260 г қанық ерітінді әзірлеу үшін қанша А заты (г) қажет.
= 30гА/100 г Н2О. Массасы 260 г қанық ерітінді әзірлеу үшін қанша А заты (г) қажет.
A) 60
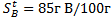 Н2О. Массасы 170г В затынан қанша қаныққан ерітінді әзірлеуге болады:
Н2О. Массасы 170г В затынан қанша қаныққан ерітінді әзірлеуге болады:
A) 370
Бір молярлы тұз қышқылының титрін анықта ?
A) 0,0365
Массасы 300г еріген заттың массалық үлесі 0,2 болатын ерітінді әзірлеу үшін қанша (г) еріткіш қанша (г) зат қажет:
A) 240, 60
Көлемі 150 мл, тығыздығы 1,25 г/мл 20%-дық ерітінді әзірлеуге қанша (г) зат қажет:
A) 37,5
Концентрациясы 3 молярлы H2SO4 –тің эквивалентінің молярлы концентрациясы қандай?
A) 6
Көлемі 300 мл тығыздығы 1,42 г/мл 38% - дың ерітіндіге 100 мл су құйылғаннан кейінгі еріген заттың массалық үлесі қандай болады?
A) 0,31
Массасы 420г еріген заттың массалық үлесі 0,18 болатын ерітіндіден 100 мл су буланып кеткеннен кейінгі ерітіндідегі заттың массалық үлесі қандай болады:
A) 0,236
Көлемі 0,25л еріген заттың концентрациясы 0,05 моль/л болатын күкірт қышқылының ерітіндісін әзірлеу үшін қанша зат қажет:
A) 1,225
Еріген натрий сульфатының концентрациясы 0,32 моль/л болатын ерітіндінің титрі қандай:
A) 0,045
Концентрациясы 0,5 моль/л болатын фосфор қышқылының ерітіндісіндегі эквивалентінің мольдік концентрациясы қандай?
A) 0,150
Еріген күміс нитратының молялды концентрациясы 0,02 моль/л болса, ол неше пайыздық ерітінді болғаны:
A) 0,355
Титрді өлшем бірлігімен қай шаманың өлшем бірлігі бірдей:
A) 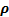
Молярлы концентрацияның өлшем бірлігімен қай шаманыкі бірдей:
A) С(f(х))
Егер қатты заттың ерігіштігі температура артқан сайын артатын болса, қанықпаған ерітіндіні қаныққанға айналдыру үшін не істеу керек:
