Алмаз в материнской породе Структура алмаза
УГЛЕРОД
Углерод (лат. Carboneum), С –– химический элемент IV группы периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107 а.е.м. Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей (ёмкость для нагрева, высушивания, сжигания, обжига или плавления различных материалов) и карандашей. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. Латинское название сarboneum углерод получил от сarbo — уголь.
Аллотропные модификации углерода
Кристаллический углерод
Алмаз
Алмаз – кубическая аллотропная модификация углерода. При нормальных условиях метастабилен, т.е. может существовать неограниченно долго. В вакууме или в инертном газе при повышенных температурах постепенно переходит в графит

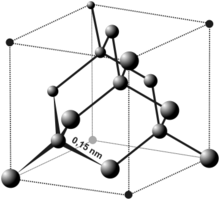
Алмаз в материнской породе Структура алмаза
Физико-механические свойства
Главные отличительные черты алмаза — высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твёрдых тел 900—2300 Вт, большие показатель преломления (величина, равная отношению фазовых скоростей света (электромагнитных волн) в вакууме и в данной среде 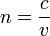 ) и дисперсия (Способность кристаллов разлагать белый свет на отдельные составляющие. Для алмаза дисперсия равна 0,063). Алмаз является диэлектриком. У алмаза очень низкий коэффициент трения по металлу на воздухе — всего 0,1, что связано с образованием на поверхности кристалла тонких плёнок адсорбированного газа, играющих роль своеобразной смазки. Когда такие плёнки не образуются, коэффициент трения возрастает и достигает 0,5—0,55. Высокая твёрдость обусловливает исключительную износостойкость алмаза на истирание. Для алмаза также характерны самый высокий (по сравнению с другими известными материалами) модуль упругости и самый низкий коэффициент сжатия
) и дисперсия (Способность кристаллов разлагать белый свет на отдельные составляющие. Для алмаза дисперсия равна 0,063). Алмаз является диэлектриком. У алмаза очень низкий коэффициент трения по металлу на воздухе — всего 0,1, что связано с образованием на поверхности кристалла тонких плёнок адсорбированного газа, играющих роль своеобразной смазки. Когда такие плёнки не образуются, коэффициент трения возрастает и достигает 0,5—0,55. Высокая твёрдость обусловливает исключительную износостойкость алмаза на истирание. Для алмаза также характерны самый высокий (по сравнению с другими известными материалами) модуль упругости и самый низкий коэффициент сжатия
Температура плавления алмаза составляет 3700—4000 °C при давлении 11 ГПа. На воздухе алмаз сгорает при 850—1000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в конечном счёте в углекислый газ. При нагреве до 2000°C без доступа воздуха алмаз переходит в графит за 15-30 минут. Средний показатель преломления бесцветных кристаллов алмаза в жёлтом цвете равен примерно 2,417, а для различных цветов спектра он варьируется от 2,402 (для красного) до 2,465 (для фиолетового).
Одним из важных свойств алмазов является люминесценция. Под действием солнечного света и особенно ультрафиолетовых и рентгеновских лучей алмазы начинают люминесцировать — светиться различными цветами. Под действием катодного и рентгеновского излучения светятся все разновидности алмазов, а под действием ультрафиолетового — только некоторые. Рентгенолюминесценция широко применяется на практике для извлечения алмазов из породы.
Большой показатель преломления, наряду с высокой прозрачностью и достаточной дисперсией показателя преломления (игра цвета) делает алмаз одним из самых дорогих драгоценных камней (наряду с изумрудом и рубином, которые соперничают с алмазом по цене). Алмаз в естественном виде не считается красивым. Красоту придаёт алмазу огранка, создающая условия для многократных внутренних отражений. Огранённый алмаз называется бриллиантом.
Структура
Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза.
Диагностика алмаза
Для того, чтобы отличить настоящий алмаз от его имитации, используется специальный «алмазный щуп», измеряющий теплопроводность исследуемого камня. Алмаз имеет намного более высокое значение теплопроводности, чем его заменители. Кроме того, используется хорошая смачиваемость алмаза жиром: фломастер, заправленный специальными чернилами, оставляет на поверхности алмаза сплошную черту, тогда как на поверхности имитации она рассыпается на отдельные капельки
Нахождение алмазов в природе

Бриллиант
Алмаз — редкий, но вместе с тем довольно широко распространённый минерал. Промышленные месторождения алмазов известны на всех континентах, кроме Антарктиды. Известно несколько видов месторождений алмазов. Уже несколько тысяч лет назад алмазы в промышленных масштабах добывались из россыпных месторождений. Только к концу XIX века, когда впервые были открыты алмазоносные кимберлитовые трубки, стало ясно, что алмазы не образуются в речных отложениях.
О происхождении и возрасте алмазов до сих пор нет точных научных данных. Учёные придерживаются разных гипотез: магматической, мантийной, метеоритной, флюидной, есть даже несколько экзотических теорий. Большинство склоняются к магматической и мантийной теориям, к тому, что атомы углерода под большим давлением (как правило, 50000 атмосфер) и на большой (примерно 200 км) глубине формируют кубическую кристаллическую решётку — собственно алмаз. Камни выносятся на поверхность вулканической магмой во время формирования так называемых «трубок взрыва».
Возраст алмазов, по данным некоторых исследований, может быть от 100 миллионов до 2,5 миллиардов лет.
Известны метеоритные алмазы, внеземного, возможно — досолнечного, происхождения. Алмазы также образуются при ударном метаморфизме при падении крупных метеоритов, например, в Попигайской астроблеме на севере Сибири.
Кроме этого, алмазы были найдены в кровлевых породах в ассоциациях метаморфизма сверхвысоких давлений, например в Кумдыкульском месторождении алмазов на Кокчетавском массиве в Казахстане.
И импактные (ударные), и метаморфические алмазы иногда образуют весьма масштабные месторождения, с большими запасами и высокой концентрацией. Но в этих типах месторождений алмазы мелки настолько, что не имеют промышленной ценности.
Синтетические алмазы
Предпосылки и первые попытки
В 1694 году итальянские учёные Дж. Аверани и К.-А. Тарджони при попытке сплавить несколько мелких алмазов в один крупный обнаружили, что при сильном нагревании алмаз сгорает, как уголь. В 1772 году Антуан Лавуазье установил, что при сгорании алмаза образуется диоксид углерода. В 1814 году Гемфри Дэви и Майкл Фарадей окончательно доказали, что алмаз является химическим родственником угля и графита.
Открытие натолкнуло учёных на мысль о возможности искусственного создания алмаза. Первая попытка синтеза алмаза была предпринята в 1823 году основателем Харьковского университета Василием Каразиным, который при сухой перегонке древесины при сильном нагреве получил твёрдые кристаллы неизвестного вещества. В 1893 году профессор К. Д. Хрущов при быстром охлаждении расплавленного серебра, насыщенного углеродом, также получил кристаллы, царапавшие стекло и корунд. Его опыт был успешно повторён Анри Муассаном, заменившим серебро на железо. Позже было установлено, что в этих опытах синтезировался не алмаз, а карбид кремния (муассани́т), который имеет очень близкие к алмазу свойства.
В 1879 году шотландский химик Джеймс Хэнней обнаружил, что при взаимодействии щелочных металлов с органическими соединениями происходит выделение углерода в виде чешуек графита и предположил, что при проведении подобных реакций в условиях высокого давления углерод может кристаллизоваться в форме алмаза. После ряда экспериментов, в которых смесь парафина, костяного масла и лития длительное время выдерживалась в запаянной нагретой до красного каления стальной трубе, ему удалось получить несколько кристаллов, которые после независимого исследования были признаны алмазами. В научном мире его открытие не было признано, так как считалось, что алмаз не может образовываться при столь низких давлениях и температурах. Повторное исследование образцов Хэннея, проведённое в 1943 году с применением рентгеновского анализа, подтвердило, что полученные кристаллы являются алмазами, однако профессор К. Лонсдейл, проводившая анализ, вновь заявила, что эксперименты Хэннея являются мистификацией.
Синтез

Изображение синтетических алмазов, полученное на растровом электронном микроскопе
В 1961 г., основываясь на научных результатах в синтезе алмазов, полученных в Московском институте физики высоких давлений АН СССР группой исследователей под руководством Л. Ф. Верещагина, Валентин Николаевич Бакуль в Киеве в ЦКТБ твердосплавного и алмазного инструментана организовал выпуск первых 2000 карат искусственных алмазов; с 1963 г. налажен их серийный выпуск.
В 1961 году появились первые публикации о реализации идей получения алмаза путём прямого фазового перехода из графита. Синтез производился с использованием энергии взрыва, или непосредственно из продуктов взрыва некоторых взрывчаток, с отрицательным кислородным балансом (работы Шабалина), особенно удобен для получения алмазов тротил. Это наиболее дешёвый способ получения алмазов, однако, «взрывные алмазы» очень маленькие и пригодны лишь для абразивов и напылений.
В настоящее время существует крупное промышленное производство синтетических алмазов, которое обеспечивает потребности в абразивных материалах. Для синтеза используется несколько способов. Один из них состоит в подготовке высокоуглеродистого сплава никель-марганец и его охлаждении под давлением в формах из твёрдого сплава. Выкристаллизовавшиеся мелкие алмазы отделяют после растворения металлической матрицы в смеси кислот.
Современные способы получения алмазов используют газовую среду, состоящую из 95 % водорода и 5 % углеродсодержащего газа (пропана, ацетилена), а также высокочастотную плазму, сконцентрированную на подложке, где образуется сам алмаз. Температура газа от 700—850 °C при давлении в тридцать раз меньше атмосферного. В зависимости от технологии синтеза, скорость роста алмазов от 7 до 180 мкм/час на подложке. При этом алмаз осаждается на подложке из металла или керамики при условиях, которые в общем стабилизируют не алмазную (sp3) а графитную (sp2) форму углерода. Стабилизация алмаза объясняется в первую очередь кинематическими процессами на поверхности подложки. Принципиальным условием для осаждения алмаза является возможности подложки образовывать стабильные карбиды (в том числе и при температурах осаждения алмаза: между 700 °C и 900 °C). Так, например, осаждение алмаза возможно на подложках из Si, W, Cr и невозможно (напрямую, либо только с промежуточными слоями) на подложках из Fe, Co, Ni.
Применение
Огранённый алмаз (бриллиант) уже многие столетия является популярнейшим и дорогим драгоценным камнем. В то время как цена других драгоценных камней определяется модой и постоянно меняется, алмаз остаётся островком стабильности на бурном рынке драгоценностей. В значительной степени такое устойчивое положение алмаза обусловлено высокой монополизацией этого рынка. Фирма «Де Бирс», на долю которой приходится около 50 % мировой добычи, разрабатывает месторождения Ботсваны, ЮАР, Намибии и Танзании. Подавляющая часть (по стоимости) природных алмазов используется для производства бриллиантов.
Исключительная твёрдость алмаза находит своё применение в промышленности: его используют для изготовления ножей, свёрл, резцов и тому подобных изделий. Потребность в алмазе для промышленного применения вынуждает расширять производство искусственных алмазов. В последнее время проблема решается за счёт кластерного и ионно-плазменного напыления алмазных плёнок на режущие поверхности. Алмазный порошок (как отход при обработке природного алмаза, так и полученный искусственно) используется как абразив для изготовления режущих и точильных дисков, кругов и т. д.Также применяются в квантовых компьютерах, в часовой и ядерной промышленности.
Крайне перспективно развитие микроэлектроники на алмазных подложках. Уже есть готовые изделия, обладающие высокой термо- и радиационной стойкостью. Также перспективно использование алмаза, как активного элемента микроэлектроники, особенно в сильноточной и высоковольтной электронике из-за большой величины пробивного напряжения и высокой теплопроводности. При изготовлении полупроводниковых приборов на основе алмаза используются, как правило, допированные плёнки алмаза. Так, допированный бором алмаз, имеет p-тип проводимости, фосфором — n-тип. Из-за большой ширины зоны алмазные светодиоды работают в ультрафиолетовой области спектра.
В 2004 году впервые синтезировали алмаз, имеющий сверхпроводящий переход при температуре 2-5 К (зависит от степени легирования). Полученный алмаз представлял собой сильнолегированный бором поликристаллический образец. Позже в Японии получили алмазные плёнки, переходящие в сверхпроводящее состояние при температурах 4-12К . Пока сверхпроводимость алмаза представляют интерес лишь с научной точки зрения.
Графен

Рис. 1. Идеальная кристаллическая структура графена представляет собой гексагональную кристаллическую решётку.
Графе́н — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в sp²-гибридизации и соединённых посредством σ- и π-связей в гексагональную двумерную кристаллическую решётку. Его можно представить как одну плоскость графита, отделённую от объёмного кристалла. По оценкам, графен обладает большой механической жёсткостью и хорошей теплопроводностью. Высокая подвижность носителей заряда (максимальная подвижность электронов среди всех известных материалов) делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Основной из существующих в настоящее время способов получения графена в условиях научных лабораторий основан на механическом отщеплении или отшелушивании слоёв графита от высокоориентированного пиролитического графита. Он позволяет получать наиболее качественные образцы с высокой подвижностью носителей. Этот метод не предполагает использования масштабного производства, поскольку это ручная процедура. Другой известный способ — метод термического разложения подложки карбида кремния — гораздо ближе к промышленному производству. Поскольку графен впервые был получен только в 2004 году, он ещё недостаточно хорошо изучен и привлекает к себе повышенный интерес.
Из-за особенностей энергетического спектра носителей графен проявляет специфические, в отличие от других двумерных систем, электрофизические свойства.
За «передовые опыты с двумерным материалом - графеном» А. К. Гейму и К. С. Новосёлову была присуждена Нобелевская премия по физике за 2010 год.
Было получено аналогичное соединение для кремния (силицен).
Графит

Графит –минерал из класса самородных элементов, одна из аллотропных модификаций углерода
Физические свойства
Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1—2 по шкале Мооса). Плотность2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. В кислотах не растворяется. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Теплопроводность графита от 278,4 до 2435 Вт/(м*К), зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном - в сотни раз меньше. Минимальное значение проводимости наблюдается в интервале 300-1300 К, причем положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Химические свойства
Со многими веществами (щелочными металлами, солями) образует соединения включения.
Реагирует при высокой температуре с воздухом, сгорая до углекислого газа. Фторированием в контролируемых условиях можно получить (CF)x.
Структура
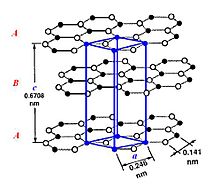
α-графит
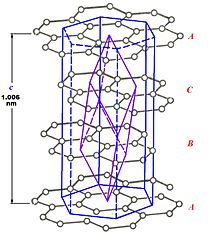
β-графит
Каждый атом углерода ковалентно связан с тремя другими окружающими его атомами углерода.
Различают две модификации графита: α-графит (гексагональный) и β-графит (ромбоэдрический).
Условия нахождения в природе
Сопутствующие минералы: пирит, гранаты, шпинель. Образуется при высокой температуре в вулканических и магматических горных породах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). С помощью ионной масс-спектрометрии российским учёным удалось обнаружить в составе графита золото, серебро и платиноиды (платина, палладий, иридий, осмий и проч.) в форме металлоорганических нанокластеров.
Искусственный синтез
Искусственный графит получают разными способами:
Ачесоновский графит: нагреванием смеси кокса и пека (смола) до 2800°C;.
Рекристаллизованный графит: термомеханической обработкой смеси, содержащей кокс, пек, природный графит и карбидообразующие элементы.
Пирографит: пиролизом из газообразных углеводородов при температуре 1400—1500°C в вакууме с последующим нагреванием образовавшегося пироуглерода до температуры 2500—3000 °C при давлении 50 МПа (образовавшийся продукт — пирографит; в электротехнической промышленности применяется наименование «электрографит»).
Доменный графит: выделяется при медленном охлаждении больших масс чугуна.
Карбидный графит: образуется при термическом разложении карбидов.
Применение
Использование графита основано на ряде его уникальных свойств.
для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов
электродов, нагревательных элементов — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
Для получения химически активных металлов методом электролиза расплавленных соединений. В частности, при получении алюминия используются сразу два свойства графита:
1. Хорошая электропроводность, и как следствие — его пригодность для изготовления электрода
2. Газообразность продукта реакции, протекающей на электроде — это углекислый газ. Газообразность продукта означает, что он выходит из электролизёра сам, и не требует специальных мер по его удалению из зоны реакции. Это свойство существенно упрощает технологию производства алюминия.
твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках
наполнитель пластмасс
замедлитель нейтронов в ядерных реакторах
компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином)
для получения синтетических алмазов
для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов, а также прочих устройств, где требуется надёжный подвижный электрический контакт.
как токопроводящий компонент высокоомных токопроводящих клеёв
Лонсдейлит
Лонсдейлит или алмаз гексагональный - одна из аллотропных модификаций углерода. Открыт в 1966. Одновременно он обнаружен в природе, в метеоритном кратере. В настоящее время группе американских и китайских ученых удалось доказать, что самый твердый на сегодняшний день материал — специально обработанный лонсдейлит. Он оказался на 58 процентов тверже алмаза.
Свойства
Является одним из самых твёрдых из известных веществ, на 58 % превосходящем по жёсткости алмаз (лонсдейлит может выдержать нагрузку в 152 ГПа, в то время как алмаз — всего в 97 ГПа), однако маловероятно практическое использование из-за сложности его получения.
Под давлением атомы в решётке лонсдейлита перестраиваются таким образом, что объём образца остается неизменным, а его жёсткость увеличивается.
Получение
По мнению учёных, лонсдейлит формируется в момент столкновения метеорита с землей из графита, входящего в состав метеорита. Под действием очень больших температур и давления происходит превращение графита в алмаз, но при этом гексагональная решётка графита сохраняется. В течение долгого времени лонсдейлит получали исключительно из графита путём колоссального сжатия, но позже было доказано, что «гексагональный алмаз» также может быть получен из кубического алмаза.
Карбин
Карбин — аллотропная форма углерода на основе sp-гибридизации углеродных атомов. Состоит из углеродных фрагментов с тройной –С≡С–С≡С–, или двойной =С=С=С=С= связью. Может быть линейным или образовывать циклические структуры.
Свойства
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полииновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР (ИНЭОС). Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Предыстория открытия
Вопрос о возможности существования форм углерода с sp-гибридизацией атомов неоднократно рассматривался теоретически. Ещё в 1885 году немецкий химик Адольф Байер пытался синтезировать цепочечный углерод из производных ацетилена ступенчатым методом. Однако попытка Байера получить полиин (соединение, содержащие в молекуле не менее трех изолированных или сопряженных связей С≡С) оказалась неудачной, он получил углеводород, состоящий из четырех молекул ацетилена, соединенных в цепочку, и оказавшийся чрезвычайно неустойчивым. Неустойчивость низших полиинов послужила Байеру основанием для создания теории напряжения, в которой он постулировал невозможность получения цепочечного углерода. Авторитет ученого охладил интерес исследователей к синтезу полиинов, и работы в этом направлении надолго прекратились.
Одномерная (линейная) форма углерода долгое время оставалась недостающим звеном в аллотропии углерода. Важным стимулом для возобновления работ в этой области явилось открытие в 1930-е годы представителей полиацетиленового ряда в природе. В некоторых растениях и низших грибах были обнаружены соединения полиинового ряда, содержащие до пяти сопряженных ацетиленовых группировок. Одними из первых, кто решился бросить вызов авторитету предшественников, стали заведующий лабораторией высокомолекулярных соединений ИНЭОС Василий Владимирович Коршак и Алексей Михайлович Сладков. Проведённая ими работа привела к открытию новой линейной аллотропной формы углерода.
В 1959–1960 годах в лаборатории высокомолекулярных соединений ИНЭОС, возглавляемой академиком Коршаком, проводились систематические исследования реакции окислительного сочетания диацетиленовых соединений. Было установлено, что в присутствии солей двухвалентной меди эта реакция может быть проведена с любыми диацетиленовыми соединениями с образованием полимеров, элементарное звено которых сохраняет углеродный скелет исходного диацетилена. При этом сначала образуются полимерные полиацетилениды Cu(I). Этот вариант реакции окислительного сочетания был назван окислительной дегидрополиконденсацией. Ученые предположили, что в качестве мономера для такой поликонденсации можно взять и ацетилен. Действительно, при пропускании ацетилена в водно-аммиачный раствор соли Cu(II) быстро выпадал черный осадок. Именно этот путь привёл А.М.Сладкова, В.В.Коршака, В.И.Касаточкина и Ю.П.Кудрявцева к открытию линейной формы углерода, которую они, по предложению Сладкова, назвали «карбин».
По словам первооткрывателей карбина, самым сложным для них было определить, какими же связями соединены в цепочку углеродные атомы. Это могли быть чередующиеся одинарные и тройные связи (–С≡С–С≡С–), только двойные связи (=С=С=С=С=), или и те, и другие одновременно. Лишь через несколько лет удалось доказать, что в полученном карбине двойных связей нет. Подтверждением полиинового строения цепочек послужило образование щавелевой кислоты при озонировании карбина.
Однако теория допускала существование и углеродного линейного полимера только с двойными связями, который и был получен в 1968 году аспиранткой Сладкова В.П.Непочатых: встречный синтез (восстановлением полимерного гликоля) привёл к образованию линейного полимера углерода с кумуленовыми (двойная связь углерод-углерод) связями, который назвали поликумуленом. Доказательством наличия двойных связей в полученном веществе стал тот факт, что при озонировании поликумулена получается только диоксид углерода.
Итак, были получены две формы линейного углерода: полииновая (–С≡С–)n, или α-карбин, и поликумуленовая (=С=С=)n, или β-карбин. Авторами открытия было проведено детальное исследование структуры карбина различными методами, изучены его термодинамические и электрофизические свойства.
Структура карбина
По мнению некоторых исследователей, однозначных и строгих доказательств индивидуальности карбина и его строения до сих пор не получено, другие же авторы, наоборот, считают, что такие доказательства имеются. Дискуссия по поводу существования карбина во многом обусловлена тем, что диагностика его имеет ряд технических сложностей, поскольку при использовании высокоэнергетических методов возможен переход карбина в другие формы углерода. К тому же представления о структуре карбина долгое время отличались несовершенством. Авторы открытия карбина предложили модель его кристаллической структуры в виде совокупности цепочек кумуленового или полиинового типа, упакованных в кристаллы за счет вандерваальсовых сил ( силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль). Цепочки полагались прямолинейными, поскольку каждый атом углерода находится в состоянии sp-гибридизации.
Действительно, к настоящему времени установлено, что структуру карбина образуют атомы углерода, собранные в цепочки двойными связями (β-карбин) или чередующимися одинарными и тройными связями (α-карбин). Полимерные цепочки имеют химически активные концы (т. е. несут локализованный отрицательный заряд) и изгибы с цепочечными вакансиями, в местах которых цепочки соединяются между собой за счет перекрывания π-орбиталей атомов углерода. Важное значение для образования сшивок имеет присутствие таких примесей металлов, как железо, калий. Убедительное свидетельство наличия зигзагов в линейной углеродной цепочке было получено в теоретической работе Коршака: результаты его расчета хорошо согласуются с ИК-спектром карбина.
На основании результатов дальнейших исследований структуры кристаллического карбина была предложена модель его элементарной ячейки. Согласно этой модели элементарная ячейка карбина составлена параллельными цепочками углерода, имеющими зигзаги, благодаря которым ячейка оказывается двуслойной. Толщину одного слоя составляет цепочка из шести атомов углерода. В нижнем слое цепочки плотно упакованы и расположены в центре и по углам гексагона, тогда как в верхнем слое центральная цепочка отсутствует, а в образовавшейся вакансии могут располагаться атомы примеси. Возможно, что они являются катализаторами кристаллизации карбина. Такая модель дает ключ к раскрытию феномена карбина и объясняет, в какой конфигурации может стабилизироваться в общем случае неустойчивая совокупность линейных цепочек углерода.
Аморфный углерод
Антрацит
Антраци́т (от лат. anthracites, из др.-греч. ἄνθραξ «уголь; карбункул») — самый древний из ископаемых углей, уголь наиболее высокой степени углефикации (метаморфизма).
Лучший сорт каменного угля, отличающийся черным цветом, сильным блеском, большой теплотворной способностью.
Высшая разновидность угля – твердого горючего полезного ископаемого, образованного из растительных остатков растений в результате гумификации и углефикации.
Уголь чёрно-серого цвета с металлическим блеском, твёрдый, высокой плотности и высокой электропроводности. В западных странах принято следующее деление ископаемых углей на группы: лигниты, суббитуминозные угли, битуминозные угли, антрациты. Иногда к углям относят графит.
Антрацит может рассматриваться как переходная стадия между каменным углем и графитом. Чаще всего месторождения антрацита встречаются в районах, которые подвергались значительным движениям земной коры, таким как отроги горных хребтов. В процессе углефикации захороненный в недрах Земли торф последовательно превращается (при соответствующих условиях) сначала в бурый, затем в каменный уголь и антрацит
От других видов угля антрацит отличается высоким содержанием связанного углерода (91-98%), низким содержанием влаги, серы, летучих веществ, высокой удельной теплотой сгорания. Антрацит горит быстро, без дыма и пламени, с высокой теплоотдачей, не спекается. Обладает высокой плотностью органической массы (1500-1700 кг/м³) и высокой электропроводностью. Твёрдость по минералогической шкале 2,0-2,5
Сажа
Сажа — аморфный углерод, продукт неполного сгорания или термического разложения углеводородов в неконтролируемых условиях. В больших количествах её используют для приготовления чёрной краски в полиграфической и лакокрасочной промышленности. Во Франции во времена Карла II с использованием сажи изготовляли ваксу.
Термин «сажа» иногда неточно применяют для наименования углеродного продукта ― технического углерода, производимого в промышленных масштабах для наполнения резин и пластических масс.
Получение
По способу производства сажи делят на три группы: канальные, печные и термические.
1. Канальные (диффузионные) сажи получают при неполном сжигании природного газа или его смеси с маслом (например, антраценовым) в так называемых горелочных камерах, снабженных щелевыми горелками. Внутри камер расположены охладительные поверхности, на которых сажа осаждается из диффузионного пламени.
2. Печные сажи получают при неполном сжигании масла, природного газа или их смеси в факеле, создаваемом специальным устройством в реакторах (печах). Сажа в виде аэрозоля выносится из реактора продуктами сгорания, и улавливается специальными фильтрами.
3. Термические сажи получают в специальных реакторах при термическом разложении природного газа без доступа воздуха.
Вред
Сажа входит в категорию частиц опасных для лёгких, так как частицы менее пяти микрометров в диаметре не отфильтровываются в верхних дыхательных путях. Дым от дизельных двигателей, состоящий в основном из сажи, считается особенно опасным из-за того, что его частицы приводят к раку.
Распространение в природе
Среднее содержание углерода в земной коре 2,3*10-2 % по массе (1*10 –2 в ультраосновных (широко распространены в мантии), 1*10–2 в основных, 2*10 –2 в средних, 3*10–2 в кислых горных породах).
В верхней части земной коры (биосфере) углерода накапливается: в живом веществе 18 %, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит, часть углерода литосферы сосредоточена в известняках и доломитах.
Число собственных минералов углерода - 112; исключительно велико число органических соединений углерода - углеводородов и их производных. С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д.
По сравнению со средним содержанием в земной коре, человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии. Углерод широко распространён также в космосе: на Солнце он занимает 4-е место после водорода, гелия и кислорода.
