Организация лабораторных занятий
Лабораторные работы по количественному химическому анализу выполняются индивидуально. К выполнению лабораторной работы допускаются студенты, которые:
P составили письменные отчеты и защитили ранее выполненные работы;
P прошли инструктаж по технике выполнения лабораторной работы;
P сдали допуск по теоретическим вопросам (устное собеседование с преподавателем).
Студенты, не оформившие отчеты и не защитившие более двух работ, не допускаютсяк выполнению последующих лабораторных работ.
Лабораторные работы считаются выполненными успешно, если полученный студентом результат в пределах допустимой погрешности совпадает с истинным значением.
После выполнения каждого цикла работ проводится проверка усвоения теоретического материала – коллоквиум. К сдаче коллоквиума допускаются студенты, которые выполнили все лабораторные работы цикла, сдали и защитили индивидуальное задание по соответствующему разделу. Студенты, не сдавшие коллоквиум по предыдущему разделу, к выполнению последующих лабораторных работ не допускаются.
2. ГРАВИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
2.1. Основные положения
Сущность гравиметрии заключается в точном измерении массы определяемого компонента, выделенного в свободном состоянии или в виде соединения определенного состава. Наибольшее распространение в аналитической практике получила гравиметрия по методу осаждения. В методе осаждения определяемый компонент выделяют в виде малорастворимого соединения, которое после соответствующей обработки (фильтрование, промывание, высушивание или прокаливание) взвешивают.
Процесс образования осадков протекает в несколько стадий. При этом различают три параллельно протекающих процесса:
ü образование центров кристаллизации (первичных кристаллов);
ü рост кристаллов;
ü агрегация кристаллов.
Число и размер частиц осадка зависят от соотношения скорости образования центров кристаллизации и скорости роста кристаллов. Скорости обоих процессов определяются величиной относительного пересыщения Q:
Q = (С – S)/S,
где С – концентрация осаждаемого вещества в растворе, получаемая в момент внесения осадителя; S – растворимость.
При небольшом значении Q преимущественно происходит рост кристаллов и образуются крупнокристаллические осадки. Поэтому для получения крупнокристаллических осадков увеличивают растворимость S (повышение температуры растворов) или уменьшают концентрацию С (разбавление растворов, медленное добавление осадителя, перемешивание растворов). С увеличением относительного пересыщения процесс образования центров кристаллизации подавляет рост кристаллов, в результате чего образуется мелкодисперсный осадок. При выдерживании кристаллического осадка в контакте с маточным раствором происходит процесс старения (созревания) осадка, заключающийся в растворении мелких кристаллов и упорядочении роста крупных кристаллов.
С учетом механизма образования необходимо соблюдать оптимальные условия осаждения кристаллических осадков:
1) проводить осаждение из разбавленных растворов;
2) осадитель добавлять медленно, по каплям (особенно в начале осаждения), при интенсивном перемешивании;
3) проводить осаждение из горячих растворов;
4) оставлять осадок на «старение».
Образование аморфных осадков происходит в том случае, если растворимость осадков очень мала. При добавлении небольших количеств осадителя в системе образуются коллоидные растворы – диспергированные в растворе твердые частицы осаждаемого вещества размером 10–5 – 10–7 см. После образования твердой частицы осадка на ее поверхности адсорбируются ионы, входящие в состав малорастворимого соединения (первичный адсорбционный слой). В результате коллоидная частица приобретает положительный или отрицательный заряд. Под действием электростатических сил вокруг такой заряженной частицы образуется слой противоионов, часть которых прочно связана с первичным адсорбционным слоем, а часть находится в диффузном слое. Благодаря наличию двойного электрического слоя (первичного адсорбционного и противоионов) коллоидные частицы отталкиваются друг от друга. Другим фактором устойчивости коллоидных систем является сольватация, т. е. адсорбция молекул растворителя на поверхности коллоидных частиц.
Наличие двойного электрического слоя и сольватных оболочек препятствует процессу коагуляции – соединению коллоидных частиц в более крупные агрегаты и выпадению осадка. Коагуляции способствуют:
ü добавление сильных электролитов;
ü механическое воздействие (перемешивание, ультразвук);
ü воздействие электрического поля;
ü нагревание.
Роль перечисленных факторов заключается в разрушении сольватных оболочек и двойного электрического слоя вокруг частиц осадка. С учетом вышесказанного определены оптимальные условия осаждения аморфных осадков:
1) осаждать из концентрированных растворов концентрированным раствором осадителя;
2) осаждать из горячих растворов;
3) осаждать в присутствии электролита-коагулянта (лучше использовать летучие соли аммония);
4) осадитель добавлять быстро;
5) не оставлять на «старение» (во избежание загрязнения посторонними ионами за счет высокой удельной поверхности).
Для уменьшения адсорбированных примесей осадки промывают, используя промывные жидкости. В зависимости от природы образующегося осадка в состав промывных жидкостей должны входить:
ü электролиты-коагулянты (для аморфных осадков);
ü электролиты, содержащие одноименные с осадком ионы (для кристаллических осадков).
Результаты гравиметрических определений чаще всего выражают как массу определяемого компонента или его массовую долю в навеске анализируемого объекта. Для пересчета массы гравиметрической формы в массу орпделяемого компонента используют гравиметрический фактор (F):
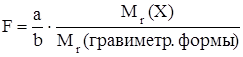 .
.
Если гравиметрической формой является Fe2O3, то для расчета массы железа (III) следует использовать
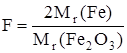 .
.
2.2. Техника выполнения основных операций
Осаждение.Проводят для выделения определяемого компонента из раствора в виде малорастворимого соединения. Осаждение считают количественным, если остаточная концентрация осаждаемого иона не превышает 10–6 моль/л.
Анализируемый раствор помещают в термостойкий стакан вместимостью 150–200 мл. В стакане находится палочка с резиновым наконечником, которую не вынимают из стакана до стадии фильтрования. Содержимое стакана нагревают, но не кипятят во избежание потерь за счет разбрызгивания раствора. Осадитель приливают по палочке и непрерывно перемешивают раствор после добавления каждой порции осадителя. Полноту осаждения проверяют, добавляя к раствору над осадком несколько капель осадителя. Если полнота осаждения достигнута, раствор над осадком остается прозрачным. При появлении мути следует добавить еще немного осадителя и вновь проверить полноту осаждения.
Фильтрование и промывание осадка.Проводят для отделения осадка от фильтрата и очистки осадка от примесных ионов.
Для отделения осадка от фильтрата используют фильтрующие тигли или бумажные фильтры. В гравиметрии для фильтрования применяют беззольные фильтры, масса золы которых после сжигания мала и указана на упаковке.
В зависимости от природы фильтруемого осадка используют фильтры различной пористости (табл. 2.1). Размер фильтра определяется объемом осадка, который должен занимать не более половины сложенного конусом фильтра.
Таблица 2.1. Виды фильтров, используемых в гравиметрии
| Вид фильтра | Назначение |
| «Синяя лента» | Наиболее плотные; для фильтрования мелкокристаллических осадков (например, BaSO4) |
| «Белая лента» | Средней плотности; для фильтрования осадков средней дисперсности (например, CaC2O4 · H2O) |
| «Красная» или «черная лента» | Наименее плотные; для фильтрования крупнокристаллических и аморфных осадков (например, Fe(OH)3) |
Перед началом фильтрования подходящий по пористости и размеру фильтр складывают, помещают в воронку и разворачивают таким образом, чтобы образовался конус (рис. 2.1). Фильтр смачивают дистиллированной водой и плотно прижимают его к стенкам воронки. Край фильтра должен находиться ниже края воронки на 5–8 мм. Воронку с фильтром помещают в кольцо штатива так, чтобы носик воронки был на 5–10 мм ниже верхнего края стакана, в который собирают фильтрат и промывные воды, и касался внутренней поверхности стакана.
Фильтрование проводят методом декантации. При этом способе фильтрования осадок должен оставаться на дне стакана. Стакан с осадком подносят к воронке, вынимают палочку и помещают ее почти вертикально над воронкой ближе к той части фильтра, где он сложен втрое (рис. 2.1, д). При этом палочка не должна касаться фильтра. Проводя носиком стакана по палочке, наклоняют стакан над воронкой и сливают (декантируют) жидкость на фильтр. Уровень жидкости должен находиться на 4–5 мм ниже края фильтра. В противном случае часть осадка может подняться выше уровня фильтра и перейти через край. Если жидкость проходит сквозь фильтр медленно, стакан приводят в вертикальное положение, проводя его носиком по палочке. Палочку помещают в стакан, стараясь не взмутить осадок, и ставят стакан с осадком на стол.
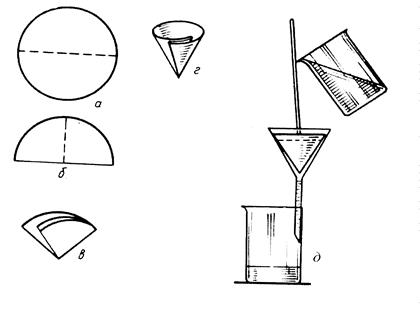
Рис. 2.1. Складывание фильтра (а–г) и фильтрование (д)
Далее приступают к промывке осадка методом декантации. Порцию промывной жидкости наливают в стакан с осадком, перемешивают палочкой и после отстаивания сливают прозрачную жидкость на фильтр. При этом осадок должен остаться в стакане. При декантации частицы осадка промываются эффективнее, чем на фильтре, где осадок слеживается более или менее плотной массой.
Полноту отмывки осадка от примесных ионов проверяют, используя чувствительную качественную реакцию этих ионов с подходящим реагентом. Операцию повторяют до отрицательной реакции на отмываемые ионы в промывных водах.
Операция фильтрования и промывания осадка должна быть проведена в один прием без перерывов. В противном случае осадок подсыхает, слипается в плотную массу и после этого его почти невозможно полностью промыть.
Затем отмытый осадок количественно переносят на фильтр. С помощью небольших порций промывной жидкости взмучивают осадок и полученную жидкость переливают по палочке на фильтр. Ополаскивают палочку промывной жидкостью над стаканом, протирают ее и стенки стакана кусочком беззольного фильтра (» 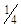 фильтра) и присоединяют этот кусочек к осадку на фильтре.
фильтра) и присоединяют этот кусочек к осадку на фильтре.
После этого с помощью резинового наконечника палочки загибают края фильтра так, чтобы осадок был полностью закрыт.
Озоление и прокаливание. Закрытый конус с осадком извлекают из воронки, помещают в фарфоровый тигель и озоляют на электрической плитке или на краю муфельной печи при открытой дверце. При этом фильтр превращается в золу, минуя стадию горения. После озоления тигель помещают вглубь муфельной печи, закрывают дверцу и прокаливают.
После прокаливания тигель переносят в эксикатор для охлаждения. После охлаждения до комнатной температуры тигель с осадком взвешивают на аналитических весах. Результат взвешивания записывают в рабочий журнал. Затем тигель снова прокаливают, охлаждают в эксикаторе и взвешивают. Между прокаливаниями тигель должен находиться в эксикаторе во избежание контактов осадка с воздухом.
Эксикатор – сосуд из толстостенного стекла с пришлифованной крышкой, на дне которого находятся вещества, поглощающие водяные пары и оксид углерода (IV). При работе с эксикатором необходимо помнить, что его крышку не приподнимают, а сдвигают в сторону (рис. 2.2, а). Переносить эксикатор следует придерживая большими пальцами обеих рук его крышку (рис. 2.2, б). Если в эксикатор поместить горячий тигель и сразу же закрыть крышкой, то расширившийся от нагревания воздух может приподнять крышку и даже сбросить ее. Поэтому крышку следует придерживать рукой и время от времени сдвигать ее вбок на долю секунды для выпускания воздуха.
Операцию прокаливания повторяют до тех пор, пока результаты двух последних взвешиваний не будут различаться более чем на 0,0001–0,0002 г (прокаливание до постоянной массы).
По достижении постоянной массы осадок высыпают из тигля, стенки его протирают фильтровальной бумагой и взвешивают пустой тигель. По разнице двух последних взвешиваний определяют массу гравиметрической формы.
 |  |
| а | б |
Рис. 2.2. Эксикатор (а), перенос эксикатора (б)
Зная массу гравиметрической формы и значение гравиметрического фактора в данном определении, рассчитывают содержание определяемого компонента в анализируемом образце.
Взвешивание.Весы предназначены для измерения массы веществ. В зависимости от требуемой точности в лабораториях используют технические (технохимические) или аналитические весы. Погрешность взвешивания технических весов составляет ±0,01 г. У аналитических весов погрешность взвешивания составляет ±0,0001 г. К весам прилагается набор гирь, помещенных в футляр, – разновес. Масса гирь-разновесок обозначена цифрами на каждой гирьке.
При взвешивании на аналитических весах следует соблюдать следующие правила.
1. Не нагружать весы выше предельной нагрузки.
2. Не ставить на чашку весов теплые или очень холодные предметы. Взвешиваемый предмет должен быть охлажден или нагрет до температуры весов.
3. Прежде чем ставить предмет на чашку весов, необходимо осмотреть, нет ли загрязнений на его внешней поверхности.
4. Дверцы весов во время взвешивания должны быть закрыты.
5. Гири разновеса необходимо брать только пинцетом.
6. Взвешиваемый предмет и гири можно ставить и снимать с чашек весов только при закрытом арретире.
7. Ручку арретира надо вращать медленно и осторожно.
8. Гири разновеса могут находиться только либо в своих гнездах, либо на правой чашке весов.
9. Каждый анализ или группу связанных между собой анализов необходимо проводить на одних и тех же весах и с одним и тем же разновесом.
10. В случае несправности весов следует обращаться к преподавателю.
2.3. Практические работы
Лабораторная работа № 1
Определение содержания железа (III)
в растворе
Цель работы – определить массу железа (III) или соли Fe2(SO4)3 · 6H2O (г) в пробе.
Сущность работы. В основе определения лежит реакция осаждения железа (III) раствором NH4OH:
Fe3+ + 3NH4OH®Fe(OH)3¯ + 3NH4+.
Выделившийся осадок Fe(OH)3 из-за низкой растворимости (ПР = 3,2 . 10–28) является аморфным. Поэтому следует строго соблюдать оптимальные условия осаждения аморфных осадков – вести осаждение из концентрированных и горячих растворов в присутствии электролита-коагулянта. Электролит-коагулянт NH4NO3 образуется в системе в результате взаимодействия раствора осадителя NH4OH и 2 н. HNO3, которую добавляют с целью окисления примесных ионов Fe2+ в Fe3+ и предотвращения гидролиза железа (III). Для очистки осадка от адсорбированных примесей и во избежание пептизации осадок промывают горячим раствором NH4NO3.
Полученный осадок прокаливают в муфельной печи при температуре t = 800–900°C до постоянной массы. При этом осаждаемая форма Fe(OH)3 превращается в гравиметрическую форму Fe2O3:
2Fe(OH)3 ® Fe2O3 + 3H2O.
Следует избегать длительного прокаливания, чтобы не произошло частичное восстановление Fe2O3 до Fe3O4.
Приборы и посуда: технические и аналитические весы, электрическая плитка, муфельная печь, конические колбы, стакан, пробирка, стеклянная палочка с резиновым наконечником, штатив с кольцом, воронка, мерный цилиндр, беззольный фильтр «белая лента».
Реактивы: 10%-ный раствор NH4OH, 2%-ный раствор NH4NO3, 2 н. раствор HNO3, 2 н. раствор BaCl2.
Выполнение работы.
1. В стакан с анализируемым раствором по палочке добавляют 2–3 мл 2 н. HNO3 (объем отмеривают цилиндром).
2. Раствор нагревают на плитке до 70–80°С (появление капель конденсата на стенках стакана).
3. К горячему раствору при перемешивании по палочке добавляют 10%-ный раствор NH4OH до появления явного запаха аммиака. При этом в стакане образуется бурый осадок Fe(OH)3.
4. В стакан с осадком добавляют 50–70 мл горячей дистиллированной воды и дают осадку отстояться.
5. Проверяют полноту осаждения железа (III), добавляя по палочке к прозрачной жидкости над осадком небольшое количество раствора NH4OH.
6. После выдерживания в течение 5 мин фильтруют содержимое стакана через бумажный фильтр «белая лента» методом декантации.
7. Осадок в стакане многократно промывают горячим раствором NH4NO3 от адсорбированных ионов SO42–. Для проверки полноты удаления SO42–-ионов используют качественную реакцию сульфат-ионов с BaCl2. Промывку осадка методом декантации ведут до отрицательной реакции на ионы SO42– в промывных водах.
8. Затем осадок с помощью небольших порций 2%-ного раствора NH4NO3 количественно переносят в воронку с фильтром. Кусочком беззольного фильтра протирают палочку, стенки и дно стакана и присоединяют этот кусочек к основному осадку.
9. Фильтр с осадком достают из воронки, загибают его края и конусом вверх помещают в фарфоровый тигель, предварительно записав номер тигля.
10. Фильтр обугливают, озоляют и прокаливают при температуре 800–900°С в муфельной печи до постоянной массы. При проведении озоления фильтр не должен гореть, поскольку в пламени возможен частичный переход Fe2O3 до Fe3O4.
11. После прокаливания тигель охлаждают в эксикаторе до комнатной температуры и взвешивают на аналитических весах. Результаты каждого взвешивания обязательно записывают в журнал. Прокаливание проводят до тех пор, пока разница результатов последнего и предпоследнего взвешиваний превышает 2 · 10–4 г (прокаливание до достижения постоянной массы).
12. По достижении постоянной массы осадок из тигля высыпают, протирают его стенки фильтровальной бумагой и взвешивают пустой тигель на аналитических весах с тем же разновесом. По разности масс тигля с осадком и пустого тигля определяют массу гравиметрической формы. Используя справочное значение гравиметрического фактора (F = 0,6994), рассчитывают содержание железа (III) в растворе.
2.4. Типовые расчеты в гравиметрии
2.4.1. Примеры решения типовых задач.
Количественное осаждение ионов. Для решения задач необходимо записать уравнение диссоциации малорастворимого соединения и правило произведения растворимости (ПР) для него. Принято считать осаждение количественным, если остаточная концентрация осаждаемого иона не превышает 1 ∙ 10–6 моль/л.
Пример. Какой должна быть концентрация ионов OH–, чтобы осадитьколичественноMg2+ в виде Mg(OH)2?
Решение.
Mg(OH)2 D Mg2+ + 2 OH–
ПР = [Mg2+] ∙ [OH–]2 [Mg2+] £ 1 ∙ 10–6 моль/л.
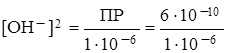 = 6 ∙ 10–4
= 6 ∙ 10–4
[OH–] = 2,45 ∙ 10–2 моль/л.
Потери при промывании осадка. Для этого типа расчетов записывают уравнение равновесия для малорастворимого соединения и его диссоциацию в промывной жидкости. Выбор дальнейшего решения зависит от присутствия в промывной жидкости одноименных с осадком ионов или разноименных. В первом случае в выражение для ПР подставляют значения суммарной концентрации одноименных ионов. Во втором – рассматривают влияние «солевого эффекта».
Пример. Сколько граммов фторида кальция растворится при промывании его: а) 250 мл 4%-ного раствора нитрата кальция; б) 250 мл раствора, содержащего 0,05 г NaCl?
Решение.
a) Исходя из равновесия в системе осадок-раствор, выразим равновесные концентрации ионов через молярную растворимость S:
S S 2S
CaF2 D Ca2+ + 2 F–
Запишем выражение ПР.
ПР = [Ca2+] ∙ [F–]2
Промывная жидкость содержит нитрат кальция, который диссоциирует c образованием одноименных с осадком ионов Са2+:
Ca(NO3)2 → Ca2+ + 2 NO3–
При условии, что плотность растворов (ρ) с концентрацией менее 5% равна 1 г/мл, найдем массу растворенного вещества:
m(Ca(NO3)2) = Vр-ра ∙ ρ ∙ ω = 250 ∙ 1 ∙ 0,04 = 10,0 г.
Тогда концентрация Са2+ в растворе Ca(NO3)2:
С (Са2+) = С (Ca(NO3)2) = 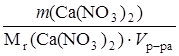
С (Са2+) = 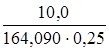 = 0,2438 моль/л.
= 0,2438 моль/л.
Общая концентрация ионов Са2+ в растворе выражается:
С (Са2+) = (0,2438 + S) моль/л.
В правило ПР подставим значения равновесных концентраций:
ПР = (0,2438 + S) ∙ (2S)2.
Так как величина S << 0,2438, то выражение ПР упрощается:
ПР = (0,2438) ∙ (2S)2 = 0,9751 ∙ S2;
S = 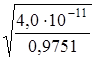 = 6,4 10–6 моль/л.
= 6,4 10–6 моль/л.
Для расчета массы растворившегося CaF2 воспользуемся формулой
m(CaF2) = S ∙ Mr(CaF2) ∙ Vр-ра
m(CaF2) = 6,4 10–6 ∙ 78,080 ∙ 0,25 =1,25 10–4 г.
б) Растворимость фторида кальция в растворе хлорида натрия рассчитаем с учетом «солевого эффекта».
CaF2 D Ca2+ + 2 F–
ПР = а(Ca2+) ∙ а2(F–) = С(Сa2+) ∙ f(Сa2+) ∙ C 2(F–) ∙ f 2(F–).
Предположим, что С (Сa2+) = S, тогда С (F–) = 2S.
ПР = 4S 3 ∙ f(Сa2+) ∙ f 2(F–)
Для расчета коэффициентов активности f(Сa2+) и f(F–) определим концентрацию NaCl и ионную силу раствора:
С (NaCl) = 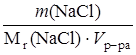 =
= 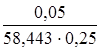 = 3,42 ∙ 10–3 моль/л.
= 3,42 ∙ 10–3 моль/л.
Ионная сила раствора будет определяться концентрацией сильного электролита NaCl (вкладом ионов CaF2 можно пренебречь):
NaCl → Na+ + Cl–
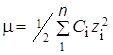 =
= 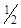 (3,42 ∙ 10–3 ∙ 1 + 3,42 ∙ 10–3 ∙ 1) = 3,42 ∙ 10–3 моль/л.
(3,42 ∙ 10–3 ∙ 1 + 3,42 ∙ 10–3 ∙ 1) = 3,42 ∙ 10–3 моль/л.
Так как μ < 0,01, то значения f(Сa2+) и f(F–) рассчитываем по формуле:
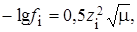
lg f(Сa2+) = – 0,5 ∙ 22 ∙ 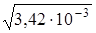 = – 0,117, f = 0,76.
= – 0,117, f = 0,76.
lg f(F–) = – 0,5 ∙ 12 ∙ 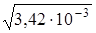 = – 0,029, f = 0,93.
= – 0,029, f = 0,93.
Рассчитаем растворимость осадка CaF2 в растворе NaCl:
S = 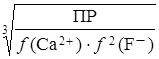 =
= 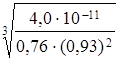 = 3,92 ∙ 10–4 моль/л
= 3,92 ∙ 10–4 моль/л
m(CaF2) = 3,92 ∙ 10–4 ∙ 78,080 ∙ 0,25 = 7,65 ∙ 10–3 г.
Расчет количества осадителя. Для решения задачи необходимо записать уравнение реакции осаждения. В соответствии со стехиометрией реакции рассчитывается необходимое количество осадителя. Особенностью при решении этого типа задач является увеличение полученного результата в 1,5 – 2 раза (для нелетучих осадителей) или в 3 раза (для летучих осадителей), так как небольшой избыток осадителя способствует практически полному осаждению.
Пример. Какой объем 10%-ного раствора аммиака потребуется для практически полного осаждения никеля из 16,0 г руды, содержащей 1,5% оксида никеля?
Решение. Рассчитываем массу NiO в руде:
m(NiO) = 16,0 ∙ 0,015 = 0,240 г.
Массу NH4OH вычисляем по следующей схеме:
NiO → Ni2+→ Ni(OH)2↓
Осаждение Ni2+ аммиаком соответствует уравнению
Ni2+ + 2 NH4OH = Ni(OH)2↓
ν (NH4OH) = 2 ν (Ni2+) = 2 ν (NiO)
Массу NH4OH рассчитаем по следующей формуле:
m(NH4OH) = 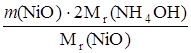
m(NH4OH) = 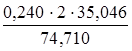 = 0,2252 г.
= 0,2252 г.
Найдем массу 10%-ного раствора NH4OH:
m(р-ра) = 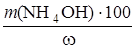 =
= 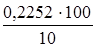 = 2,252 г.
= 2,252 г.
Определив по справочнику плотность 10%-ного раствора – 0,958 г/мл, рассчитаем его объем:
V = 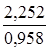 = 2,35 мл.
= 2,35 мл.
Для практически полного осаждения необходим 1,5–2-кратный (для нелетучих осадителей) или 3-кратный избыток осадителя (для летучих осадителей), то есть:
V = 2,35 ∙ 3 = 7,05 мл.
Расчет результатов анализа. Для решения задачи необходимо записать схему процесса, проставить стехиометрические коэффициенты и использовать гравиметрический фактор.
Пример. Навеску соли, содержащей Al(NO3)3, массой 0,5268 г растворили в воде и разбавили до 50,0 мл. Затем осадили алюминий, используя таннин (С76Н52О46), и прокалили осадок до Аl2O3, масса которого оказалась равной 0,3060 г. Вычислить массовую долю (%) Al в соли.
Решение. Запишем схему процесса и установим стехиометрические коэффициенты:
2 Al(NO3)3 → Аl2O3 → 2Аl
Вычислим массу Al, используя формулу:
m(Al) = m(Аl2O3) ∙ F,
где F – гравиметрический фактор, равный:
F = 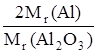 .
.
Значение гравиметрического фактора можно взять из справочника или рассчитать (F = 0,5293).
m(Al) = 0,3060 ∙ 0,5293 = 0,1620 г,
ω = 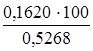 = 30,74%.
= 30,74%.
2.4.2. Индивидуальные задания для самоподготовки.
Количественное осаждение ионов.Какой должна быть концентрацияионов Б,чтобы осадитьколичественноионы А в видевещества С? Исходные данные приведены в табл. 2.2.
Таблица 2.2. Условия задач по количественному осаждению ионов
| № | Ион А | Ион Б | Вещество С |
| Pb2+ | SO42– | PbSO4 | |
| Ca2+ | C2O42– | CaC2O4 | |
| Ag+ | Cl– | AgCl | |
| Ba2+ | CrO42– | BaCrO4 | |
| Pb2+ | Cl– | PbCl2 | |
| Ba2+ | C2O42– | BaC2O4 | |
| Sr2+ | SO42– | SrSO4 | |
| Pb2+ | J– | PbJ2 | |
| Ag+ | Br– | AgBr | |
| Zn2+ | CO32– | ZnCO3 | |
| Sr2+ | F– | SrF2 | |
| Fe3+ | OH– | Fe(OH)3 | |
| Al3+ | OH– | Al(OH)3 | |
| Ba2+ | SO42– | BaSO4 | |
| Ni2+ | OH– | Ni(OH)2 | |
| Pb2+ | C2O42– | PbC2O4 |
