Водородный показатель среды
Строение атома
1. Элементы, находящиеся в одной группе и подгруппе обладают одинаковым числом …
1) протонов
2) электронов
3) энергетических уровней
Валентных электронов
2. Радиус атома возрастает в ряду:
1) O, S, Te, Se
Si, Ge, Sn, Pb
3) Al, Si, Mg, Na
4) Mg, Ca, Ba, Sr
3. Иону О2- соответствует электронная конфигурация …
1) 1s22s22p0
2) 1s22s22p6
3) 1s22s22p3
4) 1s22s22p5
5)
Химическая связь
4. Формула высшего оксида элемента, образующего водородное соединение ЭН2, имеет вид…:
1) ЭO2 2) ЭO3 3) ЭO 4) ЭO4
5. Формула водородного соединения элемента, образующего высший оксид Э2О7, имеет вид…:
1) HЭ2) ЭH4 3) H2Э 4) ЭH3
6. Вещества, содержащие только ковалентные полярные химические связи (обычный механизм), расположены в ряду…
1) PF5, Cl2O7, NH4Cl 2) F2, H2SO4, P2O5
3) H3PO4, BF3, CH3COONH4 4) NO2, SOCl2, CH3COOH
7. Степень ионности связей возрастает в ряду…
1) Na2O, BaO, CO2
2) H2O, CH4, CaH2
3) BH3, BeH2, LiH
4) CCi4, NaJ, MgCl2
8. В группах с увеличением порядкового номера электроотрицательность элементов…
1)увеличивается
2) изменяется периодически
3). уменьшается
4). не изменяется
9. В молекуле аммиака все связи…
Ковалентные полярные
2) ковалентные неполярные
3) донорно – акцепторные
4) ионные
10. В молекуле сероводорода химическая связь ….
Ковалентная полярная
2) донорно – акцепторная
3) ковалентная неполярная
4) водородная
11. Наиболее прочной является связь между элементами в молекуле, формула которой …
1) H2Te
2) H2Se
3) H2O
4) H2S
12. Формула вещества с тетраэдрическим строением молекулы имеет вид …
1) BF3
2) NH3
3) H2O
4) CH4
13. Вещество, в молекуле которого содержится π – связь, называется …
1) сероводород
2) водород
Кислород
4) этанол
14. Число π – связей одинаково в молекулах …
1) CO2 и C2H2
2) CH3COOH и CO2
3) H2SO4 и H3PO4
4) Cl2O7 и P2O5
15. В ряду кислот HF-HCl-HBr-HJ сила кислот ….
1) изменяется неоднородно
Увеличивается
3) не изменяется
4) уменьшается
16. Формула вещества с молекулярной кристаллической решеткой имеет вид…
1) CaH2
2) KCl
3) CaO
4) NH3
Способы количественного выражения состава растворов
17. Для приготовления 500 г 10% раствора сульфата калия необходимо навеску соли растворить в ……граммах воды
1) 50
2) 450
3) 400
4) 475
18. Смешали 200 г 20%-ного и 300 г 10%-ного растворов глюкозы. Массовая доля вещества в полученном растворе равна … %
1) 15 2) 16 3) 18 4) 14
19. Массовая доля соли в растворе, полученном при смешивании 150 г 2% раствора и 350 г 4% растворов составляет…%
1) 3
2) 3,4
3) 6,8
4) 1,7
20. Массовая доля фосфата калия в растворе, полученном при растворении 0,5 моль соли в 124 г воды равна…%
1) 23
2) 69
3) 46
4) 72
21. . Масса осадка, образующегося при сливании 200мл 0,1 М раствора карбоната натрия и 100 мл 0,15 М раствора хлорида кальция равна… грамм
1) 4,5 2) 2,0 3) 1,5
22. Объем 0,15 н р-ра серной кислоты для осаждения ионов бария из 60 мл 0,2 н раствора хлорида бария равен … мл
1) 40
2) 90
3) 80
4) 180
23. Объем 0,2 н р-ра серной кислоты, необходимый для нейтрализации 100 мл 0,15 н раствора гидроксида натрия равен … мл
1) 40
2) 75
3) 80
4) 180
24. Молярная концентрация раствора, в 2 л которого содержится 19,6 г серной кислоты, равна …моль /л
1) 0,5
2) 1,0
3) 0,2
4) 0,1
25. Масса растворенного вещества в 500 мл раствора серной кислоты с молярной концентрацией 0,1 моль/л равна ….грамм
1) 4,9
2) 9,8
3) 49
4) 24,5
Условия протекания реакций ионного обмена до конца
26. Уравнение реакции, осуществимой в водном растворе, имеет вид…
1. Ba(NO)2 +2NaOH = 2NaNO3 +Ba(OH)2
2. NaNO3 + НС1 = NaCl + HNO3
3. CuSO4 + 2KOH = K2SO4 + Cu(OH)2
4. Fe2(SO4)3 + 6HNO3 = 2Fе(NО3)3 + 3H2SO4
27. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид…
1. Ca(NO3)2 + 2NaNO3 = Ca(NO3)2 + 2NaCl
2. FeCl3 + 3NaOH = Fe(OH)3 + NaCl
3. BaSO4 + 2HCl = BaCl2 + H2SO4
4. K2SO4 + 2HCl = H2SO4 + 2HCl
Гидролиз
28. . В растворе карбоната натрия лакмус окрашивается в …..цвет
1) красный
2) зеленый
3) фиолетовый
4) синий
Химические свойства соединений
29. Кислотный характер имеют оксиды, образованные металлами…
1) с любой степенью окисления
2) главных подгрупп
3) со степенью окисления ниже +4
4) со степенью окисления равной или выше +4
30. Оксиды образуются при…
1) растворении негашеной извести
2) горении железа в хлоре
Горении природного газа
4) растворении хлора в воде
31. Пропущенными веществами в схеме химической реакции
LiH + H2O → ….+ … являются:
1. Li2O 2. О2 3. LiOH 4. H2
32. . Наиболее сильным основанием является…
1) Ba(OH)2 1) Mg(OH)2 1) Cu(OH)2 1) Sr(OH)2
33. Для цепочки превращений
FeCl2 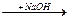 X1
X1 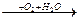 X2
X2 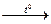 X3
X3
конечным веществом Х3 является…
1) Fe(OH)3 2) FeO 3) Fe2O3 4) Fe(OH)2
34. Для цепочки превращений
Fe 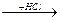 X1
X1 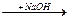 X2
X2 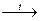 X3
X3
конечным веществом Х3 является…
1) Fe(OH)2 2) Fe3O4 3) FeO 4) Fe(OH)3
35. Для цепочки превращений
Zn 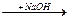 X1
X1 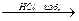 X2
X2 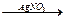 X3
X3
конечным веществом Х3 является…
1) ZnCl2 2) Ag2O 3) Ag2ZnO2 4) Zn(NO3)2
36. Для цепочки превращений
Cu 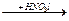 X1
X1 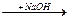 X2
X2 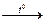 X3
X3
конечным веществом Х3 является…
1) CuO 2) Cu(NO3)2 3) Cu2O 4) [Cu(OH)4]NO3
37. Кислая соль образуется при взаимодействии 1 моль Са(ОН)2 с …
1) 1 моль Н3РО4
2) 1 моль НNО3
3) 1 моль СН3СООН
4) 2 моль НCl
38. При взаимодействии оксида серы (IV) с избытком раствора NaOH образуется…
1) гидросульфит натрия 2) гидросульфат натрия
3) сульфит натрия 3) сульфат натрия
39. Формулы веществ, пропущенных в схеме химической реакции:
CaCO3 + H2O + … → …
имеют вид …
1) Ca(HCO3)2
2) CO2
3) Ca(CHO2)2
4) CO
40. С кислотами и щелочами взаимодействует оксид…
1) хрома (III) 2) хрома (II) 3) хрома (VI) 4) магния
41. В водных растворах невозможна реакция….
1) KJ + F2 →
2) KJ + Cl2 →
3) KBr + Cl2 →
4) KCl + Br2 →
42. В цепочке превращений веществом Х является….
KCrO2 + Br2 + KOH → X →H2SO4→K2Cr2O7
1) Cr(OH)3
2) CrBr2
3) Cr2O3
4) K2CrO4
43. . Соль образуется при…
1) обугливании сахара серной кислотой
2) растворении негашеной извести в воде
Горение железа в хлоре
4) разложении перекиси водорода
44. Растворы щелочей реагируют с ….
1) С
2) N2
Zn
4) Mn
Водородный показатель среды
45. Для водных растворов справедливо соотношение…
1) рН = рОН 2) рН + рОН = 14
3) рН + рОН = 7 4) рН < рОН
46. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН равный…11) 1 2) 2 3) 5 4) 4
47. Для определения рН растворов потенциометрическим методом в качестве индикаторного электрода используется ……электрод
1) стеклянный (ионселективный) 2) газовый 3) хлорсеребряный
48. Объем 0,1 н раствора КОН, необходимый для нейтрализации 20 мл 0,15 н раствора азотной кислоты, равен……миллилитрам.
1) 15 2) 45 3) 304) 20
Аналитическая химия
49. Различная способность веществ к адсорбции используется в…
1) томографии 2) полярографии
3) рентгенографии 4) хроматографии
50. Вещество, на поверхности которого происходит разделение и концентрирование анализируемых веществ в методе хроматографии, называется…
1) элюэнт 2) сорбтив 3) сорбат 4) сорбент
51. . Методы анализа, основанные на способности вещества поглощать свет определенной длины волны, называются ...
1) потенциометрическими 2) спектрофотометрическими
3) фотоэмиссионными 4) радиометрическими
52. Формула реагента, используемого для качественного определения ионов аммония в растворе, имеет вид….
1) Fe(OH)2 2) H2SO4 3) NaOH 4) BaCl2
53. При взаимодействии ионов Fe3+с гексацианоферратом (II) калия наблюдается образование…
1) бурого осадка 2) белого осадка
3) темно-синего осадка 4) кроваво-красного осадка
54. При взаимодействии ионов Cu2+с избытком раствора аммиака наблюдается образование…
1) бурого осадка 2) белого осадка
3) ярко-синего раствора4) кроваво-красного осадка
Термодинамика
55. Если энтальпия образования SO2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16 г серы, равно……кДж.
1) 148,5 2) 297 3) 74,25 4) 594
56. При нагревании 56 г железа с 32 г серы (ΔН = -100кДж/моль) выделяется …. кДж теплоты.
1) 50
2) 75
3) 25
4) 100
