Глава 10. Химия радиоактивных элементов 4 страница
Уран- 92 –ой элемент Периодической системы Менделеева, последний и самый тяжелый из существующих в природе элементов. Этот элемент занимает в современной жизни особое место. Он сыграл, по словам Д.И. Менделеева выдающуюся роль в утверждении периодического закона.
В дальнейшем с ураном оказались связанными два важнейших открытия науки ХХ века, давшие толчок многочисленным исследованиям: радиоактивность и деление ядер.
Уран, главный элемент ядерной энергетики и сырье для получения другого главного энергетического элемента- плутония, причастен ко многим открытиям ХХ века. Уран помог раскрыть тайны атома, стал источником невиданной мощи. Он основа современной «алхимии», превращения элементов и получения новых. В нейтронных потоках урановых реакторов в наши дни тоннами накапливаются элементы, в десятки раз более ценные, чем золото.
Открыл уран немецкий химик Клапрот в 1789 г., выделив из саксонской смоляной руды черное металлоподобное веществ, и назвал его ураном. Более пятидесяти лет это вещество считалось металлом и только в 1841 г. францезский химик Пелиго доказал, что это окисел урана UO2. Прошло еще 55 лет и, в 1896 г. А. Беккерель обнаружил, благодаря урану, явление радиоактивности.
Природный уран состоит из трех изотопов: 238U – 99,2739%, продукт его распада 234U– 0,0057% и 235U – 0,7204%. Первый и последний являются родоначальниками семейств естественных радиоактивных элементов урана (тип ядра по массе 4n+2) и 235U (актиноурана) (4n+3). Их периоды полураспада равны соответственно 4,51.109 и 7,13.108 лет. С помощью циклотрона и ядерного реактора в настоящее время получено 11 искусственных радиоактивных изотопов и 1 изомер урана. Наиболее важный из них – 233U (T1/2 = 1.62·105 лет), как и 235U способен к цепной реакции деления, поэтому является ядерным горючим.
Уран довольно широко распространен в природе. По распространенности он занимает 38-е место.
Уран, наряду с первичными рудами магматического происхождения, образует вторичные осадочные рудные месторождения. Он содержится более чем в 100 различных минералах. Главные из них – окислы урана и смешанные соли ванадиевой, фосфорной, кремневой, мышьяковой, титановой и ниобиевой кислот. Наиболее важными первичными минералами промышленных месторождений являются уранинит и урановая смолка, а вторичным минералом – карнотит.

Рис. Уранинитовая руда
Уран – блестящий металл, напоминающий по внешнему виду сталь. Он обладает полиморфизмом. Он обладает относительно высокой температурой плавления 11320 С и кипения 46900 С. Электропроводность урана близка к электропроводности железа. Ниже 1 К уран становится сверхпроводником.
Химические свойства урана изучены методами классической химии. Электронная конфигурация атом урана 5f3 6d1 7s2.
Химические свойства урана довольно сложные. Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. При 1000 °C уран соединяется с азотом, образуя желтый нитрид урана. При сильном встряхивании металлические частицы урана начинают светиться. Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана.
Уран растворяется в соляной, азотной и других кислотах, но не взаимодействует со щелочами.
Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото.
Степени окисления урана +3, +4, +5, +6. Ионы урана гидратированы и гидролизованы. Степень гидролиза и комплексообразования растет в ряду:
U 5+< U 3+< U 4+< U 6+
Наиболее устойчивое валентное состояние в водных растворах- U6+. Однако в нейтральной и кислой средах как настоящий амфотерный элемент уран образует двухзарядные катионы уранила UO  ; в щелочной— анионы диураната UO
; в щелочной— анионы диураната UO  . Образующиеся при этом соли полиуранаты малорастворимы. Так, прибавление едкого натра к раствору какой-либо соли уранила вызывает выпадение желто-бурого аморфного осадка диураната:
. Образующиеся при этом соли полиуранаты малорастворимы. Так, прибавление едкого натра к раствору какой-либо соли уранила вызывает выпадение желто-бурого аморфного осадка диураната:
2UO2SO4 + 6NaOH  Na2U2O7
Na2U2O7  + 2Na2SO4+ 3H2O
+ 2Na2SO4+ 3H2O
Образование нерастворимых диуранатов из солей уранила— очень важная реакции, которой пользуются для перевода шестивалентного урана в осадок. Полиуранаты являются типичным примером образования неорганических полимеров. Характерной особенностью почти всех солей шестивалентного урана является способность давать растворимые комплексы (даже в щелочной среде) в присутствии избытка карбонатов, оксалатов, сульфатов щелочных металлов или аммония вследствие образования комплексных ионов.

Рис. Урановое (U6+) стекло
Тетрахлорид урана UCl4 и диоксид урана UO2 — примеры четырёхвалентного урана. Вещества, содержащие четырёхвалентный уран, обычно нестабильны и при длительном пребывании на воздухе обращаются в шестивалентные.
Все соли U+4 ярко-зеленого цвета. Четырехвалентный уран в кислотах более склонен к комплексообразованию, чем U6+.
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Первое – дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырехвалентном состоянии, то этот способ неприменим: четырехвалентный уран в серной кислоте практически не растворяется. И либо нужно прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Окончательное извлечение урана осуществляется методами экстракции, ионного обмена и др. Методы ионного обмена и экстракции хороши тем, что позволяют достаточно полно извлекать уран из бедных растворов, в литре которых лишь десятые доли грамма элемента №92. После этих операций уран переводят в твердое состояние – в один из окислов или в тетрафторид UF4.
Металлический уран в небольших количествах получается восстановлением U3O8 магнием или натрием в атмосфере СО2. Промышленный способ получения металлического урана заключается в восстановлении UF4 кальцием или магнием.
UF4+ 2 Ca®U +2 CaF2
Из всех известных изотопов урана наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии (критическая масса около 50 кг). Возможные схемы вынужденного деления были рассмотрены более подробно в главе 6 (раздел 6.6.2).
Изотоп U238 способен делиться только под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией). Изотоп 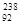 U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра
U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра  U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
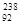 U(n, г)
U(n, г)  U
U 
 Np
Np 
 Pu
Pu 
 U
U
Таким образом, 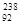 U с одной стороны является ядом для цепной реакции. С другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящегося
U с одной стороны является ядом для цепной реакции. С другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящегося  Pu.
Pu.  Pu используется, в основном, для производства ядерного оружия.
Pu используется, в основном, для производства ядерного оружия.
Если ядерный реактор работает на смеси природного  Th с
Th с  U при радиационном захвате нейтрона торием возможно получение 23392U:
U при радиационном захвате нейтрона торием возможно получение 23392U:
 Th (n, г)
Th (n, г)  Th
Th 
 Pa
Pa 
 U
U 
Уран-233является ядерным топливом для атомных электростанций и производства атомных бомб (критическая масса около 16 кг). Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
В ядерных реакторах в качестве тепловыделяющих элементов (ТВЭЛов) могут использоваться чистый уран или его сплавы с алюминием, цирконием, хромом, цинком.. В большинстве энергетических реакторов обычно применяют керамические сердечники из двуокиси урана (UO2), которые не деформируются в течение рабочего цикла выгорания топлива. Другое важное свойство этого соединения — отсутствие реакции с водой, которая может привести в случае разгерметизации оболочки ТВЭЛа к попаданию радиоактивных элементов в теплоноситель. Также, к достоинствам диоксида урана можно отнести то, что его плотность близка плотности самого урана, что обеспечивает нужный поток нейтронов в активной зоне.

Рис. Тепловыделяющие элементы (ТВЭЛы)
Четверть века назад ядерные реакторы обычно называли атомными котлами, подчеркивая тем самым суть происходящих в них процессов: главное – это выделение энергии. Но если в обычных топках горючее полностью (или почти полностью) сгорает, то в ядерном реакторе все обстоит иначе. В рабочем цикле выгорает лишь незначительная доля урана: «протопить» реактор до полного выгорания ядерного горючего технически невозможно. Уран в реакторе постепенно «зашлаковывается» продуктами деления и в нем меньше становится урана-235. Цепная реакция неизбежно начинает глохнуть, и поддержать ее можно, только сменив твэлы. Поэтому старые твэлы снимают и отправляют на переработку: их растворяют в кислотах и извлекают уран из раствора методом экстракции. Уран легко образует экстрагируемые комплексы и переходит в органическую фазу, а осколки деления, от которых нужно избавиться, остаются в водном растворе.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки. При хронической интоксикации возможны нарушения кроветворения и нервной системы. В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7г.
10.9 ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ ( 93Np, 94Pu, 95Am)
