В расплавленных и твердых электролитах
На границе раздела металл — твердый электролит образуется двойной электрический слой, связанный с адсорбцией катионных или анионных вакансий. По В. Н. Чеботину и Л. М. Соловьевой, двойной слой на границе раздела фаз может быть представлен так, как это изображено на рис. 7.20. Первый слой состоит из отдельных атомов, второй имеет избыток вакансий по сравнению с их концентрацией в объеме, последующие слои содержат такое же число вакансий, как и в объеме. Однако по аналогии с теорией строения двойного электрического слоя в растворах можно предполагать, что двойной слой состоит из плотной части, локализованной в первом слое, и диффузной части, распределенной в последующих слоях. Подвижными частицами в твердом электролите являются дефекты кристаллической решетки, т. е. катионные и анионные вакансии. Плотность заряда электрода равна сумме плотностей зарядов в плотной части двойного слоя и в его диффузной части.
Экспериментальные исследования емкости (точнее, импеданса) электрода проводят на ячейках, состоящих из двух одинаковых электродов, между которыми находится твердый электролит. Как правило, при таких измерениях электроды не являются идеально поляризуемыми, а наличие частотной зависимости импеданса не позволяет считать измеряемые значения емкости равными емкости

Рис. 7.20. Модель строения поверхности твердого электролита.
двойного слоя. Однако изучение частотной зависимости импеданса дает возможность построить эквивалентную электрическую схему ячейки и выделить из нее путем расчета элементе в схемы емкость двойного слоя. В области определенных значений потенциалов при тщательной специальной подготовке электродов можно добиться весьма низкой дисперсии емкости с частотой и получить зависимость дифференциальной емкости С от потенциала Е. На кривых С — Е наблюдаются минимумы. Абсолютные значения емкости, а также форма кривых С — Е в значительной степени определяются условиями эксперимента. В настоящее вре мя не существует достаточно строгой количественной теории ионного двойного слоя на границе металл — твердый электролит.
На границе расплавленный металл —расплав соли могут быть получены электрокапиллярные кривые или измерена емкость двойного электрического слоя (А. Н. Фрумкин, Е. А. Укше, Н. Г. Букун, В. А. Кузнецов, Д. И. Лейкис). Емкостные кривые на расплавленных свинце, кадмии, алюминии, сурьме, серебре, таллии, висмуте, индии, галлии и теллуре в расплаве КС1 — NaCl имеют форму параболы с симметричными ветвями. Аналогичные зависимости получены на твердых металлах (Al, Mg, Ag) в расплаве LiCl — KC1.
Электрокапиллярные кривые на жидких металлах в расплавах КС1 — LiCl имеют максимум, который по потенциалу находится вблизи минимума дифференциальной емкости. Этот факт позволяет предполагать, что указанные экстремумы на кривых соответствуют потенциалу нулевого заряда металла. Абсолютное значение минимума дифференциальной емкости зависит от природы расплава (в частности, от анионного состава электролита) и температуры и почти не зависит от природы металла. Эти экспериментальные факты не могут быть объяснены с позиций теории строения двойного слоя, рассмотренной для водных растворов, так как теория Гельмгольца не может объяснить симметричность С — E-кривых, а представления о диффузном слое неприменимы в связи с высокими значениями емкости в минимуме С — E-кривой; [(20 ÷ 75)∙10–2 Ф/м2].
Для объяснения экспериментальных фактов предложено несколько моделей строения двойного слоя в расплавах. Согласно одной из них, избыточные заряды в электролите располагаются на глубину в несколько атомных слоев и рост емкости со сдвигом потенциала от потенциала минимума емкости связан с деформацией структуры расплава, а не электронных оболочек ионов. По другой модели в расплаве подвижными являются только катионы или катионные вакансии и их распределение зависит от потенциала.
Р. Р. Догонадзе и Ю. А. Чизмаджев предложили знакопере- менное строение двойного слоя в расплаве, когда заряд второго слоя противоположен заряду первого и третьего слоев, заряд четвертого — заряду третьего и пятого и т. д. Количественная теория строения двойного электрического слоя в расплавах пока отсутствует.
%(%8 КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
Если замкнуть разомкнутую электрохимическую систему на внешний источник напряжения или на сопротивление, то в ней возникнет электрический ток и произойдет превращение веществ на электродах в соответствии с законами Фарадея. Скорость w электрохимического превращения, как и скорость любой гетерогенной реакции, выражается массой вещества (моль), прореагировавшего на единице поверхности (м2) в единицу времени (с). Но скорость электрохимической реакции удобнее выражать в токовых единицах, связанных с w уравнением:
i = zFw
Поскольку F выражено в кулонах на моль электронов, а z – в молях электронов на моль вещества, то z выражается в амперах на квадратный метр и называется плотностью тока.
Строго говоря, значение плотности тока должно выражаться в единицах тока, отнесенных к единице истинной поверхности электрода (истинная плотность тока). Однако в случае твердых электродов не всегда возможно измерить их истинную поверхность или коэффициент шероховатости. Поэтому при постановке эксперимента либо уделяют большое внимание сглаживанию поверхности электрода, чтобы приблизить истинную поверхность к видимой, либо определяют шероховатость поверхности каким-нибудь независимым способом. Иногда шероховатость не учитывают, и ток относят к единице видимой (так называемой габаритной) поверхности. При этом скорость электрохимической реакции, получаемая экспериментально, оказывается всегда завышенной.
Сдвиг потенциала электрода от его равновесного значения называется перенапряжением. Перенапряжение η может быть представлено следующими, вполне эквивалентными уравнениями
η = E – Ep; η = Ep – E
где Е – потенциал электрода при пропускании тока; Ер – равновесный потенциал электродной реакции.
В катодном процессе Е отрицательнее Ер и в соответствии с первым из этих уравнений перенапряжение отрицательно, а в соответствии со вторым – положительно. В анодном процессе Е по-ложителънее Ep и, следовательно, по первому уравнению перенапряжение положительно, а по второму – oтрицательно. В литературе по электрохимии применяют оба выражения. B настоящем издании для однозначности будем использовать первое из этих уравнений (хотя это не имеет принципиального значения) и считать катодное перенапряжение отрицательным, а анодное – положительным.
Часто сдвиг потенциала электрода от его значения без тока называют катодной или анодной поляризацией.
Целью изучения кинетики электродных реакций является установление закономерностей протекания электрохимических реакций, определение элементарных стадий, через которые осуществляется реакция, и механизма электродных процессов.
Электродные реакции гетерогенны и сопровождаются переходами заряженных частиц через границу раздела фаз. Они состоят из отдельных элементарных последовательных, а иногда и параллельных электрохимических и химических стадий, включающих помимо переноса зарядов диффузию исходных веществ и продуктов реакции, их возможную адсорбцию на поверхности электрода, адсорбцию промежуточных частиц, образование новой фазы и т. д. Под механизмом реакции понимают установление определенной последовательности элементарных стадий, которые составляют суммарную электродную реакцию, т. е. реакцию, в которой четко могут быть определены как исходные вещества, так и конечные продукты реакции. В большинстве случаев исходные вещества, вступающие в реакцию, известны, и тем не менее доказательство участия какого-либо сорта частиц в реакции представляет известную трудность, так как в растворе или расплаве исходное вещество может находиться в виде частиц различного состава. Частицы, непосредственно реагирующие на электроде, могут быть в растворе в ничтожной концентрации, но непрерывно восполняться в результате быстрой химической реакции. Аналогично и продукты реакции могут вступать в последующее химическое взаимодействие с компонентами раствора или расплава. Наличие элементарной стадии переноса заряда через двойной электрический слой существенно отличает электрохимические реакции от гетерогенных химических реакций.
В принципе, любая электрохимическая реакция может состоять из ряда последовательных стадий. Во-первых, участники реакции должны доставляться к поверхности электрода, затем они могут претерпевать химическое превращение, приводящее их в более реакционноспособную форму. После этого происходит присоединение или освобождение одного или нескольких электронов (восстановление, или окисление), которое может протекать в одну или несколько стадий. После собственно электрохимического акта должно происходить удаление продуктов реакции.
При стационарном протекании электрохимической реакции скорости всех стадий одинаковы, причем скорость суммарной реакции определяется скоростью наиболее медленной стадии. Стадия, которая определяет собой скорость электрохимической реакции, называется лимитирующей или замедленной стадией реакции. Замедленная стадия, следовательно, это такая стадия, которая в данных условиях не может протекать со скоростью большей, чем она есть. Скорости других последовательных стадий могли бы быть в данных условиях и больше, если бы они не ограничивались скоростью лимитирующей стадии. Другими словами, скорости всех стадий реакции вследствие концентрационных изменений участников реакции как бы подстраиваются к скорости лимитирующей стадии.
ПОЛЯРИЗАЦИОННЫЕ КРИВЫЕ
Основным отличием скорости электрохимической реакции от скорости любой гетерогенной химической реакции является ее зависимость от потенциала. Поэтому очень часто эту фундаментальную зависимость сначала выражают графически в координатах: скорость реакции в единицах плотности тока (i, А/м2) – потенциал или перенапряжение. Такая зависимость называется поляризационной кривой (катодной или анодной). Далее выводят кинетическое уравнение, описывающее данную поляризационную кривую или хотя бы часть ее и основанное на определенных представлениях о механизме протекающей реакции.
Поляризационные кривые часто имеют довольно сложный вид (рис. 8.1). При малых плотностях тока катодная и анодная поляризационные кривые имеют вид экспоненты (участок 1)*. Затем следует участок возрастающей кривой (участок 2), к которому экспоненциальное уравнение неприменимо. Участок 3 соответствует затуханию роста i с η; он переходит в площадку, отвечающую независимости плотности тока от потенциала.
На экспоненциальном участке поляризационной кривой скорость реакции обычно лимитируется стадией переноса электрона, На участке 2 скорости стадий переноса электрона и концентрационных изменений соизмеримы, в связи с чем рост плотности тока с потенциалом происходит медленнее, чем на участке 1. Участок 3 отвечает смене лимитирующей стадии. Скорость реакции здесь практически целиком ограничивается концентрационными изменениями и при концентрациях реагирующих частиц у поверхности электрода, близких к нулю, переходит в область так называемых предельных токов, не зависящих от потенциала.
В соответствии с характером поляризационных кривых эти участки имеют названия: 1) область электрохимической кинетики; 2) область смешанной кинетики; 3) область концентрационной кинетики.
Если изменение концентрации реагирующих частиц у поверхности обусловлено замедленной стадией диффузии, то область 3 называется областью диффузионной кинетики.
Кроме показанного на рис. 8.1 способа изображения поляризационных кривых, есть еще способ, представленный на рис. 8.2 и применяющийся обычно в полярографии. Согласно этому способу, вниз от линии нулевого тока откладывают анодные токи, вверх – катодные. Точка пересечения поляризационной кривой с линией
* При очень малых плотностях тока, вблизи равновесного потенциала, экспоненциальная зависимость нарушается. О причине этого см. 8.2.1.

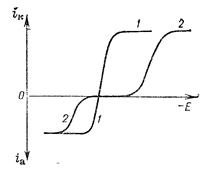
Рис. 8.1. Катодная (к) и анодная (а) поляризационные кривые на натриевом электроде в растворе NaClO4 в тетрагидрофуране концентрации 0,5 кмоль/м3.
Рис. 8.2. Поляризационные кривые реакции Ti3+ ↔ Ti4+ на ртутном капельном электроде:
1 — в растворе щавелевой кислоты (обратимый процесс); 2 — в соляной кислоте (необратимый процесс).
нулевого тока дает значение равновесного потенциала. Кривая 2 рис. 8.2 аналогична кривым рис. 8.1 и соответствует необратимому процессу, кривая 1 – обратимому.
В случае замедленного протекания электрохимической стадии происходит разделение волны на анодную и катодную и такие кривые соответствуют необратимому процессу. Если же скорость процесса лимитируется стадией диффузии и поляризационная кривая представляет собой единую анодно-катодную волну, то такой процесс называется обратимым. В этом случае перенапряжение определяется сдвигом равновесного (обратимого) потенциала из-за изменения концентрации потенциалопределяющих ионов у поверхности электрода. При изменении условий эксперимента может измениться природа замедленной стадии, а следовательно, и обратимость процесса. Кроме того, обратимость или необратимость процесса в определенной мере связана с точностью эксперимента. Так, при увеличении точности эксперимента процесс, казавшийся обратимым, может проявить характерные черты необратимости.
Методы экспериментального получения стационарных поляризационных кривых разнообразны. В гальвано- и потенциостатическом методах поддерживаются постоянными либо плотность тока, либо потенциал, а другой параметр (соответственно, потенциал или ток) регистрируется, когда достигает стационарного значения. Полученные таким методом кривые, называются стационарными поляризационными кривыми.
В динамических методах ток или потенциал изменяются с течением времени по определенному закону (обычно линейно) и регистрируется потенциал или ток, соответственно, как функция первого параметра. Такие поляризационные кривые называются динамическими, При снятий динамических кривых скорость
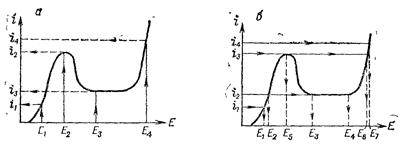
Рис. 8.3. Схема, поясняющая построение поляризационной кривой при задании постоянного потенциала (а) и постоянного тока (б).
изменения (развертки) тока или потенциала может изменяться в очень широких пределах – от сотых долей милливольта в секунду до сотен вольт в секунду. Если скорости развертки достаточно малы, то динамические поляризационные кривые, как правило, совпадают со стационарными и могут быть интерпретированы как стационарные поляризационные кривые. При высоких скоростях развертки динамические кривые существенно отличаются от стационарных, что связано как с протеканием процесса в нестационарных условиях, так и с наложением дополнительных факторов, например нефарадеевских токов (токов заряжения).
Поляризационные кривые сложных процессов существенно зависят от метода снятия кривой (с заданием тока или потенциала). Например, для кривой, изображенной на рис. 8.3, а любому заданному значению потенциала Е1 – Е4 соответствует вполне определенное значение тока i1 – i4. Если поддерживать постоянным ток, то, как видно из рис. 8.3, б, току i1 соответствует только потенциал Е1, току i2 – потенциал Е2 или область потенциалов E3 – E4, току i3 – потенциал Е5 и Е6, току i4 – потенциал Е7. Экспериментально это выражается в том, что при определенном значении тока i потенциал в области E2 – Е4 «ползает», а кривая, полученная с заданием тока, имеет вид, изображенный на рис. 8.4.
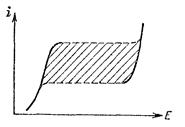

Рис. 8.4. Поляризационная кривая (рис. 8.3, б), полученная при задании постоянного тока.
Рис. 8.5. Правильное изображение поляризационной кривой, полученной в гальваностатическом режиме.
Строго говоря, при графическом изображении потенцио- и гальваностатических кривых координатные оси должны быть различны. Поскольку по оси х откладывается аргумент, а по оси y– функция, то кривые, изображенные на рис. 8.3, а и б, соответствуют потенциостатическому режиму, а гальваностатическому режиму отвечает кривая на рис. 8.5.
В литературе по электрохимии такое различие в построении поляризационных кривых не является общепринятым, поэтому следует указывать, каким способом получена та или иная кривая.%)%
