Синтетическое использование реакций расщепления двойной углерод-углеродной связи
Созидательный потенциал реакций, приводящей к разрыву углерод-углеродных связей, еще более наглядно может быть продемонстрирован на примере окислительного расщепления олефинов. Среди методов, применяемых для этой цели, особенно часто используется последовательность двух реакций: специфическое окисление олефина тетраоксидом осмия, ведущее к образованию чис-гликоля, и последующее окислительное расщепленине диола периодатом или тетраацетатом свинца (см. выше) [38d]. Эта последовательность может быть проведена в одном реакционном сосуде (при действии смеси периодат — OsO4), причем в таком случае возможно использовать каталитические количества дорогого и токсичного OsO4, так как в ходе реакции он регенерируется за счет наличия в среде избытка периодата.
Один из самых важных случаев синтетического использования окислительного расщепления алкенов — синтез 1,п-дикарбонильных соединений окислением соответствующих циклоалкенов. Так, окисление циклогексена является простейшим путем получения 1,6-диальдегида 460,из которого путем внутримолекулярной альдольной конденсации легко может бьпъ получен альдолъ 461,а из последнего — 1-формилциклопентен (462,схема 2.149).
Как окислительное расщепление двойной связи, так и альдольная конденсация в системах, подобных 460,относятся к категории общих и надежнейших методов. Поэтому связка из этих двух превращений может рассматриваться как стандартный путь преобразования легко доступной (например, с помощью диенового синтеза, восстановления по Берчу или аннелирования по Робинсону) циклогексеновой системы в функционализированные производные циклопентена (как это было сделано, например, в синтезе холестерина, см. гл. 3, схема 3.1).
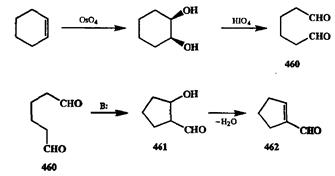 Схема 2.149 Схема 2.149 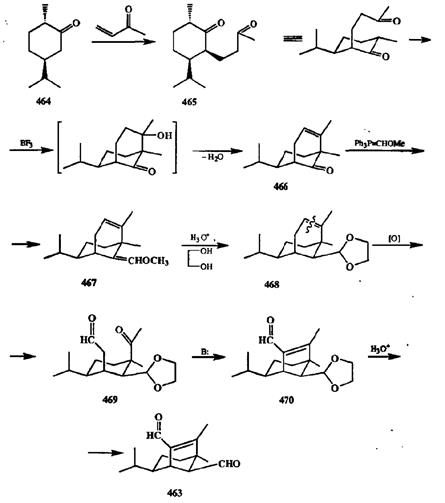 Схема 2.150 Схема 2.150 |
На схеме 2.150 показано эффективное использование этого приема на ключевой стадии сборки трициклического скелета сесквитерпена гельминоспора-ля (463),токсина грибов. В этом синтезе [38е] в качестве исходного соединения был выбран коммерчески доступный (—)-карвоментон (464),реакция которого с метилвинилкетоном приводила к образованию дикетона 465.
Внутримолекулярная кротоновая конденсация последнего дала бицикли-ческиЙ продукт 466,который по реакции Виттига был превращен в виниловый эфир 467,а из последнего был получен защищенный альдегид 468.Завершающие стадии синтеза — это уже рассмотренные выше окислительное расщепление циклогексенового фрагмента с образованием кетоальдегида 469и его «кротонизация» с получением трициклического продукта 470,из которого при гидролитическом снятии защиты и был получен целевой сеск-витерпен 463.
Расщепление фрагмента С=С на два карбонильных остатка может быть выполнено и другим способом: окислением с помощью озона. Озон быстро реагирует с алксном, давая сначала неустойчивый аддукт 471(схема 2.151), который сразу же перегруппировывается в озонид 472.Последний также нестабилен (и взрывоопасен), и его без выделения обрабатывают каким-либо восстановителем (Mc2S, H2/Pd, Zn/CH3COOH) [39а], что приводит к образованию соответствующего 1,п-дикарбонильного производного.
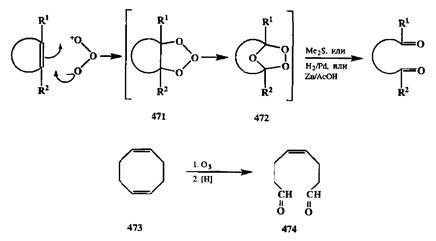 Схема 2.151 Схема 2.151 |
Озонолиз используется, в частности, для превращения промышленно доступных циклоолигомеров диенов (например, изопрена и бутадиена), таких, как 473,в бифункциональные производные типа 474.Соединения этого типа со строго фиксированным положением и конфигурацией двойных связей полезны как полупродукты синтеза многих феромонов (см., например, [39Ь]). Селективность окисления лишь одной двойной связи в системах типа 473обеспечивается использованием не более чем 1 экв. окислителя.
Наглядным примером синтетической полезности селективного окисления озоном может служить синтез ювенильного гормона (475,схема 2.152). Основной проблемой в полном синтезе этого гормона являлось созданиетребуемой геометрии двойных связей и Z-конфигурации эпоксидного фрагмента. В рассматриваемом синтезе, выполненном Кори [39с], успешное решение этой проблемы было обусловлено как тщательным выбором исходных соединений, так и применением высокоселективных методов проведения отдельных стадий.
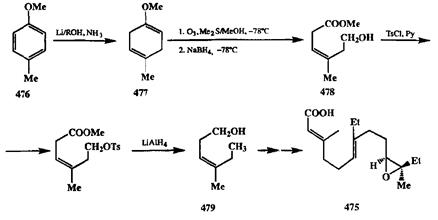 Схема 2.152 Схема 2.152 |
На первой стадии синтеза легко доступный метиловый эфир л-крезола (476)восстановлением по Берчу был превращен в диен 477.Озонирование последнего протекало как селективное окисление более нуклеофильной ме-токсизамещенной двойной связи. Восстановление озонида с хорошим выходом дало ключевой продукт синтеза, алкен 478.Z-Конфигурация двойной связи в этом соединении обеспечивала нужную стереохимию эпоксидного цикла в конечном продукте. Последующее тозилирование гидроксильной группы и гидрогенолиз тозилата при действии UAIH4 с одновременным восстановлением карбометоксильной группы дали гомоаллильный спирт 479,который далее с помощью серий стереоселективных реакций удлинения цепи был превращен в целевой продукт 475.Таким образом, благодаря связке двух эффективных реакций, а именно восстановления по Берчу и селективного озонолиза, удалось использовать исходное ароматическое производное 476в качестве синтетического эквивалента функционализованного ациклического С7-синтона с фиксированной Z-геометрией двойной связи.
