Коагуляция коллоидных систем
Проблема устойчивости коллоидных систем – одна из важнейших проблем коллоидной химии.
Русский учёный Песков предложил рассматривать:
а) седиментационную (кинетическую) устойчивость;
б) агрегативную устойчивость.
Эти два вида устойчивости имеют разные механизмы и требуют отдельного рассмотрения.
Седиментационная устойчивость – это способность дисперсной системы сохранять неизменным во времени распределение частиц по всему объёму системы, т.е. способность системы противостоять действию силы тяжести.
Чтобы оценить седиментационную устойчивость системы, необходимо знать следующие характеристики: r – радиус частицы дисперсной фазы; ρ – плотность частицы; ρ0 – плотность дисперсионной среды; η – вязкость дисперсионной среды; V – объём частицы.
Седиментационная устойчивость дисперсных систем определяется, главным образом, размерами частиц дисперсной фазы:
v Лиофобные золи (10 –7 – 10 –5 см) – седиментационно устойчивые системы, диффузия обеспечивает равномерное распределение частиц по всему объёму системы;
v микрогетерогенные системы (10 – 5 – 10 – 3 см); в них устанавливается седиментационно-диффузионное равновесие, для которого характерно распределение частиц по всему объёму системы в соответствии с теорией Гиббса;
v грубодисперсные (более 10 – 3 см) – седиментационно неустойчивы, частицы быстро выпадают в осадок.
Агрегативная устойчивость – это способность дисперсной системы сохранять во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Агрегативная устойчивость препятствует слипанию частиц и препятствует их осаждению.
Существует 5 факторов, которые могут обеспечивать агрегативную устойчивость золя: электростатический; адсорбционно-сольватный; структурно-механический; энтропийный; гидродинамический.
Важнейшим является электростатический. Он обусловлен наличием на поверхности коллоидных частиц ДЭС. Появление ДЭС на поверхности частиц приводит к возникновению электростатического отталкивания частиц, так как заряд частиц одноимённый.
Кроме того, важное значение имеет ζ-потенциал. Снижение величины ζ-потенциала до 0,025 – 0,040 В приводит к началу слипания частиц, а затем следует осаждение более крупных частиц. Этот процесс называется коагуляцией.
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся более крупными и не могут участвовать в броуновском движении.
Коагуляция самопроизвольный процесс, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но ещё не теряют своей седиментационной устойчивости.
2 стадия – явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Коагуляция возникает под действием разнообразных внешних воздействий. К ним относятся:
¨ изменение температуры;
¨ действие электрического и электромагнитного полей;
¨ действие видимого света;
¨ облучение элементарными частицами;
¨ механическое воздействие;
¨ добавление электролитов и др.
Наиболее изучена коагуляция электролитами, которая является очень важной в практическом отношении, например, при очистке воды с целью освобождения от взвешенных частиц и бактерий.
Коагуляция электролитами происходит при сравнительно невысокой концентрации добавляемого электролита. Коагуляцию вызывают все электролиты, так как при введении их в коллоидную систему происходит сжатие диффузного слоя, снижение ζ-потенциала, что и приводит к разрушению коллоидной системы. Минимальная концентрация электролита, вызывающая за данный промежуток времени определённый видимый эффект коагуляции, называется порогом коагуляции (γ) или критической концентрацией (скрит). Эта величина служит сравнительным критерием агрегативной устойчивости дисперсной системы. Критическую концентрацию принято выражать в ммоль/л.
Коагуляцию вызывает ион противополжного знака знаку заряда коллоидной частицы: для положительных – анион, для отрицательных – катион, вводимого в систему электролита. Коагулирующее действие ионатем выше, чем выше его заряд (правило Шульце-Гарди).
Теоретическими расчётами показано, что отношения порогов коагуляции одно-, двух- и трёхзарядных ионов при прочих равных условиях обратно пропорциональны шестой степени величины заряда: γ1 : γ2 : γ3 = 1/16 : 1/26 : 1/36. В среднем можно считать, что концентрация электролитов, соответствующая порогу коагуляции, с однозарядными иолнами в 60 раз выше, чем с ионами двухзарядными и, приблизительно, в 750 раз выше, чем с ионами трёхзарядными.
Правило Шульце – Гарди имеет лишь приближенный характер, так как коагулирующее действие электролита зависит не только от заряда иона. Так, например, органические однозарядные ионы (например, катион морфина) обладает более сильной специфической адсорбируемостью и легче входят во внутреннюю часть ДЭС коллоидных частиц.
Для ионов одинакового заряда порог коагуляции определяется их положением в лиотропном ряду (ряды Гофмейстера). Лиотропные ряды – ряды ионов, расположенных в порядке улучшения или ухудшения их влияния на свойства чистого растворителя, а также на скорость и глубину химических реакций и физико-химических процессов в данном растворителе. Последовательность ионов в лиотропном ряду определяется их зарядом, размером и способностью связывать молекулы растворителя. При изменении растворителя, рН среды, температуры последовательность ионов в ряду может легко меняться.
ТЕОРИЯ УСТОЙЧИВОСТИ ЛИОФОБНЫХ ЗОЛЕЙ – ТЕОРИЯ ДЛФО
Современная теория устойчивости, развитая российскими учёными Б.В. Дерягиным и Л.Д. Ландау, получила всеобщее признание.
[Дерягин Б.В. (09.08. 1902 – 16.05.1994) – российский физикохимик, академик РАН. Создатель и руководитель лаборатории тонких слоёв и поверхностных явлений. Создал (вместе с академиком Л.Д. Ландау) количественную теорию устойчивости коллоидных систем, теорию молекулярного трения, развил теорию сил адгезии и т.д. Впервые синтезировал (1967) при низких давлениях нитевидные кристаллы алмаза, алмазные плёнки. Является лауреатом Государственной премии СССР (1991)].
[Ландау Л.Д. (1908-1968), советский физик-теоретик, академик АН СССР, основатель научной школы, лаурет многих премий СССР, автор классического курса теоретической физики. Нобелевская премия (1962).]
Несколько позже такую же теорию создали голландские учёные Фервей и Овербек. Поэтому теорию называют теорией ДЛФО. Суть этой теории физической коагуляции в следующем.[
Когда коллоидные частицы подходят близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Устойчивость лиофобных золей определяется главным образом, особыми свойствами этих тонких жидких слоёв. Такой слой образуется при сближении коллоидных частиц.
Такой слой может утончаться, частицы сближаются ещё сильнее. Утончение может закончиться следующим:
А) при некоторой толщине слой разрывается, частицы слипаются;
Б) при некоторой толщине наступает равновесие – слой более не меняется, толщина остаётся постоянной. В этом случае частицы не слипаются, коагуляция не происходит.
Исследования показали, что утончение тонкого слоя при сближении частиц происходит путём вытекания из него жидкости. При толщине слоя 100 – 200 нм свойства жидкости начинают сильно отличаться от свойств жидкости в окружающем объёме. В слое появляется дополнительное давление, которое Дерягин назвал «расклинивающим давлением». По определению Дерягина, оно положительно, когда давление в слое понижено. Тогда жидкость не вытекает из слоя, а это препятствует сближению частиц. Отсюда происходит и название «расклинивающее давление», т.е. давление, которое раздвигает «расклинивает» частицы.
Если давление отрицательно, то повышается давление в слое, ускоряется вытекание из слоя жидкости, что способствует сближению частиц.
Возникновение расклинивающего давления определяется двумя факторами:
1. электростатическое взаимодействие в слое – это силы отталкивания с энергией Uотт › 0;
2. ван-дер-ваальсовы силы притяжения с энергией Uпр ‹ 0.
Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
U = Uотт + (- Uпр) = Uотт - Uпр
Если │Uотт │ › │Uпр │, то преобладают силы отталкивания, коагуляция не происходит, золь явлется агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
КИНЕТИКА КОАГУЛЯЦИИ
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции V – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы.
V = - 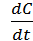 ,
,
где «c» – концентрация частиц; t – время. Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции α:
α = Zэф/Z ,
где Z – общее число столкновений частиц в единицу времени; Zэф – число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
Если α = 0, коагуляция не происходит, золь агрегативно устойчив.
Если α = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
Если 0 ‹ α ‹ 1, то идет медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары, должен быть преодолён потенциальный барьер коагуляции ∆UK. Следовательно, коагуляция произойдёт только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной для преодоления этого барьера. Это может быть достигнуто добавлением к золю электролита-коагулянта.
КОАГУЛЯЦИЯ ЭЛЕКТРОЛИТАМИ
По современной теории коагуляции электролитами, разработанной Б.В. Дерягиным и Л.Д. Ландау, порог коагуляции определяется уравнением:
γ = C 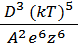 ,
,
где С – константа, зависящая от числа зарядов катиона и аниона; k – константа Больцмана; е – заряд электрона, Т – температура (в К), ε – диэлектрическая проницаемость раствора, А – константа вандерваальсова притяжения; z – величина заряда иона.
Данное уравнение хорошо согласуется с опытными данными, полученными на различных золях.
Коллоидные системы подвергаются коагуляции при невысокой концентрации электролитов. Можно в значительной степени повысить их устойчивость против коагуляции электролитами, создав дополнительно на поверхности коллоидных частиц адсорбционные слои с повышенным структурно-механическими свойствами. Они могут совершенно предотвратить коагуляцию электролитами. Такая стабилизация золя по отношению к электролитам достигается при добавлении незначительного количества высокомолекулярных веществ (желатина, казеинат натрия, яичный альбумин и т.д.) получила название защиты. Защищённые золи весьма устойчивы к электролитам. Так, коллоидные системы серебра, защищённые белковыми веществами и используемые как лекарственные препараты (протаргол, колларгол), становятся не только мало чувствительными к электролитам, но могут быть даже упарены досуха, сухой остаток после обработки водой снова может переходить в золь.
В организме в большом количестве содержатся различные растворы высокомолекулярных соединений, и одно из проявлений их защитного действия состоит в удержании в растворе карбонатов и фосфатов кальция в коллоидном состоянии. Протеины сыворотки крови стабилизируют коллоиды карбоната кальция, повышая порог коагуляции почти в 5 раз. Патологическое образование в организме различных твёрдых тел (почечные и желчные камни) связано, с одной стороны, с увеличением содержания нерастворимых оксалатов, муцина, урохрома, а с другой стороны, с возникающей нехваткой высокомолекулярных соединений для удержания указанных веществ в коллоидном состоянии.
Защитное действие различных веществ не одинаково. Мерой защитного действия служит количество вещества, достаточное для предотвращения коагуляции того или иного золя в некоторых стандартных условиях.
Так, например, для характеристики защитного действия ВМС Зигмонди предложил использовать золотое число.
Золотое число – это количество миллиграммов ВМС, которое надо добавить к 10 мл 0,0006%-го красного золя золота, чтобы предотвратить его посинение при добавлении к нему 1 мл 10%-ного раствора хлорида натрия.
[Зигмонди Рихард (1865-1929). Австрийский химик, установивший гетерогенную природу коллоидных систем, выдвинувший теорию капиллярной конденсации пара (1911), разработавший способы получения цветных стёкол; создал (совместно с Г. Зидентопфом) щелевой ультрамикроскоп (1903) и ультрафильтр (1922)]
СЕНСИБИЛИЗАЦИЯ
Иногда введение в коллоидную систему очень малых количеств ВМС приводит не к защите, а к снижению устойчивости.
Сенсибилизацией называется снижение порога коагуляции золя при добавлении в него ВМС
Это явление характерно для линейных макромолекул, несущих полярные группы на обоих концах цепи (поливиниловые спирты). Длинная молекула полимера присоединяется двумя концами к двум разным частицам дисперсной фазы, скрепляет их углеводородным мостиком. Этот вид коагуляции называют флокуляцией. В этом случае образуются рыхлые хлопьевидные частицы – флокулы.
Флокулянты достаточно дёшевы, их широко используют для очстки природных и сточных вод.
