Переходные металлы в живых организмах; аминокислотные остатки как лиганды
Шесть переходных металлов - Fe, Zn, Cu, Mn, Mo и Co - относят к так называемым «металлам жизни» - то есть металлам, необходимым для функционирования живых организмов. Кроме того, установлены физиологические функции ванадия (фиксация азота), хрома (кофактор инсулина) и никеля (стабилизация структуры ДНК и РНК) . Все они входят в состав ферментов и других биологически активных веществ (например, медь при суммарном содержании в организме человека 0,2 г входит в состав 30 ферментов) в виде комплексных соединений.Лигандами в этих комплексах являются сложные органические молекулы, а также молекулы белка (в биохимии слово "лиганд" имеет другое значение - так называют малую органическую молекулу, присоединившуюся к белку).
Типичные нейтральные неорганические лиганды σ-типа - это молекулы воды и аммиака. Типичные лиганды анионного типа - это кислотные остатки: Cl‾, F‾, CN‾, NO2‾ и и т.д. Все они способны образовывать связи с металлом-комплексообразователем по донор-но-акцепторному механизму, предоставляя для этого свою электронную пару. Органические молекулы, содержащие атомы азота, серы и кислорода с неподеленными электронными парами (НЭП), тоже могут участвовать в реакциях комплексообразования. Такие атомы есть в боковых цепях многих аминокислот, поэтому в белковых молекулах всегда имеются группы, способные образовывать связи с ионами металлов. На рисунке приведены примеры таких аминокислот.
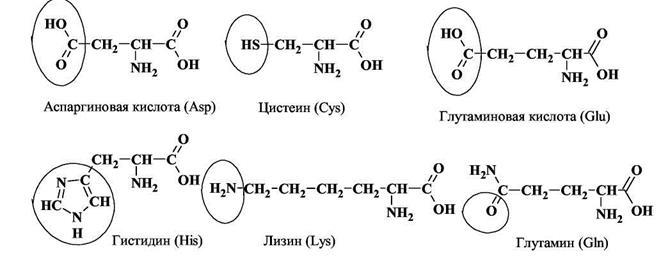
Группы, содержащие потенциальные донорные атомы, выделены. Способность к компле-ксообразованию остатков аспаргиновой и глутаминовой кислот возрастает при диссоциации карбоксильной группы и переходе ее в анионное состояние. Именно в таком состоянии эти остатки обычно и находятся в белках при нейтральной реакции среды.
2. Имидазол: его строение, координационные и кислотно-основные свойства
Наиболее часто белки образуют комплексные соединения с участием гистидиновых остатков, в состав которых входит имидазол - пятичленный цикл с двумя атомами азота: пир-рольного и пиридинового типа (см. рисунок). Оба этих атома имеют неподеленные электронные пары, которые, однако, различаются по своим свойствам. НЭП атома азота пир-рольного типа участвует в образовании ароматической я-системы и поэтому не принадлежит одному только атому азота, а распределена по всему циклу. В таких случаях говорят, что электронная пара делокализована.Делокализацию можно изобразить при помощи резонансных структур. Неподеленная электронная пара атома азота пиридинового типа локализованаи не участвует в образовании я-связей. Поэтому при образовании координационных связей донором электронной пары может быть только этот атом.
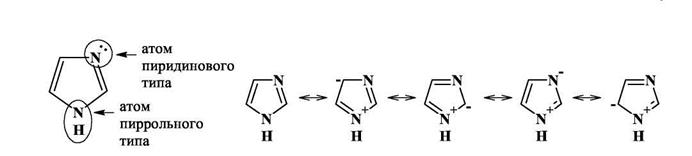
Однако в молекуле гистидина и в гистидиновом остатке атом водорода может переходить от одного атома азота к другому, при этом пиррольный и пиридиновый атомы азота меняются местами. Константа равновесия этого процесса близка к 1, поэтому в белках можно встретить гистидиновые остатки с атомом водорода как в δ-, так и в 8-положении. Сдвиг равновесия происходит под влиянием окружения, в котором находится гистидино-вый остаток. Например, если рядом с одним из атомов азота находится ион металла, то атом водорода от этого атома уйдет, чтобы не препятствовать образованию координационной связи. Наоборот, если вблизи окажется отрицательно заряженная карбоксилатная группа, то нахождение здесь атома водорода станет энергетически выгодным, так как образуется водородная связь.
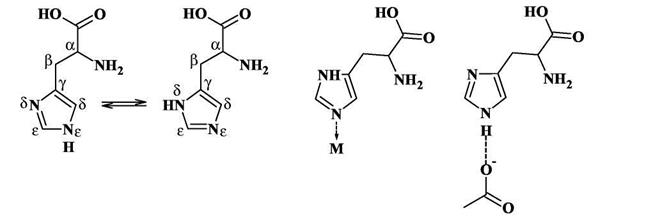
Почему наиболее важным лигандом является именно остаток гистидина, а не остатки, содержащие аминогруппы, например, лизин? Дело в том, что аминогруппа в этих остатках является более сильным основанием, чем имидазольная группа в гистидине: константа диссоциации типичного алкиламина как основания равна 4-10-4 моль/л, тогда как для имидазола она равна 1,6-10-7.
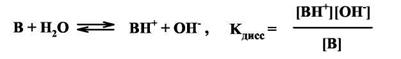
При pH=7,4 (типичное значение рН плазмы человеческой крови) соотношение концентраций катионной формы ВН* и нейтрального основания В составляет для алкиламинов 1600, а для имидазола - лишь 0,64. Поэтому почти все боковые аминогруппы белковых молекул существуют в виде катионов RNH3+, тогда как протежированных (катионов ВН*) и нейтральных гистидиновых остатков в белке должно быть практически поровну, причем небольшое изменение рН приведет к значительному сдвигу равновесия либо в сторону нейтральной формы имидазола, либо в сторону катионной.
Растворимость кислорода в воде − лишь 0,000044 г/мл при 293 К и атмосферном давлении; примерно такой же способностью к растворению кислорода обладает и плазма крови. Для обеспечения активной жизнедеятельности организма кровь должна переносить намного больше кислорода. Органические жидкости растворяют кислород лучше, чем вода. Например, перфторированные углеводороды при тех же условиях могут содержать до 0,03 г/мл кислорода, и их эмульсии сейчас пытаются использовать в качестве кровезаменителей. Однако природа пошла по другому пути - по пути создания соединений, способных к обратимому присоединению и кислорода. Эти соединения - белки, содержащие в качестве активного центра, к которому и присоединяется молекула Ог, комплексы железа или меди. Благодаря этим белкам, человеческая кровь способна переносить в 70 раз больше кислорода, чем если бы он просто растворялся в ней.
Строение гема
Наиболее известным переносчиком кислорода является гемоглобин.Он присутствует в организмах позвоночных, а также и ряда беспозвоночных (например, двустворчатых моллюсков, морских многощетинковых червей, голотурий). Молекула гемоглобина состоит из белковой части - глобинаи гсма- комплекса Fe(II) с одним из порфиринов-так называемым протопорфирином IX.Порфирин - это циклическая молекула, в состав которой входит 4 пиррольные группы. Так выглядит молекула гема:
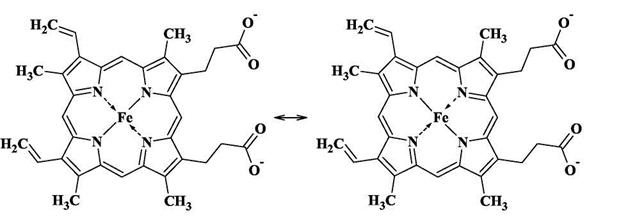
Атом железа образует с атомами азота две ковалентные и две координационные (донорно-акцепторные) связи. В действительности же все 4 связи Fe-N почти равноценны (как и 4 связи N-H в катионе аммония), поэтому вклад резонансных структур примерно одинаков. С трех сторон порфириновый цикл гема содержит гидрофобные заместители -метальные и винильные группы, а с четвертой стороны - две гидрофильные карбоксильные группы, которые в нейтральной среде находятся в анионной форме СОО-. Координационное число атома железа в геме равно 4, поэтому он может образовывать еще две координационные связи, дополняя свое окружение до октаэдрического.
