Кислотные и основные гидроксиды
Гидроксиды - тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН)n, где n = 1÷6. Форма гидроксидов Е(ОН)n называется орто-формой; при n > 2 гидроксид может находиться также в мета-форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2. Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.
Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета-форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов НхЕОу, где электроотрицательную составляющую ЕОух называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка. Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием “ая” и группового слова “кислота”. Ниже приведены формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):
| кислотный гидроксид | кислотный остаток |
| HAsO2 метамышьяковистая | AsO2- метаарсенит |
| H3AsO3 ортомышьяковистая | AsO33- ортоарсенит |
| H3AsO4 мышьяковая | AsO43- арсенат |
| В4О7 2- тетраборат | |
| ВiО33- висмутат | |
| HBrO бромноватистая | BrO- гипобромит |
| HBrO3 бромноватая | BrO3- бромат |
| H2CO3 угольная | CO32- карбонат |
| HClO хлорноватистая | ClO-гипохлорит |
| HClO2 хлористая | ClO2- хлорит |
| HClO3 хлорноватая | ClO3- хлорат |
| HClO4 хлорная | ClO4- перхлорат |
| H2CrO4 хромовая | CrO42- хромат |
| НCrO4-гидрохромат | |
| H2Cr2О7 дихромовая | Cr2O72- дихромат |
| FeO42- феррат | |
| HIO3 иодноватая | IO3-иодат |
| HIO4 метаиодная | IO4-метапериодат |
| H5IO6 ортоиодная | IO65- ортопериодат |
| HMnO4 марганцовая | MnO4-перманганат |
| H2MnO4 марганцовистая | MnO42- манганат |
| H2MоO4 молибденовая | MоO42-молибдат |
| HNO2 азотистая | NO2-нитрит |
| HNO3 азотная | NO3- нитрат |
| HPO3 метафосфорная | PO3- метафосфат |
| H3PO4 ортофосфорная | PO43-ортофосфат |
| НPO42- гидроортофосфат | |
| Н2PO4- дигидроотофосфат | |
| H4P2O7 дифосфорная | P2O7 -4 дифосфат |
| НReO4 рениевая | ReO4- перренат |
| H2SO3 сернистая | SO32- сульфит |
| HSO3- гидросульфит | |
| H2SO4 серная | SO42- сульфат |
| НSO4- гидросульфат | |
| H2S2O7 дисерная | S2O72- дисульфат |
| H2S2O6(O2) пероксодисерная | S2O6(O2)2- пероксодисульфат |
| H2SO3S тиосерная | SO3S2- тиосульфат |
| H2SeO3 селенистая | SeO32- селенит |
| H2SeO4 селеновая | SeO42- селенат |
| H2SiO3 метакремниевая | SiO32- метасиликат |
| H4SiO4 ортокремниевая | SiO44- ортосиликат |
| H2TeO3 теллуристая | TeO32- теллурит |
| H2TeO4 метателлуровая | TeO42- метателлурат |
| H6TeO6 ортотеллуровая | TeO66- ортотеллурат |
| НVO3 метаванадиевая | VO3- метаванадат |
| H3VO4 ортованадиевая | VO43- ортованадат |
| H2WO4 вольфрамовая | WO42- вольфрамат |
Названия кислотных остатков используют при построении названий солей.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Классификация
1. По составу: бескислородные и кислородсодержащие.
2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные.
Бескислородные:
| Кислота | Название соли, анион |
| HCl - хлористоводородная (соляная), одноосновная | Хлорид, Cl- |
| HBr – бромистоводородная, одноосновная | Бромид, Br- |
| HI – йодистоводородная, одноосновная | Йодид, I- |
| HF - фтористоводородная (плавиковая), одноосновная | Фторид, F- |
| H2S - сероводородная двухосновная, | Сульфид, S2- |
Получение
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 = BaSO4↓+ 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl = H2SiO3↓+ 2NaCl
2NaCl(тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑
Химические свойства
1. Действие на индикаторы.
лакмус - красный
метилоранж - розовый
2. Взаимодействие с основаниями (реакция нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
3. Взаимодействие с основными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
4. Взаимодействие с металлами(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители):
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Азотная кислота взаимодействует с металлами, стоящими в ряду напряжений как до водорода, так и после (кроме золота и платины), без выделения водорода, при этом происходит восстановление азота от степени окисления +5 до +4 – (-3) в зависимости от степени разбавления кислоты и активности металла. Восстановление тем глубже, чем активнее металл и ниже концентрация кислоты:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
5Mg + 12HNO3(разбавл.) = 5Mg(NO3)2 + N2 + 6H2O
4Mg + 10HNO3(сильно разбавл.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Азотная кислота (особенно при нагревании) способна окислять не только металлы, но и многие неметаллы, кроме кремния, фтора и хлора. При этом концентрированная HNO3 восстанавливается чаще всего до NO2 , а разбавленная – до NO:
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
P + 5HNO3(конц.) = H3PO4 + 5NO2 + H2O
C + 4HNO3(конц.) = CO2 + 4NO2 + 2H2O
3P + 5HNO3(разбавл.) + 2H2O = 3H3PO4 + 5NO
I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
Разбавленная серная кислота взаимодействует только с металлами, стоящими в ряду напряжений металлов до водорода, с выделением водорода.
Zn + H2SO4(разбавл.) = ZnSO4 + Н2
Концентрированная серная кислота реагирует как с металлами, находящимися в ряду напряжений как до водорода, так и после (кроме Au, Pt), без выделения водорода. С более активными металлами восстановление серы глубже:
8Na +5H2SO4(конц) = 4Na2SO4 + 4H2O + H2S
3Zn + 4H2SO4(конц) = 3ZnSO4 + S
5. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 = BaSO4 +2HCl
2HCl + K2CO3 = 2KCl + H2O + CO2
Основные гидроксиды.
Основаные гидроксиды состоят из иона металла и гидроксогрупп (OH-). Например, NaOH, Mg(OH)2, La (OH)3, Ca (OH)2.
ОН- — это гидроксид - ион, заряд его равен — 1. Число гидроксид - ионов в основании определяется степенью окисления металла.
Номенклатура. Название основания составляется из слов “гидроксид” + название металла в родительном падеже. Например, КОН — гидроксид калия, Ва(ОH)2 — гидроксид бария, La(OH)3 — гидроксид лантана.
Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 — гидроксид железa (II), Bi(OH)3 — гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 — дигидроксид кальция, Вi(ОН)3 — тригидроксид висмута.
Число гидроксогрупп в молекуле основания определяет его кислотность. Например, NaOH, КОН, NH4OH — однокислотные основания, Ca(OH)2, Sr(OH)2, Ва(OH)2 — двухкислотные основания, La(OH)3, Bi(OH)3 — трехкислотные основания, Th(OH)4 — четырехкислотное основание. Пятикислотные и шестикислотные основания неизвестны.
Остатки оснований. Положительно заряженные группы атомов (положительные ионы), которые остаются после отрыва от молекулы основания одной или нескольких гидроксогрупп, называются остатками основания или радикалами основания. Величина положительного заряда остатка основания определяется числом отрывавшихся гидроксогрупп.
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто-форме; их общая формула М(ОН)n, где n = 1,2 (реже 3,4) и Мn+ катион металла. Примеры формул и названий основных гидроксидов и их остатков:
| Название oснования | Формула | Кислотность, остаток |
| Гидроксид натрия | NaОН | 1, Na+ Натрий-ион |
| Гидроксид магния | Mg(ОН)2 | 2, Mg2+ Магний –ион, MgOH+ Гидроксомагний - ион |
| Гидроксид висмута (III) | Bi(OH)3 | 3, Bi3+ Висмут (III)-ион, Bi(OH)2+ Гидроксовисмут (III)-ион, Bi(OH)2+ Дигидроксовисмут (III)-ион |
| Гидроксид меди (I) | CuOH | 1, Cu+ Медь(I)-ион |
| Гидроксид марганца (II) | Mn (OH)2 | 2, Mn2+ Марганец (II) – ион, MnOH+ Гидроксомарганец (II) – ион |
Получение
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Химические свойства
1. Действие на индикаторы растворимых основных гидроксидов.
лакмус - синий
метилоранж - жёлтый
фенолфталеин - малиновый
2. Взаимодействие с кислотными оксидами.
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
3. Взаимодействие с кислотами (реакция нейтрализации) с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
NaOH + HNO3 = NaNO3 + H2O
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
4. Обменная реакция с солями
Ba(OH)2 + K2SO4 = 2KOH + BaSO4 ↓
3KOH+Fe(NO3)3 = Fe(OH)3 ↓+ 3KNO3
5. Термический распад.
Cu(OH)2 –t° = CuO + H2O
3.4 Кислотные и оснόвные оксиды
Оксиды ЕхОy продукты полной дегидратации гидроксидов:
| H2SO4 - H2O → SO3 | H2CO3 - H2O → CO2 |
| NaOH - H2O → Na2O | Ca(OH)2 - H2O → CaO |
Кислотным гидроксидам (H2SO4, H2CO3) отвечают кислотные оксиды (SO3, CO2), а основным гидроксидам (NaOH, Ca(OH)2) основные оксиды (Na2O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду. Пример формул и названий оксидов:
| SO3 триоксид серы | Nа2О оксид натрия |
| N2O5 пентаоксид диазота | La2O3 оксид лантана (III) |
| P4O10 декаоксид тетрафосфора | ThO2 оксид тория (IV) |
Химические свойства
Основные оксиды Кислотные оксиды
1. Взаимодействие с водой
Образуется основание: Образуется кислота:
Na2O + H2O = 2NaOH SO3 + H2O = H2SO4
CaO + H2O = Ca(OH)2 P2O5 + 3H2O = 2H3PO4
2. Взаимодействие с кислотой или основанием:
При реакции с кислотой При реакции с основанием
образуется соль и вода образуется соль и вода
MgO + H2SO4 = MgSO4 + H2O CO2 + Ba(OH)2 = BaCO3 + H2O
CuO + 2HCl = CuCl2 + H2O SO2 + 2NaOH = Na2SO3 + H2O
Амфотерные оксиды взаимодействуют
с кислотами как основные: ZnO + H2SO4 = ZnSO4 + H2O
с основаниями как кислотные: ZnO + 2NaOH = Na2ZnO2 + H2O при сплавлении в отсутствие воды
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] в водном растворе
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.
Na2O + CO2 = Na2CO3
4. Восстановление до простых веществ:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
P2O5 + 5C = 2P + 5CO
3.5 Амфотерные оксиды и гидроксиды
Амфотерность гидроксидов и оксидов химическое свойство, заключающееся в образовании ими двух рядов солей, например, для гидроксида и оксида алюминия:
(а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
(б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль сульфат алюминия Al2(SO4)3, тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль диоксоалюминат (III) натрия NaAlO2. В первом случае элемент алюминий проявляет свойство металла и входит в состав электроположительной составляющей (Al3+), во втором свойство неметалла и входит в состав электроотрицательной составляющей формулы соли (AlO2). Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
2Al(OH)3 + 3H2SO4 = [Al(H2O)6]2(SO4)3
Al(OH)3 + NaOH = Na[Al(OH)4]
Здесь квадратными скобками выделены комплексные ионы [Al(H2O)6]3+ - катион гексаакваалюминия(III), [Al(OH)4] - тетрагидроксоалюминат(III)-ион. Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерные оксиды называют так же, как и основные, например:
| BeO оксид бериллия | FeO оксид железа(II) |
| Al2O3 оксид алюминия | Fe2O3 оксид железа(III) |
| SnO оксид олова(II) | MnO2 оксид марганца(IV) |
| SnO2 диоксид олова(IV) | ZnO оксид цинка(II) |
Амфотерные гидроксиды (если степень окисления элемента превышает + II) могут находиться в орто или (и) мета форме. Приведем примеры амфотерных гидроксидов:
| Be(OH)2 | гидроксид бериллия |
| Al(OH)3 | гидроксид алюминия (орто) |
| AlO(OH) | метагидроксид алюминия |
| TiO(OH)2 | дигидроксидоксид титана |
| Fe(OH)2 | гидроксид железа(II) |
| FeO(OH) | метагидроксид железа |
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
| SnO2 . nH2O | полигидрат оксида олова(IV) |
| Au2O3 . nH2O | полигидрат оксида золота(I) |
| Au2O3 . nH2O | полигидрат оксида золота(III) |
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4. Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например HMnO4 марганцовая кислота.
Таким образом, деление элементов на металлы и неметаллы условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами.
Соли
Соли - сложные вещества, которые состоят из катиов металла и анионов кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация. СОЛИ бывают: средние, кислые, основные, двойные, смешанные, комплексные. Соли тип сложных веществ, в состав которых входят катионы Мn+ и кислотные остатки. Соли с общей формулой Мх(ЕОу)n называют среднимисолями, а соли с незамещенными атомами водорода - кислыми солями. Иногда соли содержат в своем составе также гидроксид- или(и) оксид-ионы; такие соли называют основными солями. Приведем примеры и названия солей:
| Ca3(PO4)2 | ортофосфат кальция |
| Ca(H2PO4)2 | дигидроортофосфат кальция |
| CaHPO4 | гидроортофосфат кальция |
| CuCO3 | карбонат меди(II) |
| Cu2CO3(OH)2 | дигидроксид-карбонат димеди |
| La(NO3)3 | нитрат лантана(III) |
| Ti(NO3)2O | оксид-динитрат титана |
Средние. При диссоциации дают только катионы металла (или NH4+)
Na2SO4 → 2Na+ +SO42-
CaCl2 → Ca2+ + 2Cl-
Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 → Na+ + HCO3- → Na+ + H+ + CO32-
Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла.
Основные. При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl → [Zn(OH)]+ + Cl- → Zn2+ + OH- + Cl-
Продукты неполного замещения групп OH соответствующего основания на кислотные остатки.
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 → Ca2+ + Cl- + OCl-
Комплексные. Содержат сложные катионы или анионы.
[Ag(NH3)2]Br → [Ag(NH3)2]+ + Br -
Na[Ag(CN)2] → Na+ + [Ag(CN)2]-
Средние соли
Название
Средние соли называют используя название кислотного остатка в именительном падеже и катиона металла в родительном. Например, соли К3РО4, Са(NO3)2, NaCl называют фосфат калия, нитрат кальция, хлорид натрия соответственно.
Получение
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом:
2Na + Cl2 = 2NaCl
2) металла с кислотой:
Zn + 2HCl = ZnCl2 + H2
3) металла с раствором соли менее активного металла
Fe + CuSO4 = FeSO4 + Cu
4) основного оксида с кислотным оксидом:
MgO + CO2 = MgCO3
5) основного оксида с кислотой
CuO + H2SO4 = CuSO4 + H2O
6) основания с кислотным оксидом
Ba(OH)2 + CO2 = BaCO3 + H2O
7) основания с кислотой:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8) соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
9) раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
10) растворов двух солей с образованием осадка нерастворимой соли:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓+ 6NaCl
11) Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Ca(HSO4)2 + Ca(OH) = CaSO4↓+ 2H2O
(CaOH)2SO4 + H2SO4 = 2CaSO4↓+ 2H2O
Химические свойства
1. Термическое разложение.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
NH4Cl = NH3 + HCl
2. Гидролиз.
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Na2S + H2O = NaHS +NaOH
3. Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl = AgCl + HNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl
4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Кислые соли
Название
Кислые соли называют аналогичным образом, добавляя к названию кислотного остатка приставку гидро, дигидро, тригидро, и.т.д. Например, соли КН2РО4, NaHSO4, СsHCO3 называют дигидрофосфат калия, гидросульфат натрия, гидрокарбонат цезия соответственно.
Получение
1. Взаимодействие кислоты с взятым в недостатке основанием.
KOH + H2SO4 = KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Химические свойства.
1. Термическое разложение с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
2. Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Основные соли
Название
Основные соли называют аналогично средним, добавляя к названию катиона приставку гидроксо, дигидроксо и. т.д. Например, соли ZnOHCl, Fe(OH)2Cl, AlOHSO4 называют хлорид гидроксоцинка, хлорид дигидроксожелеза, сульфат гидроксоалюминия соответственно.
Получение
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Химические свойства.
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
2. Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl = SnCl2 + H2O
Бинарные соединения
Большую группу неорганических сложных веществ составляют бинарные соединения. К ним относятся, в первую очередь все двухэлементные соединения (кроме основных, кислотных и амфотерных оксидов), например H2O, KBr, H2S, Cs2(S2), N2O, NH3, HN3, CaC2, SiH4. Электроположительная и электроотрицательная составляющие формул этих соединений включают отдельные атомы или связанные группы атомов одного элемента.
Многоэлементные вещества, в формулах которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения, например CSO, IO2F3, SBrO2F, CrO(O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2(NH2). Так, CSO можно представить как соединение CS2, в котором один атом серы заменен на атом кислорода.
Названия бинарных соединений строятся по обычным номенклатурным правилам, например:
| OF2 дифторид кислорода | K2O2 пероксид калия |
| HgCl2 хлорид ртути(II) | Na2S сульфид натрия |
| Hg2Cl2 дихлорид диртути | Mg3N2 нитрид магния |
| SBr2O оксид-дибромид серы | NH4Br бромид аммония |
| N2O оксид диазота | Pb(N3)2 азид свинца(II) |
| NO2 диоксид азота | CaC2 ацетиленид кальция |
Для некоторых бинарных соединений используют специальные названия, список которых был приведен ранее.
Химические свойства бинарных соединений довольно разнообразны, поэтому их часто разделяют на группы по названию анионов, т.е. отдельно рассматривают галогениды, халькогениды, нитриды, карбиды, гидриды и т. д. Среди бинарных соединений встречаются и такие, которые имеют некоторые признаки других типов неорганических веществ. Так, соединения CO, NO, NO2, и (FeIIFe2III)O4, названия которых строятся с применением слова оксид, к типу оксидов (кислотных, основных, амфотерных) отнесены быть не могут. Монооксид углерода СО, монооксид азота NO и диоксид азота NO2 не имеют соответствующих кислотных гидроксидов (хотя эти оксиды образованы неметаллами С и N), не образуют они и солей, в состав анионов которых входили бы атомы СII, NII и NIV. Двойной оксид (FeIIFe2III)O4 оксид дижелеза(III)-железа(II) хотя и содержит в составе электроположительной составляющей атомы амфотерного элемента
железа, но в двух разных степенях окисления, вследствие чего при взаимодействии с кислотными гидроксидами образует не одну, а две разные соли.
Такие бинарные соединения, как AgF, KBr, Na2S, Ba(HS)2, NaCN, NH4Cl, и Pb(N3)2, построены, подобно солям, из реальных катионов и анионов, поэтому их называют солеобразными бинарными соединениями (или просто солями). Их можно рассматривать как продукты замещения атомов водорода в соединениях НF, НCl, НBr, Н2S, НCN и НN3. Последние в водном растворе обладают кислотной функцией, и поэтому их растворы называют кислотами, например НF(aqua) фтороводородная кислота, Н2S(aqua) сероводородная кислота. Однако они не принадлежат к типу кислотных гидроксидов, а их производные к солям в рамках классификации неорганических веществ.
Гидриды металлов
Известны соединения с водородом всех элементов, кроме благородных газов, платиновых металлов (кроме Pd): Ag, Au, Cd, Hg, In, Tl.
Комплексные гидриды металлов LiAlH4, NaBH4 широко используются в органическом синтезе в качестве восстанавливающих реагентов.
При нагревании с металлами водород (Н2) образует гидриды:
2Li + H2 = 2LiH
Ca + H2 = CaH2
Гидриды металлов неустойчивы и легко разлагаются водой:
LiH + H2O = LiOH + H2
Они являются сильными основаниями и способны оторвать протон даже от весьма слабых органических кислот:
CH3-CO-CH3 + Na+H- = CH3-CO-C-H2Na+ + H2
СТРОЕНИЕ АТОМА
4.1 Исторические этапы развития представлений о строении атома
Большую роль в установлении структуры атома сыграло открытие и изучение радиоактивности. Кроме того, на рубеже XIX–XX вв. были открыты такие явления, как фотоэлектрический эффект, катодные лучи, рентгеновские лучи. Эти открытия свидетельствовали о сложной структуре атома.
Первоначально были предложены две модели атома. Согласно модели Томсона, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда. Для проверки гипотезы Томсона Резерфорд провел опыты по рассеиванию a-частиц металлическими пластинками. Эти опыты показали, что основная доля a-частиц проходила через пластинки беспрепятственно, т.е. подавляющая часть пространства, занимаемого атомом, является «пустой», а почти вся его масса занимает очень малую долю объема. Резерфордом в 1911 г. была предложена планетарная модель атома. Согласно этой модели, атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов.
Эта модель первоначально не могла объяснить устойчивость атома, так как вращающийся вокруг ядра электрон должен излучать энергию. Любая заряженная частица, движущаяся с ускорением, излучает электромагнитные волны. Движение электрона вокруг ядра является ускоренным (центростремительное ускорение). и в конце концов «упасть» на ядро. Вторым противоречием этой модели была невозможность объяснить линейчатый характер атомных спектров, т.е. излучение атомом электромагнитных волн только с определенными длинами волн.
Для устранения этих противоречий Бор в 1913 году дополнил планетарную модель атома на основе следующих предположений (постулаты Бора):
1) Электрон может вращаться вокруг ядра не по любым орбитам, а лишь по некоторым определенным (стационарным) орбитам, на которых он не излучает энергии.
2) Ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. При сообщении энергии извне электрон может перейти на одну из более удаленных орбит (возбужденное состояние атома).
3) Поглощение и излучение энергии атомом может происходить только при переходе электрона с одной орбиты на другую. При этом разность энергий начального и конечного состояний воспринимается или отдается в виде кванта лучистой энергии. Этому излучению соответствует частота колебаний ν, выражаемая уравнением Планка:
hν = Eн – Eк ,
где h – постоянная Планка (h=6,62 ×10–34 Дж×с); Ен, Ек – соответственно энергии начального и конечного состояний (Рис.4.1.).
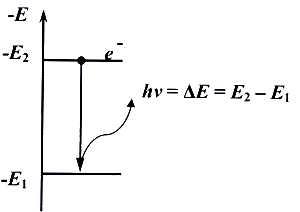
Рис.4.1. Переход электрона с одного энергетического уровня на другой.
Для того, чтобы объяснить, почему имеет место квантование энергетических уровней (существование стационарных орбит), в 1924 г. де Бройлем была выдвинута гипотеза, что любая движущаяся частица одновременно обладает свойствами волны, длина которой
λ = h/(m . v), где m – масса частицы, v – ее скорость.
Эта гипотеза основывалась на последних достижениях физики того времени (например, было уже известно, что свет имеет двойственную природу, обладая свойствами электромагнитной волны с длиной λ = с/ν и одновременно свойствами потока частиц – фотонов с энергией каждого Е = hν. Гипотеза де Бройля экспериментально подтверждается дифракцией электронов в кристаллах и позволяет объяснить существование стационарных орбит. Электрон может без потери энергии находиться на тех орбитах, в которых укладывается целое число волн де Бройля. В этом случае соблюдается условие существования стоячей волны.
Возможность рассматривать каждую частицу одновременно как волну называется корпускулярно-волновым дуализмом. Из него вытекает соотношение неопределенностей Гейзенберга. Согласно классической механике, движение материальной точки однозначно описывается значениями координат и импульса. Импульсом называется произведение массы объекта на его скорость: p = mv. В случае микрообъектов, когда движение происходит в соответствии с законами квантовой механики, описать координаты и скорость с любой точностью принципиально невозможно.
4.2 Волновое уравнение. Квантовомеханическое объяснение строения атома
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома.
Согласно квантовой механике, движение электрона в атоме описывается волновым уравнением (уравнение Шредингера):
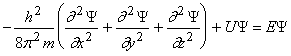
где Y – волновая функция;
m – масса электрона. Масса покоя электрона me = 9,109.10-31 кг;
U – потенциальная энергия;
E – полная энергия электрона;
x, y, z – координаты электрона в системе с центром в ядре атома.
Решением уравнения Шредингера является волновая функция Y и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции. Квадрат волновой функции в данной точке пространства |Y|2 – это плотность вероятности обнаружения электрона в этой точке пространства. Значит величина |Y|2 . dv – вероятность обнаружить электрон в области пространства dv. Вероятность обнаружить электрон в какой-нибудь точке пространства равна единице, т.е. 
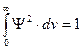 , причем величина волновой функции вдали от ядра атома близка к нулю и, поэтому электрон находится вблизи ядра. Область пространства, ограниченная поверхностью одинакового значения величины волновой функции электрона, вероятность обнаружения электрона в которой составляет 0,9 (или 90%) называется электронным облаком.
, причем величина волновой функции вдали от ядра атома близка к нулю и, поэтому электрон находится вблизи ядра. Область пространства, ограниченная поверхностью одинакового значения величины волновой функции электрона, вероятность обнаружения электрона в которой составляет 0,9 (или 90%) называется электронным облаком.
Таким образом, в квантовомеханической (вероятностной) модели атома исчезает смысл орбиты, на которой находится электрон. Взамен ее мы имеем дело с электронной плотностью, «размазанной» в пространстве атома.
Наличие трех измерений пространства приводит к тому, что в выражении волновой функции Y, являющейся решением уравнения Шредингера, появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n, ℓ и ml. Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.
