Химическая и электрохимическая коррозия металлов.
Химическая коррозия - самопроизвольное разрушение металлических материалов вследствие их взаимодействия с коррозионной средой, при котором окисление металла и восстановление окислителя - пространственно неразделенные процессы.
Процесс химической коррозии можно описать реакцией вида:
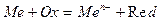 .
.
Химическая коррозия наблюдается при помещении металлических материалов в атмосферу раскаленных газов или в жидкость,не являющуюся электролитом (нефть, бензин и т.д.). Наиболее распространенный вид химической коррозии - газовая коррозия.
Электрохимическая коррозия – самопроизвольное разрушение металлических материалов вследствие их электрохимического взаимодействия с окружающей, электролитически проводящей средой.
Главная особенность электрохимической коррозии состоит в том, что в процессе ее течения, ионизациия атомов металла и восстановление окислителя, содержащегося в коррозионной среде – пространственно разделенные акции, а их скорости определяются величинами электродных потенциалов. Кроме того, процесс электрохимической коррозии сопровождается наличием электрического тока в корродирующем металле.
Этот тип коррозии наиболее распространен. Он реализуется при взаимодействии металлических материалов с электролитами: водными растворами солей, кислот, щелочей, расплавами солей и щелочей.
Вопрос 12. Водородные соединения неметаллов. Закономерности в изменении их свойств, в связи с положением элементов в периодической системе Д. И. Менделеева.
Вопрос 13. Высшие оксиды и гидроксиды химических элементов третьего периода. Закономерности в изменении их свойств, в связи с положением элементов в периодической системе.
Вопрос 14. Кислоты: классификация, свойства на основе теории электролитической диссоциации, практическое применение.
Кислоты
Уравнения диссоциации кислот можно записать более точно, с учетом гидратации ионов
НCl(газ.)  Н+ (водн.) + Cl- (водн.)
Н+ (водн.) + Cl- (водн.)
СН3СООН(водн.)  Н+(водн.) + CH3COO-(водн.)
Н+(водн.) + CH3COO-(водн.)
Как видно, кислоты в воде диссоциируют на ионы водорода и кислотные остатки - анионы. Никаких других катионов, кроме ионов водорода, кислоты не образуют. Механизм диссоциации кислот: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - в гидратированные ионы.
Различают кислородные и бескислородные кислоты. Как показывает само название, первые содержат кислород (например, Н2SО4, НNО3, Н3РО4), вторые его не содержат (например, НСl, НВr, НI, Н2S).
Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний –ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
|
|
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется префикс «мета», при наибольшем числе - префикс « орто»:
| НВО2 - метаборная кислота | Н2n(SiO3)n- полиметакремниевая кислота |
| Н3ВО3- ортоборная кислота | H4SiO4 - ортокремниевая кислота |
Названия бескислородных кислот производятся от названия неметалла с окончанием о и прибавлением слова водородная:
НF - фтороводородная, или плавиковая, кислота
НCl - хлороводородная, или соляная, кислота
НBr - бромоводородная кислота
НI - йодоводородная кислота
Н2S - сероводородная кислота
Свойства:
Большинство кислородных кислот получают при взаимодействии оксидов неметаллов (в высокой степени окисления) с водой. Например:
SO3 + H2O H2SO4; N2O5 + H2O = 2HNO3
Если такие оксиды нерастворимы в воде, то соответствующие им кислоты получают косвенным путем, а именно, действием другой кислоты (чаще всего серной) на соответствующую соль. Например:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Бескислородные кислоты получают путем соединения водорода с неметаллом с последующим растворением водородного соединения в воде. Таковы НF, НСl, НВr, НI, H2S.
Свойства.
Кислоты представляют собой жидкости (Н2SO4, НNO3 и др.) или твердые вещества (Н3PO4 и др.). Многие кислоты хорошо растворимы в воде. Растворы их имеют кислый вкус, разъедают растительные и животные ткани, изменяют синий цвет лакмуса на красный.
Кислоты реагируют с основаниями (а также с основными и амфотерными оксидами и гидроксидами) с образованием солей. Например:
HCl + NaOH = NaCl + H2O
H2SO4 + Fe(OH)2 = FeSO4 + 2H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
Кислоты классифицуируются по следующим признакам:
по силе (как электролиты) - на сильные (например HCl, HNO3, H2SO4) и слабые (H2S, HNO2, HCN и т.д.)
по наличию кислорода в составе кислоты - на кислородные (HClO3, H3PO4) и бескислородные (HCN, H2S). При этом элемент, входящий в состав кислородной кислоты называется кислотообразующим.
по основности (т.е. по числу атомов водорода в молекуле кислоты, способных замещаться на металл) на одноосновные (HCl, HNO3), двухосновные (H2SO3, H2S), трехосновные (H3PO4) и т.д.
по окислительным свойствам - на обычные кислоты, у которых в окислительно-восстановительных реакциях, например с металлами, восстанавливаются ионы водорода (например, HCl), и кислоты-окислители, у которых происходит восстановление кислотообразующего элемента (например, HNO3).
Кислоты имеют общие химические свойства:
Взаимодейcтвуют с металлами. Обычные кислоты (неокислители) взаимодействуют с металлами, стоящими в ряду напряжений левее водорода:
Fe + 2HCl = FeCl2 + H2 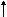
Zn + H2SO4(разб) = ZnSO4 + H2 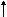
Кислоты окислители могут реагировать как с металлами, расположенными в ряду напряжений левее водорода, например:
Zn + HNO3(разб) = Zn(NO3)2 + H2O + N2 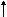
Так и правее его:
Ag + HNO3(конц) = AgNO3 + H2O + NO2 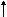
Вопрос 15. Основания: классификация, свойства на основе теории электролитической диссоциации, практическое применение.
Основания.
Гидроксидами металлов называются вещества, содержащие ион металла и одну или несколько гидроксильных групп. Гидроксиды делятся на основные (основания) и амфотерные. Основные гидроксиды, в свою очередь, делятся на сильные основания – щелочи, и слабые основания. В состав щелочей входят катионы щелочных и щелочноземельных металлов, например КОН, NaOH, Ca(OH)2, Ba(OH)2. Слабыми основаниями являются гидроксиды переходных металлов в низших степенях окисления, например Fe(OH)2,Mn(OH)2, Cu(OH)2.Число гидроксильных групп в основании называется кислотностью основания. Амфотерные гидроксиды включают в свой состав катионы металлов III группы Периодической системы, катионы переходных металлов в промежуточных степенях окисления, например Al(OH)3, Cr(OH)3, Fe(OH)3. К амфотерным также относятся Be(OH)2, Zn(OH)2.
Основные гидроксиды реагируют с кислотами с образованием соли и воды, например:
Сu(OH)2 + H2SO4 = CuSO4 + 2H2O
Щелочи реагируют с кислотными и амфотерными оксидами:
Ca(OH)2 + CO2 = CaCO3 + H2O
2NaOH + Fe2O3 = 2NaFeO2 + H2O
Амфотерные гидроксиды реагируют и с кислотами (в этом случае они ведут себя как основания), и со щелочами (как кислоты), например:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Cлабые основания и амфотерные гидроксиды при нагревании разлагаются:
Cu(OH)2 = CuO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Для получения слабых оснований и амфотерных гидроксидов используют реакцию их вытеснения из солей щелочами:
CuCl2 + 3NaOH = Cu(OH)2 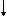 + 3NaCl
+ 3NaCl
Fe2(SO4)3 + 6KOH = Fe(OH)3 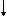 + 3K2SO4
+ 3K2SO4
Щелочи можно получить взаимодействием металла с водой:
2Na + 2H2O = 2NaOH + H2 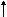
соответствующего оксида с водой:
СаО + Н2О = Са(ОН)2
или электролизом водного раствора соли соотвествующего металла:
2KCl + 2H2O = 2KOH + H2 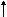 + Cl2
+ Cl2 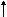
Вопрос 16. Соли: классификация, свойства на основе теории электролитической диссоциации, возможное их применение в вашей профессии.
Соли
Соли можно рассматривать как продукт взаимодействия основания и кислоты. При этом может происходить как полное, так и неполное замещение ионов водорода в кислоте катионами металла (или аммония) или гидроксильных групп в основании кислотными остатками.
Соли, не содержащие ионов водорода или гидроксильных групп, называются средними, например NaCl, CuSO4, Ca3(PO4)2.
Соли, содержащие ионы водорода – кислые, например: KH2PO4 – дигидрофосфат калия, NaHCO3 – гидрокарбонат натрия.
Соли, содержащие ионы гидроксила, называются основными: Mg(OH)Cl – гидроксихлорид магния, (CuOH)2CO3 – гидроксикарбонат меди (II).
Соли, содержащие два катиона, называются двойными: Fe(NH4)2(SO4)2  12H2O – двойной сульфат железа(II)-аммония (соль мора), KCr(SO4)2
12H2O – двойной сульфат железа(II)-аммония (соль мора), KCr(SO4)2  12H2O – двойной сульфат хрома (III) - калия (хромокалиевые квасцы).
12H2O – двойной сульфат хрома (III) - калия (хромокалиевые квасцы).
Соли, содержащие комплексные ионы, называются комплексными: K3[Fe(CN)6] - гексацианоферрат (III) калия (красная кровяная соль), [Co(NH3)6]Cl2 - хлорид гесаамминокобальта (II).
Солями называются электролиты, дающие при диссоциации в водном расторе катиона металла или аммония (и водорода в случае кислых солей) и анионы кислотного остатка (и гидроксила в случае основных солей). Ионы, входящие в состав соли могут быть комплексными.
Соли реагируют с металлами, эти реакции всегда окислительно-восстановительные:
Fe + CuSO4 = Cu + FeSO4
Cu + FeCl3 = CuCl + FeCl2
C неметаллами, это также окислительно-восстановительные реакции:
S + Na2SO3 = Na2S2O3 - при кипячении
С водой, образуя кристаллогидраты:
CuSO4 + 5Н2О = CuSO4  5H2O
5H2O
Na2SO4 + 10Н2О = Na2SO4  10H2O
10H2O
или необратимо гидролизуясь:
Al2S3 + 6Н2O = 2Al(OH)3 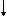 + 3H2S
+ 3H2S 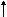
Соли реагируют со щелочами:
NH4Cl + NaOH = NH3 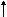 + NaCl + H2O
+ NaCl + H2O
CuCl 4 + NaOH = NaCl + Cu(OH)2 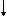
и кислотами:
K2CO3 + HCl = KCl + CO2 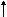 + H2O
+ H2O
NaNO3(тв) + H2SO4(конц) = NaHSO4 + HNO3 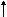 - при нагревании
- при нагревании
Ca3(PO4)2 + H3PO4 = 3CaHPO4
Соли реагируют с солями:
NaCl + AgNO3 = NaNO3 + AgCl 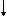
Соли кислородных кислот при нагревании разлагаются:
2KClO3 = 2KCl + 3O2 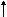
2NaNO3 = 2NaNO2 + O2