Механизмы инвазии, неоангиогенеза и метастазирования
Инвазия
Важным условием механизма инвазии является нарушение связей между отдельными опухолевыми клетками. В опухоли снижена экспрессия белков кадгеринов, связывающих клетки между собой, что облегчает отрыв отдельных клеток от общей клеточной массы.
Роль остеопонтина в инвазии. Опухолевая клетка способна к самостоятельному движению в направлении действия хемоаттрактантов, выделяющихся из окружающих тканей, а также вырабатываемых самой опухолью. Двигательная активность опухолевых клеток связана с наличием в них филаментов актомиозина и способностью образовывать псевдоподии. Диссеминация опухолевых клеток также опосредована лигандом – остеопонтином, который продуцируется макрофагами, моноцитами, Т-лимфоцитами и гладкомышечными клетками сосудистой стенки. Этот цитокин также имеет значение в неоваскуляризации и защите опухолевых клеток от апоптоза. Метастатический потенциал различных злокачественных опухолей связан с экспрессией остеопонтина. Остеопонтин индуцирует СD-44 – зависимый хемотаксис. Ткани, где секретируется остеопонтин (остеоциты, остеокласты костей), лимфатические узлы (Т-лифоциты), легкие (альвеолярные макрофаги) и печень (клетки Купфера) также могут способствовать «хоумингу» опухолевых клеток.
Роль интегринов. Взаимодействие опухолевой клетки с фибронектином, ламинином и витронектином экстрацеллюлярного матрикса с помощью интегриновопределяет инвазию в окружающие ткани. Затем происходит ферментативное разрушение экстрацеллюлярного матрикса коллагеназой, катепсином D и другими ферментами, которые вырабатываются как опухолевыми клетками, так и стимулированными макрофагами.
Эпителиально-мезенхимальная трансформация (ЭМТ). Опухолевые клетки могут приобретать особые свойства, необходимые для инвазии, в ходе процесса, называемого ЭМТ. Под ЭМТ понимают превращение неподвижных, плотно связанных между собой эпителиальных клеток в подвижные клетки мезенхимного типа (рис. 6). Важнейшим стимулом для ЭМТ является секреция клетками опухолевой стромы ряда факторов роста, включая ТФР-β, ЭФР, ТрФР и фактор роста гепатоцитов. Под влиянием этих факторов в эпителиальных клетках начинают экспрессироваться белки, свойственные клеткам мезенхимы, например, N-кадгерин. Клетки утрачивают полярность и большинство межклеточных контактов, а также приобретают подвижность, что создает предпосылки для инвазии и интравазации.
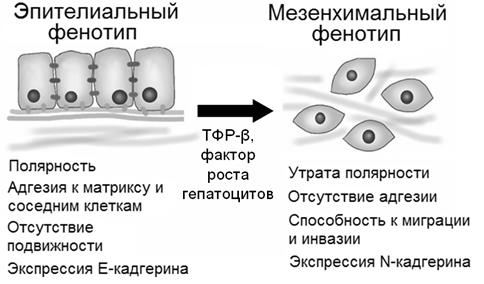
Рис. 6. Эпителиально-мезенхимальная трансформация - один из механизмов опухолевой инвазии.
Опухолевый ангиогенез
Опухоли достигают крупных размеров во многом благодаря кровоснабжению опухолевой ткани за счет развития сосудистой сети, которая возникает и увеличивается по мере роста самой опухоли. Опухоль прорастает сосудами под действием факторов, стимулирующих ангиогенез, которые вырабатываются как самой опухолью, так и макрофагами, богато представленными в зоне опухолевого роста (рис. 7). Наиболее активными в ангиогенезе считаются фактор роста фибробластов (из макрофагов), ТФРa, ТФРb, ЭФР, ФРТр. Эти факторы способствуют миграции и пролиферации эндотелиоцитов. В опухоли не происходит роста лимфатических сосудов, а кровеносные сосуды преимущественно относятся к сосудам капиллярного типа, поэтому при достижении опухолью крупных размеров происходит некроз ее центральных отделов из-за нехватки кислорода.
Известны следующие ангиогенные факторы, участвующие в опухолевом ангиогенезе:
· СЭФРсекретируются как при обычном ангиогенезе, так и при опухолевом, обеспечивая пролиферацию эндотелиоцитов, а также феномен «спрутинга». Повышенная экспрессия СЭФР является индикатором предраковых состояний (дисплазия слизистой желудка, атипичная аденома толстой кишки, карцинома молочной железы) in situ.
· Ангиопоэтины-1, -2, -3, -4обнаруживаются при ремоделировании сосудов и вовлечены в процесс ангиогенеза и опухолевой прогрессии.
· ФРФстимулируют пролиферацию эндотелия, продукцию коллагена и активатора плазминогена.
· ТрФРстимулирует рекрутинг перицитов, необходимых для роста капилляров опухоли. Аутокринная регуляция этого фактора роста наблюдается при лейкозах, глиомах и саркомах.
· ТФР-βимеет как проангиогенный, так и антиангиогенный характер действия. Высокие концентрации подавляют рост эндотелия, стимулируют дифференцировку гладкомышечных клеток и реформацию базальной мембраны.
· Ангиогенинучаствует в миграции эндотелия капилляров и запускает пролиферативные реакции раневого процесса.
Патофизиологическая характеристика сосудов опухолей
Опухолевые микрососуды атипичны. Они характеризуются трихотомическим делением, также прослеживаются дефекты базальной мембраны в виде увеличенных межэндотелиальных промежутков и фенестр и везикулярно-вакуолярных каналов. Также для опухолевого микроциркуляторного русла характерно отсутствие дифференцировки микрососудов на артериолы, капилляры и посткапиллярные венулы. Микрососуды опухоли образуют недифференцированную разветвленную сеть. Характерными особенностями микрососудов опухоли является также отсутствие иннервации и включение опухолевых клеток в структуру сосудистой стенки. Сопротивление опухолевых сосудов току крови повышено как за счет вязкости крови, так и изменений сосудистой стенки. В сочетании в повышенной проницаемостью опухолевых сосудов это приводит к повышению гидростатического и онкотического давления внутри сосудов и в интерстиции опухоли. Интерстициальная жидкость «вытекает» из области опухоли в здоровую ткань, тем самым способствуя распространению ангиогенных и лимфангиогенных факторов роста, а также метастазирующих клеток
Несмотря на интенсивный процесс ангиогенеза опухолевой ткани, существует несоответствие между пролиферативной активностью опухолевых клеток и развитием сосудистой сети. Это проявляется феноменом «острой гипоксии», приводящей к активации в опухолевой ткани транскрипционного фактора, индуцируемого гипоксией-1α (HIF-1α). В свою очередь, HIF-1α контролирует экспрессию множества генов, способствующих повышению устойчивости ткани к гипоксии. Среди них - ангиогенные факторы роста, в частности, СЭФР и рецептор к СЭФР.
Потенциальные возможности предупреждения опухолевого ангиогенеза. Размеры опухоли определяются интенсивностью ангиогенеза. Подавляя синтез и секрецию ангиогенных факторов, можно предотвращать опухолевый рост, инвазию и метастазирование.
Антиангиогенные препараты – еще один подход к терапии опухолей, так как опухолевые клетки регулируют процесс ангиогенеза эндотелиальных клеток.
Известны следующие антиангиогенные факторы:
· Ангиостатинвызывает апоптоз эндотелиальных клеток
· Эндостатинподавляет миграцию эндотелиоцитов и вызывает апоптоз
· Тромбоспондин-1,вазостатин, PF-4
· Остеопонтин –фосфорилированныйгликопротеин, который участвует в ангиогенезе, опухолевом росте. Его выработка связана с агрессивными формами рака молочной железы.
· Тканевые ингибиторы металлопротеиназучаствуют в подавлении метастазирования.
Метастазирование
Процесс метастазирования является причиной смерти у подавляющего большинства онкологических больных. Метастазирование опухоли, т.е. ее распространение и образование дочерних опухолей, происходит тремя путями:
· Лимфогенно (распространение клеток в лимфатические узлы по путям лимфооттока),
· Через интерстициальную жидкость (метастазирование в ближайшие органы),
· Гематогенно (метастазирование в отдаленные органы).
Локальная инвазия
Метастазирование опухоли неразрывно связано с механизмами инвазии, охарактеризованными выше, поскольку для попадания опухолевых клеток в лимфу, кровь или интерстициальное пространство они должны пройти через несколько барьеров, в частности, через экстрацеллюлярный матрикс. Для обеспечения локальной инвазии опухолевые клетки используют различные стратегии, включающие как индивидуальную, так и коллективную миграцию. Индивидуальная миграция предполагает амебоидный вариант движения опухолевых клеток. Коллективная миграция может происходить в виде кластеров (групп) клеток или многоклеточных тяжей. Итогом миграции и локальной инвазии является проникновение опухолевых клеток в просвет близлежащего сосуда. Ниже рассмотрены механизмы гематогенного метастазирования, при котором опухолевые клетки попадают в просвет кровенесных сосудов.
Интравазация
Процесс локальной инвазии завершается прикреплением опухолевой клетки к базальной мембране кровеносного сосуда. Деградация базальной мембраны осуществляется под действием секретируемых опухолевой клеткой матриксных металлопротеиназ и сериновых протеаз. Далее опухолевые клетки проникают в просвет сосуда, продвигаясь между соседними эндотелиоцитами. Показано, что в процессе интравазации большая роль принадлежит макрофагам, которые вступают во временный контакт с опухолевыми клетками и "направляют" их в просвет сосуда, что обозначают термином "ко-миграция". Попадание опухолевой клетки в просвет сосуда нередко инициирует немедленное тромбообразование с формированием вокруг клетки фибринового "чехла".Фиксированный на эндотелии фибриновый сгусток с опухолевой клеткой в центре может лизироваться с помощью выделяемого опухолевой клеткой активатора плазминогена, в результате чего опухолевая клетка высвобождается.
Циркуляция опухолевой клетки в крови
В процессе перемещения опухолевых клеток в кровотоке происходит повреждение большей их части иммунной системой организма. Жизнеспособность сохраняют только 0,1% клеток, попавших в сосудистое русло. Некоторые опухолевые клетки защищены от иммунного повреждения за счет образования вокруг себя агрегатов тромбоцитов и фибриновых сгустков вследствие активации системы гемостаза ферментами, выделяющимися из опухолевых клеток.
Экстравазация
На этом этапе действуют те же механизмы адгезии, что и при инвазии опухолевых клеток в окружающие ткани. Движение опухолевой клетки в ткани происходит при стимуляции хемоаттрактантами (например, остеопонтином).
В дальнейшем происходит взаимодействие опухолевой клетки с клетками микроокружения, ее пролиферация и образование дочерней опухоли (метастаза).
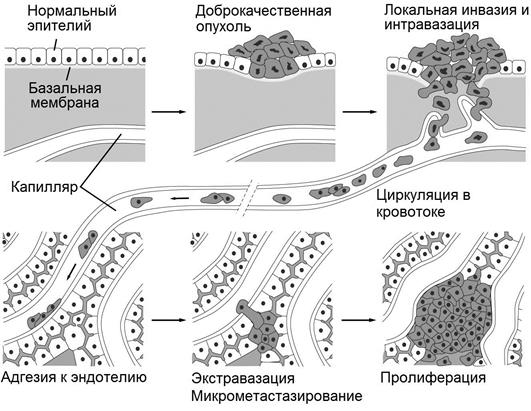
Рис. 7. Опухолевый ангиогенез и метастатический каскад.
Механизмы формирования органоспецифических метастазов
Клинические данные свидетельствуют о том, что злокачественные опухоли определенных локализаций преимущественно дают метастазы в определенные органы. Так, при раке предстательной железы часто формируются метастазы в костную ткань, при раке молочной железы – в легкое и в кость. Для объяснения этого феномена предложены две конкурирующие гипотезы:
1. Теория избирательного роста микрометастазов. Согласно этой гипотезе, экстравазация опухолевых клеток происходит в микрососудах всех органов с одинаковой вероятностью. Однако, для выживания опухолевых клеток и формирования метастазов определяющее значение имеют условия микроокружения, специфичные для разных тканей.
2. Теория избирательного выхода опухолевых клеток. Предположительно, в силу функциональной гетерогенности эндотелия в различных сосудистых регионах на его поверхности происходит экспрессия определенных лигандов, которые распознаются соответсвующими рецепторами на опухолевых клетках. Процесс лиганд-рецепторного взаимодействия, в основных чертах сходный с регуляцией эмиграции лейкоцитов при воспалении, обеспечивает адгезию и выход опухолевых клеток только в определенных тканях.
Опухоль и ИММУНИТЕТ
Опухолевые клетки имеют антигенные отличия, позволяющие иммунной системе осуществить функцию иммунологического надзора и уничтожить их.
