Изоструктурные синтоны обратной полярности
Как видно, синтонный подход позволяет планировать синтез на основе гете-ролитическях реакций как сборку целевой молекулы из готовых «кубиков», порядок сцепления которых определяется противоположностью их зарядов. Легко понять, что гибкость такой сборки значительно возрастает, если фрагмент данной структуры может быть представлен синтонами обоих знаков, подобно тому, как это имеет место, например, в уже рассмотренных несколько ранее вариантах синтонов для фрагмента СООН (-СООН » "CN и +СООН о СО2).
Другим примером пары реагентов, соответствующих изоструктурным синтонам противоположной полярности, являются аллилгалогенид и аллил-силан. Первый из них является электрофилом, эквивалентным синтону СН2=СНСН2+. Аллилсилан, напротив, служит ковалентным эквивалентом
нуклеофильного синтона СН2=СНСН2. Очевидно, что наличие двух таких доступных реагентов позволяет ввести аллильную группу как по нуклеофиль-ному,так и по электрофильным центрам, что дает возможность рассматривать соответствующие варианты ретросинтетического анализа как равноправные альтернативы.
Точно также для введения ароматического остатка синтетик может воспользоваться вариантом, предусматривающим использование как анионного синтона Аг~, так и карбокатионного Аг+. Как мы уже неоднократно отмечали, соответствующие углеводороды АгН или их металлоорганические производные (например, ArMgHal) являются удобными эквивалентами синтона Аг-. Второй вариант, предполагающий возможность переноса Аг+, может быть реализован с помощью арилгалогенидов, которые ведут себя как эффективные электрофилы в реакциях с купратными реагентами в качестве С-нуклеофилов.
Было бы преувеличением утверждать, что для всех важнейших типов вводимых фрагментов возможно подобное использование синтонов противоположной полярности. Тем не менее, целенаправленные исследования в этом направлении ведутся достаточно успешно, и далее мы покажем эффективность некоторых найденных на этом пути решений.
Значение синтона RCO+ не подлежит сомнению ввиду высокого синтетического потенцила вводимой с его помощью карбонильной функции; существует множество реагентов, эквивалентных этому синтону. Спрашивается: возможен ли синтон обратной полярности RCO"? Из всего опыта органической химии можно было с уверенностью утверждать, что подобные частицы не могут существовать как таковые из-за отсутствия элементов структуры, способных обеспечивать стабилизацию карбанионного центра. Следовательно, для того чтобы сконструировать реагент, отвечающий требуемому синтону, необходимо придумать структуру, в которой карбанионный центр был чем-то стабилизирован, и это «что-то» должно быть легко превращаемо в карбонильную группу. Благодаря подобной определенности в формулировке задачи дизайн реагентов требуемого типа оказался сравнительно несложным делом. Предложенное решение было основано на специфических особенностях свойств цитиоацеталей, легко доступных производных альдегидов [27е]. Принцип этого подхода показан в общем виде на схеме 2.101.
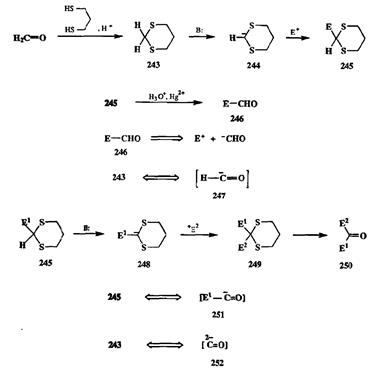 Схема 2.101 Схема 2.101 |
Родоначальником всей группы синтонов рассматриваемого типа служит 1,3-дитиан (243),легко получаемый из формальдегида. Обработка 243сильными основаниями приводит к получению карбаниона 244,стабилизированного за счет наличия при карбанионном центре двух атомов серы. Таким образом, трансформация формальдегида в 1,3-дитиан (243)привела к тому, что электрофильный атом углерода формальдегида был превращен в нуклео-фильный центр карбаниона 244.Как и можно было ожидать, 244охотно реагировал с самыми различными электрофилами, давая производные типа 245.Гидролизом последних можно было далее легко получать альдегиды типа 246.Нетрудно заметить, что образование последних в показанной последовательности превращений по своему конечному результату в точности соответствует парадоксальной сборке электрофил (Е+) + формил-анион (-СНО, 247).
Поскольку промежуточно образующийся продукт 245также содержит до -статочно кислый атом водорода, то возможно повторение цикла: генерация карбаниона 248,его реакция с другим электрофилом и гидролиз продукта алкилирования 249,что приведет к получению кетонов общего типа 250.В последнем случае 245выступает в роли ацил-анионного эквивалента (Е'СО-, 251),а суммарный итог превращения формальдегида в кетон 259соответствует последовательности сочетания двух электрофилов (+Е1 и +Е2) с дважды заряженным карбонил-анионом (2-СО, 252).Успешное применение дитиана как предшественника карбонил-анионных эквивалентов показанных типов вызвало всплеск исследований по разработке других реагентов этого же класса, которые содержат комбинации самых различных геминаль-ных заместителей, способных стабилизировать карбанионный центр, например MeSCH2S(O)Me, PhSeCH2SiMe3, R1OCH(R)CN и т. д. Некоторое представление о результативности этих работ можно получить, ознакомившись с обширной библиотекой синтонов, приведенной в монографии Хэйза [27f]: только для формила-аниона (247)в этой библиотеке перечислено более 30 различных реагентов. Реагенты, отвечающие одному и тому же синтону, могут в существенной степени отличаться по их реакционной способности с электрофилами различных типов, по доступности и легкости проведения реакций с их участием. Благодаря наличию столь разнообразного инструментария синтетическая операция общего вида: +Е' + 2-СО + +Е2, приобрела значение универсального метода стратегической значимости [27gJ.
Потенциал подхода, основанного на обращении полярности, был неоднократно показан на самых различных примерах [27g,h]. Хорошей иллюстрацией преимуществ его использования может служить синтез антибиотика вермикулина, выполненный Зеебахом с сотрудниками [27i]. Ключевой стадией этого синтеза явилось получение полифункционального соединения 253с помощью последовательности превращений, показанных на схеме 2.102.
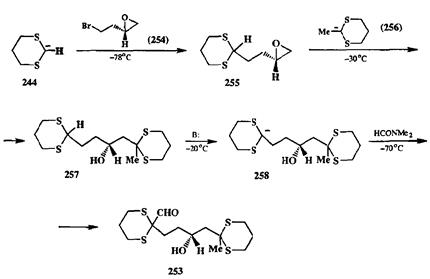 Схема 2.102 Схема 2.102 |
На первой стадии этой последовательности формил-анион эквивалент 244 вводится в реакцию с бромэпоксидом 254. Поскольку первичный бромид является более активным электрофилом, чем эпоксидный фрагмент, то результатом этой реакции при тщательном контроле условий ее проведения явилось селективное образование аддукта 255. В несколько более жестких условиях эпоксидный фрагмент этого продукта реагирует с ацетил-анионным эквивалентом 256 с образованием продукта 257. На следующей стадии этой последовательности из 257 генерировали карбанионный интермедиат 258, реакция которого с димегилформамидом и дала требуемый продукт 253. Примечательно, что все описанные синтетические операции проводились без выделе-ния промежуточных продуктов, в одном реакционном сосуде, приводили к целевому 253 с достаточно высоким общим выходом (более 50%).
Поучительно рассмотреть синтоны некоторых других типов, полезных для осуществления ряда иных превращений карбонильных производных. Привычным для химика-органика методом введения заместителя по сс-уг-лероду карбонильных соединений всегда являлась реакция электрофилов с енолятами — эквивлентами карбанионного синтона 259 (схема 2.103). Потребности синтеза заставили задуматься над проблемой, можно ли осуществить такое же по конечному результату превращение альтернативным путем, а именно сочетанием нуюгеофила с карбокатионным синтоном 260? Ясно, что пытаться решить эту проблему с помощью карбонилсоцержащих реагентов — дело заведомо безнадежное, так как карбонильная группа дестабилизирует положительный заряд на соседнем а-углеродном атоме. Тем не менее реагенты, эквивалентные синтону 260, удалось создать также на основе тиопроизводных с использованием на этот раз производных кислот, таких, как дитиокетенацетали 261 [27jj. Соединения этого типа легко третируют с карбанионными нуклеофилами с образованием стабилизированных дитиозамещенных карбанионных интсрмедиатов типа 262. Реакции последних с электрофилами мы уже обсуждали (см. схемы 2.101, 2.102); их результатом может быть образование соответствующих альдегидов 263 или кетонов 264.
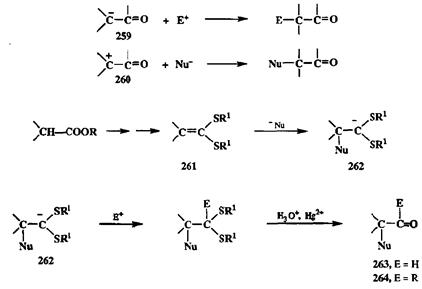 Схема 2.103 Схема 2.103 |
Легко видеть, что в синтезе альдегидов 263 реагент 261 используется в роли эквивалента а-формилкатионного синтона 260, в то время как при полу-гаении кетонов 264 этот же реагент является эквивалентом еще более странного биполярного синтона >СН+С- = О.
В синтонных терминах присоединение реактивов Гриньяра по карбонильной группе соответствует сочетанию синтонов R!R2C+(OH) и -R3. В принципе тот же результат может быть достигнут для пары синтонов с обращенной полярностью, а именно R'RС-OH) и +R3. В качестве эквивалента первого синтона необходимо, естественно, использовать производные с защищенной гидро-ксильной группой, однако литий или магнийорганические соединения такого типа трудно получать, и они, как правило, малостабильны. Интересное реше-;ння этой проблемы было предложено Кнохелем [27k], который показал, что цинк-медныс реагенты типа 265 свободны от указанных ограничений и вполне подходят для решения этой задачи. Эти реагенты легко получить из альдегидов с помощью последовательности реакций, показанных на схеме 2.104.
 Схема 2.104 Схема 2.104 |
Реагенты 265 служат эквивалентами синтона 266 в реакциях с сильными электрофилами типа алкилтрифлатов, давая соответствующие продукты типа 267. Интересной особенностью рассматриваемых реагентов является их полная инертность по отношению к таким электрофилам, как нитрильная или сложноэфирная функция. Это дает возможность использовать алкилтрифлаты, содержащие в своем составе функциональные заместители этих типов, в качестве электрофильных партнеров в реакциях с 265. Найдено также, что и альдегиды, используемые для получения последних, могут содержать эти функции.
В показанных примерах прослеживается одна из главных тенденций в разработке реагентов новых типов, основанная на дизайне синтонов снсобычной полярностью и/или содержащих «странные» сочетания функций, наличие которых несовместимо с химизмом того или другого из требуемых превращений, если оставаться в рамхах использования традиционных реагентов и реакций.
Итак, мы рассмотрели некоторые аспекты синтонного подхода на примере использования как классических, так и нетрадиционных реагентов. Читатель легко может заметить, что, хотя в разделе о построении связей С—С мы не пользовались термином «синтон», многие из рассмотренных там реакций легко описываются в терминах синтонного подхода, а используемые реагенты с полным основанием могут рассматриваться как эквиваленты соответствующих синтонов.
Естественно, что в рамках нашей книги мы не имели возможности сколько-нибудь полно рассмотреть набор синтонов даже основных типов. Уместно, однако, подчеркнуть, что библиотека синтонов различной структуры и полярности очень богата и продолжает пополняться [27f,m,n,]. При этом стимулом для такого расширения служит вовсе не желание заполнить пустые клетки в таблице мыслимых электрофильных и нуклеофильных синтонов различной структуры. Актуальность и перспективность таких работ более всего обусловлена тем, что решение задач современного уровня по синтезу сложных соединений требует разработки коротких синтетических схем, основанных на соединении крупных и, по возможности, стандартизованных блоков, а этого невозможно достичь без наличия широкого набора синтонов самой различной природы. В этом, собственно, и заключается идейная сущность синтонного подхода.
Синтонный подход предъявляет весьма жесткие требования к синтетическим методам и реагентам как в отношении их эффективности, так и в отношении их общности и надежности. Задаваемые им строгие критерии способствуют выявлению слабых мест существующих синтетических методов, тем самым стимулируя их совершенствование, а также требуют постоянного расширения ассортимента реагентов, вовлекаемых в обиход органической химии. Ввести в современную синтетическую практику реагент, способный служить эквивалентом нового синтона, — это значит выдержать весьма строгий экзамен на качество выполненного исследования.
И последнее замечание: до сих пор мы ограничивались рассмотрением лишь заряженных синтонов, соответствующих электрофильным или нукле-офильным партнерам в гегеролитических реакциях образования связей С—С. Из этого, однако, совсем не следует, что синтонный подход применим лишь при рассмотрении реакций этого типа в ретросинтетическом анализе. Отнюдь нет. Идеология синтонного подхода вполне универсальна, и в се плодотворности мы сможем убедиться далее при рассмотрении синтетического потенциала реакций самых различных типов.
