Стислі теоретичні відомості
Термодинамічні характеристики будь-якого фазового переходу в однокомпонентних системах пов’язані рівнянням Клапейрона-Клаузіуса:
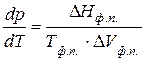 ,
,
де 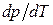 характеризує температурну залежність тиску насиченої пари або залежність температури фазового переходу від зовнішнього тиску;
характеризує температурну залежність тиску насиченої пари або залежність температури фазового переходу від зовнішнього тиску; 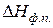 ,
, 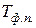 - молярна теплота та температура фазового переходу;
- молярна теплота та температура фазового переходу; 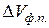 - зміна молярного об’єму речовини внаслідок фазового перетворення.
- зміна молярного об’єму речовини внаслідок фазового перетворення.
Для процесу випаровування з урахуванням деяких припущень це рівняння набуває вигляду
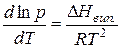 ,
,
або за умови 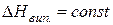
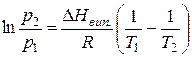 .
.
Воно виражає залежність тиску насиченої пари рідини від температури або залежність температури кипіння рідини від зовнішнього тиску.
Діаграму стану двокомпонентної системи, в якій в рівновазі перебувають рідина, що кипить, та її насичена пара, зображують у координатах “температура кипіння – склад”. За нижньою кривою визначають склад рідини, яка кипить при заданій температурі, за верхньою – склад рівноважної з нею пари.
Загальний тиск насиченої пари, що перебуває в рівновазі з розчином двох летких компонентів А та В, дорівнює сумі їх парціальних тисків:
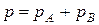 .
.
Для ідеальних розчинів згідно із законом Рауля парціальні тиски компонентів над розчином прямо пропорційні їх молярним часткам 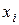 у розчині:
у розчині:
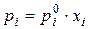 ,
,
де 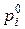 - тиск насиченої пари над чистим компонентом і.
- тиск насиченої пари над чистим компонентом і.
Молярну частку компоненту і в парі ( 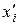 ) над ідеальним розчином розраховують за співвідношенням:
) над ідеальним розчином розраховують за співвідношенням:
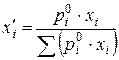 ,
,
а масовий вміст ( 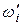 , %) – за формулою:
, %) – за формулою:
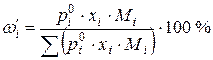 ,
,
де 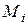 - молярна маса компоненту і.
- молярна маса компоненту і.
Якщо рідини не розчиняються одна в одній, то тиск насиченої пари кожної з них не залежить від складу рідкої системи і дорівнює тиску над чистим компонентом. В цьому випадку загальний тиск насиченої пари становить 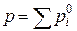 , а масовий вміст компоненту і в парі:
, а масовий вміст компоненту і в парі:
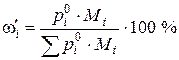 .
.
Тиск насиченої пари 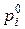 над індивідуальним компонентом і за будь-якої температури можна розрахувати за емпіричним рівняннями Антуана:
над індивідуальним компонентом і за будь-якої температури можна розрахувати за емпіричним рівняннями Антуана:
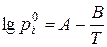 або
або 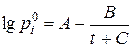 ,
,
де Т – абсолютна температура, К; t – температура в 0С; коефіцієнти А, В та С – константи, що наведені в дод. 3.
Рівновагу між твердою та рідкою фазами двокомпонентної системи зображують у вигляді діаграм плавлення, що характеризують залежність температур початку та кінця кристалізації від складу системи. Діаграми плавлення будують за допомогою кривих охолодження - залежностей температури системи від часу. За виглядом діаграми роблять висновки стосовно взаємної розчинності компонентів у рідкому та твердому станах, встановлюють наявність хімічної взаємодії між ними, склад та властивості хімічних сполук, що утворюються, визначають якісний та кількісний склад евтектик і подалі.
3.2. Завдання 3. Визначення фізико-хімічних властивостей одно-
Та двокомпонентних систем
Задача 1
Для наведеної у додатку 4 рідини визначити температуру кипіння при тиску “р”. Необхідні для розрахунку дані взяти з довідника [6].
Задача 2
За даними додатку 5 побудувати діаграму рівноваги між рідиною та парою у двокомпонентній системі. За діаграмою визначити:
1. температуру кипіння розчину, що містить зазначений у дод. 5 молярний відсоток компонента В;
2. склад рівноважної з цим розчином пари;
3. фракції, на які можна розділити цей розчин при ректифікації, та їх молярне співвідношення;
4. якими відхиленнями від закону Рауля характеризується дана система.
Задача 3
Для ідеального бінарного розчину (дод. 6), що містить 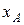 молярної частки рідини А, обчислити масовий вміст компонентів у насиченій парі при температурі Т. Тиск насиченої пари індивідуальних рідин визначити за рівнянням Антуана (дод. 3).
молярної частки рідини А, обчислити масовий вміст компонентів у насиченій парі при температурі Т. Тиск насиченої пари індивідуальних рідин визначити за рівнянням Антуана (дод. 3).
Задача 4
Для наведеної у додатку 7 системи, що утворена водою та нерозчинною у воді органічною рідиною,:
1. розрахувати за рівнянням Антуана (дод. 3) тиск насиченої пари органічної рідини при чотирьох – п’яти температурах;
2. побудувати залежності тиску насиченої пари над окремими компонентами (дані по температурній залежності тиску насиченої водяної пари наведені у дод. 8) та загального тиску в системі від температури;
3. визначити за графіком температуру кипіння системи за умови стандартного тиску;
4. розрахувати масовий вміст компонентів в конденсаті після перегонки системи за стандартного тиску.
Задача 5
На підставі даних про температури за шкалою Кельвіна початку (Тпоч.) та кінця (Ткін.) кристалізації у двокомпонентній системі (дод. 9):
1. побудувати діаграму плавлення системи А – В (склад системи наведений у молярних відсотках за виключенням варіантів 6, 12, 15 та 25, де склад виражений у масових відсотках);
2. описати діаграму: зазначити її тип, позначити на полях діаграми фази, евтектичні точки, визначити формули хімічних сполук, тощо);
3. накреслити криві охолодження для сумішей, що містять а, б, в, г % компоненту В (дод. 10).
ДОДАТКИ
Додаток 1
Рівняння хімічних реакцій
| Варіант | Реакція | Варіант | Реакція |
| 2H2 + CO = CH3OH(г.) 4HС1(г.) + O2 = 2H2O(г.) + 2С12 2СО + О2 = 2СО2 S2 (г.) + 2H2 = 2H2S(г.) C2H5Cl(г.) = C2H4 + HCl(г.) 2NO2 = 2NO + O2 N2O4 = 2NO2 CaCO3 = CaO + CO2 SO2 + 0,5O2 = SO3 CO + 3H2 = CH4 + H2O(г.) SO2 + Cl2 = SO2Cl2 (г.) СОС12 (г.) = СО + С12 СО2 + Н2 = СО + Н2О(г.) СО2 + 4Н2 = СН4 + 2Н2О(г.) СН4 + І2 (г.) = СН3І(г.) + НІ(г.) | 2СО + 2Н2 = СН4 + СО2 С2Н6 = С2Н4 + Н2 С6Н6 (г.) + 3Н2 = С6Н12 (г.) СО + 0,5О2 = СО2 РС13 (г.) + С12 = РС15 (г.) N2 + 3H2 = 2NH3 NO + 0,5O2 = NO2 2SO2 + O2 = 2SO3 Н2 + С2Н4 = С2Н6 СО + Н2О(г.) = НСООН(г.) 2СО + 2Н2 = СН3СООН(г.) С2Н4 + Н2О(г.) = С2Н5ОН(г.) СО + С12 = СОС12 (г.) С2Н6 + С12 = С2Н5С1(г.) + НСl(г.) CO + NH3 = HCN(г.) + H2O(г.) |
Додаток 2
Дані для розрахунку термодинамічних характеристик процесу нагрівання рідини
| Варіант | Рідина | р, атм | Варіант | Рідина | р, атм |
| Н2О | 0,80 | C6H6 | 0,70 | ||
| Н2О | 0,60 | C6H6 | 0,50 | ||
| Н2О | 0,40 | C7H8 | 0,75 |
Продовження додатку 2
| C7H8 | 0,55 | CH3СОCH3 | 0,35 | ||
| CH3OH | 0,85 | CH3СОCH3 | 0,50 | ||
| CH3OH | 0,45 | СCl4 | 0,60 | ||
| CH3OH | 0,30 | СCl4 | 0,40 | ||
| C2H5OH | 0,90 | СHCl3 | 0,95 | ||
| C2H5OH | 0,80 | СHCl3 | 0,80 | ||
| C2H5OH | 0,60 | С6H5Cl | 0,85 | ||
| НCООH | 0,85 | С6H5Cl | 0,60 | ||
| НCООH | 0,75 | С5H5N | 0,75 | ||
| НCООH | 0,55 | С5H5N | 0,50 | ||
| CH3СООH | 0,65 | SO2Cl2 | 0,45 | ||
| CH3СООH | 0,45 | SO2Cl2 | 0,35 |
Додаток 3
Коефіцієнти рівняння Антуана
| Формула | Назва сполуки | Інтервал T, оС | А | В | С |
| CCl4 | тетрахлорметан | -15 – 138 | 6,9339 | 1242,43 | |
| CHCl3 | трихлорметан | -15 – 135 | 6,90328 | ||
| C2HCl5 | пентахлоретан | 15 – 165 | 7,80304 | 2129,6 | |
| C2H2Cl4 | 1,1,2,2-тетрахлоретан | 20 – 146 | 8,06938 | 2167,83 | |
| C2H3Cl3 | 1,1,2-трихлоретан | 30 – 186 | 6,84165 | 1262,6 | |
| C4H9Br | 2-бромбутан | 10 – 146 | 6,82724 | 1229,08 | |
| C5H12 | н-пентан | -30 – 120 | 6,87372 | 1075,82 | 233,36 |
| C5H12 | і-пентан | -30 – 100 | 6,78967 | 1020,01 | 233,1 |
| C6H5F | фторбензол | 0 – 145 | 7,04659 | 1283,5 |
Продовження додатку 3
| C6H5Cl | хлорбензол | 0 – 40 40 – 200 | 7,49823 6,94504 | 1413,12 | 232,3 |
| C6H5Br | бромбензол | 0 - 60 60 – 190 | 7,35311 6,91444 | 1696,4 1474,06 | 199,4 |
| C6H6 | бензол | 5 – 160 | 6,9121 | 1214,64 | 221,2 |
| C6H7N | амінобензол | 90 – 250 | 7,24179 | 1675,3 | |
| C6H12 | циклогексан | -20 – 142 | 6,84498 | 1203,53 | 222,86 |
| C6H14 | н-гексан | -60 – 110 | 6,87776 | 1171,53 | 224,37 |
| C7H5F3 | трифтортолуол | 0 – 150 | 7,00708 | 1331,3 | 220,58 |
| C7H7Cl | о-хлортолуол | 65 – 220 | 6,94763 | 1497,2 | |
| C7H8 | толуол | 20 – 200 | 6,95334 | 1343,94 | 219,38 |
| C7H16 | н-гептан | -60 – 130 | 6,90027 | 1266,87 | 216,76 |
| C8H10 | етилбензол | 45 – 190 | 6,95719 | 1424,26 | 213,21 |
| C8H10 | о-ксилол | 25 – 50 50 – 200 | 7,35638 6,99891 | 1671,8 1474,68 | 213,69 |
| C8H10 | м-ксилол | 45 – 195 | 7,00908 | 1462,27 | 215,11 |
| C8H10 | п-ксилол | 25 – 45 45 – 190 | 7,32611 6,99052 | 1635,74 1453,43 | 231,4 215,31 |
| C8H14 | октин –1 | 25 – 170 | 7,02447 | 1413,8 | |
| C8H16 | октен – 1 | -50 – 151 | 6,93262 | 1353,49 | 212,76 |
| C8H18 | н-октан | 15 – 40 40 –155 | 7,47176 6,92377 | 1641,52 1355,23 | 234,5 209,52 |
| C8H18 | тетраметилбутан | -20 – 101 | 7,92864 | 1709,43 | 233,63 |
| C9H12 | п-етилтолуол | 65 – 210 | 6,99801 | 1527,11 | 208,92 |
| C9H12 | пропілбензол | 65 – 205 | 6,95142 | 1491,3 | 207,14 |
| C10H16 | камфен | 60 – 160 | 7,2159 | 1702,88 | 233,58 |
| C10H22 | н-декан | 25 – 75 | 7,33883 | 1719,86 | 213,8 |
| SnCl4 | тетрахлорид стануму | 3 – 109 | 7,5968 | 1824,9 | - |
Додаток 4
Дані для розрахунку температури кипіння рідини
| Варіант | Рідина | Формула | р×10-5, Па |
| амінобензол | C6H7N | 0,1013 | |
| бензол | C6H6 | 0,5065 | |
| гексан | C6H14 | 0,3039 | |
| гептан | C7Н16 | 4,0520 | |
| трихлорметан | CHСl3 | 0,1013 | |
| дихлорметан | CH2Cl2 | 1,5195 | |
| метанол | CH4O | 2,0260 | |
| мурашина кислота | HCOOH | 0,5065 | |
| тетрахлорметан | CCl4 | 0,7091 | |
| метилбензол | C7H8 | 0,4052 | |
| азотна кислота | HNO3 | 1,4182 | |
| сірковуглець | CS2 | 3,0390 | |
| етанол | C2H6O | 2,0260 | |
| циклогексан | C6H12 | 6,0780 | |
| н-пропанол | C3H8О | 5,0650 | |
| бутанол | C4H10О | 0,8104 | |
| етиленгліколь | C2H6О2 | 0,1013 | |
| оцтова кислота | C2H4О2 | 0,7091 | |
| диметилкетон | C3H6О | 0,3039 | |
| хлорбензол | C6H5Cl | 0,2026 | |
| пірідин | C5H5N | 0,5065 | |
| вода | H2О | 1,3169 | |
| диетиловий етер | C4H10О | 3,0390 |
Продовження додатку 4
| етилбензол | C8H10 | 2,0260 | |
| нафталін | C10H8 | 0,2026 | |
| трихлорид фосфору | PCl3 | 1,9210 | |
| сульфурил хлорид | SO2Cl2 | 2,5325 | |
| тетрахлорид силіцію | SiCl4 | 4,0520 | |
| амоніак | NH3 | 10,1300 | |
| дифеніл | C12Н10 | 0,6078 |
Додаток 5
Склад рівноважних рідкої (х) та газоподібної (у) фаз бінарної системи А – В за умови сталого тиску
| Варіант | Система | Т, К | Вміст В, % мол. | Т, К | Вміст В, % мол. | В,% | ||
| х | у | х | у | |||||
| А – Н2О В – НNО3 р = 1,013×105 Па | ||||||||
| А – С2Н4О2 В – НNО3 р = 1,013×105 Па |
Продовження додатку 5
| А – Н2О В – НF р = 1,013×105 Па | ||||||||
| А – С5Н4О2 В – Н2О р = 1,013×105 Па | 370,9 | 90,8 | 90,5 90,6 90,8 | |||||
| А – н-С4Н10О В – Н2О р = 1,013×105 Па | 365,7 | |||||||
| А – і-С4Н10О В – Н2О р = 1,013×105 Па | ||||||||
| А – С5Н12О В – Н2О р = 1,013×105 Па |
Продовження додатку 5
| А – С3Н6О В – СS2 р = 1,013×105 Па | 312,8 | |||||||
| А – CCl4 В – CH4O р = 1,013×105 Па | ||||||||
| А – С6Н6 В – CH4O р = 9,67×104 Па | ||||||||
| А – С6Н6 В – CH4O р = 1,013×105 Па | ||||||||
| А – С6Н6 В – С2Н6О р = 1,013×105 Па | 340,7 |
Продовження додатку 5
| А – CH4O В – С3Н6О р = 1,013×105 Па | 328,6 | |||||||
| А – СН3С1 В – С3Н6О р = 9,76×104 Па | 335,4 | |||||||
| А – СН3С1 В – С3Н6О р = 1,013×105 Па | 336,8 336,4 | |||||||
| А – С2Н6О В – СС14 р = 0,99×105 Па | 336,6 | |||||||
| А – С6Н12О2 В – С4Н10О р = 6,7×103 Па | 323,7 |
Продовження додатку 5
| А – С6Н12О2 В – С4Н10О р = 0,2×105 Па | 353,5 349,4 | 353,3 | ||||||
| А – С6Н12О2 В – С4Н10О р = 1,013×105 Па | 390,5 | |||||||
| А – СН4О В – CНCl3 р = 0,9×105 Па | ||||||||
| А – Н2О В – С3Н8О р = 1,013.105 Па | 360,8 | |||||||
| А – СН4О В – С2Н2С12 р = 1,013.105 Па | 337,6 | 333,8 |
Продовження додатку 5
| А – С4Н10О В – С7Н8 р = 1,013×105 Па | 373,5 | |||||||
| А – СН4О В – С2Н2С12 р = 1,013×105 Па | ||||||||
| А – С4Н8О2 В – СС14 р = 0,91×105 Па | 344,6 | 346,4 | ||||||
| А –CS2 В – C3H6O р = 1,013×105 Па | 312,8 | |||||||
| А – C3H8O В – H2O р = 1,013×105 Па | 360,8 |
Продовження додатку 5
| А – CCl4 В – C2H6O р = 0,99×105 Па | 336,6 | |||||||
| А – C4H8O2 В – C2H6O р = 1,013×105 Па | ||||||||
| А – НNО3 В – С2Н4О2 р = 1,013×105 Па |
Додаток 6
Дані для визначення складу пари над ідеальним розчином двох рідин
| Варіант | Рідина А | Рідина В | 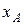 | T, K |
| метилбензол тетрахлоретан н-гептан метилбензол циклогексан | бензол тетрахлорид стануму н-октан бензол тетрахлорметан | 0,30 0,60 0,50 0,40 0,50 |
Продовження додатку 6
| бензол н-октан н-гексан хлорбензол трихлорметан о-ксилол бензол о-ксилол тетрахлорид стануму н-пентан тетрахлорметан бромбензол тетрахлорметан п-ксилол тетрахлорметан н-гептан н-декан метилбензол циклогексан хлорбензол бензол н-гексан н-пентан н-декан 1,1,2,2-тетрахлоретан | метилбензол н-гептан і-пентан бромбензол тетрахлорметан п-ксилол хлорбензол п-ксилол тетрахлорметан н-гексан циклогексан хлорбензол трихлорметан о-ксилол тетрахлорид стануму н-декан н-гептан бензол тетрахлорметан бензол бромбензол і-пентан і-пентан н-октан 1,1,2-трихлоретан | 0,30 0,30 0,70 0,50 0.20 0,40 0,80 0,25 0,65 0,55 0,30 0,40 0,25 0,25 0,40 0,55 0,85 0,45 0,25 0,40 0,90 0,60 0,75 0,35 0,70 |
Додаток 7
Дані для визначення температури кипіння системи, що складається з двох нерозчинних одна в одній рідин
| Варіант | Рідина | Формула | Варіант | Рідина | Формула |
| бромбензол | C6H5Br | трифтортолуол | C7H5F3 | ||
| амінобензол | C6H5NH2 | 1,1,2-трихлоретан | C2H3Cl3 | ||
| бензол | C6H6 | 1,1,2,2-тетрахлоретан | C2H2Cl4 | ||
| циклогексан | C6H12 | пентахлоретан | C2HCl5 | ||
| октан | C8H18 | октен-1 | C8H16 | ||
| гептан | C7H16 | октин-1 | C8H14 | ||
| 2-бромбутан | C4H9Br | о-ксилол | C8H10 | ||
| п-етилтолуол | C9H12 | фторбензол | C6H5F | ||
| пропілбензол | C9H12 | п-ксилол | C8H10 | ||
| хлорбензол | C6H5Cl | камфен | C10H16 | ||
| тетраметилбутан | C8H18 | трихлорметан | CHCl3 | ||
| м-ксилол | C8H10 | тетрахлорметан | CCl4 | ||
| метилбензол | C7H8 | н-пентан | C5H12 | ||
| етилбензол | C8H10 | і-пентан | C5H12 | ||
| o-хлортолуол | C7H7Cl | н-гексан | C6H14 |
Додаток 8
Тиск насиченої водяної пари при різних температурах
| t, 0C | |||||||||
| p, мм рт. ст. | 9,20 | 12,8 | 17,5 | 23,8 | 31,8 | 42,2 | 55,3 | 92,5 | 118,1 |
| t, 0C | |||||||||
| p, мм рт. ст. | 149,4 | 187,6 | 233,7 | 289,1 | 355,2 | 433,6 | 525,9 | 634,0 | 760,0 |
Додаток 9
Температури початку та кінця кристалізації двокомпонентних систем
| Варіант | Система | В, % | Тпоч | Ткін | В, % | Тпоч | Ткін | В, % | Тпоч | Ткін |
| А – КС1 B – LiCl | ||||||||||
| А – AgCl B – NaCl | ||||||||||
| А – AgCl B – КCl | ||||||||||
| А – Li2CO3 B – K2CO3 | ||||||||||
| А – RbCl B – SrCl2 | ||||||||||
| А – KCl B – CaCl2 | ||||||||||
| А – Au B – Pt |
Продовження додатку 9
| А – CdCl2 B – TlCl | ||||||||||
| А – Co B – Cr | ||||||||||
| А – Mg B – Zn | ||||||||||
| А – H2SO4 B – H2O | ||||||||||
| А – Cu B – Au | ||||||||||
| А – InCl3 B – NaCl |
Продовження додатку 9
| А – FeCl3 B – TlCl | ||||||||||
| А – Bi B – Sb | ||||||||||
| А – LiNO3 B – RbNO3 | ||||||||||
| А – MgCl2 B – TlCl | ||||||||||
| А – MgCl2 B – RbCl | ||||||||||
| А – MgSO4 B – K2SO4 |
Продовження додатку 9
| А – PbCl2 B – TlCl | ||||||||||
| А – Cs2SO4 B – Li2SO4 | ||||||||||
| А – Ni B – Cu | ||||||||||
| А – KI B – CdI2 | ||||||||||
| А – MnSiO3 B – CaSO3 | ||||||||||
| А – HNO3 B – H2O | ||||||||||
| А – MnCl2 B – KCl |
Продовження додатку 9
| А – CsCl B – CuCl | ||||||||||
| А – SrCl2 B – CsCl | ||||||||||
| А – TlCl B – PbCl2 | ||||||||||
| А – ZnCl2 B – NaCl |
Додаток 10
Дані для побудови кривих охолодження
| Варіант | а | б | в | г | Варіант | а | б | в | г |
Продовження додатку 10
Список рекомендованої літератури
1. Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высш.шк., 1988, 2001. – 496 с.
2. Киреев В.А. Курс физической химии. - М.: Химия, 1975. - 776 с.
3. Физическая химия / Под ред. К.С. Краснова. - М.: Высш. шк., 1982.- 688 с.
4. Физическая химия / Под ред. Б.П. Никольского. - Л: Химия, 1987. - 880 с.
5. Голиков Г.А. Руководство по физической химии. - М.: Высш. шк., 1988. – 384 с.
6. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. - Л.: Химия, 1983, 1999. – 232 с.
Зміст
Вступ3
1. ХІМІЧНА ТЕРМОДИНАМІКА 4
1.1. Стислі теоретичні відомості 4
1.2. Завдання 1. Розрахунок термодинамічних характеристик
хімічних та фізичних процесів 8
2. ХІМІЧНА РІВНОВАГА 9
2.1. Стислі теоретичні відомості 9
2.2. Завдання 2. Розрахунок констант рівноваги хімічних реакцій 11
3. ФАЗОВІ РІВНОВАГИ12
3.1. Стислі теоретичні відомості 12
3.2. Завдання 3. Визначення фізико-хімічних властивостей одно-
та двокомпонентних систем 15
ДОДАТКИ17
Додаток 1. Рівняння хімічних реакцій 17
Додаток 2. Дані для розрахунку термодинамічних характеристик
процесу нагрівання рідини 17
Додаток 3. Коефіцієнти рівняння Антуана 18
Додаток 4. Дані для розрахунку температури кипіння рідини 20
Додаток 5. Склад рівноважних рідкої (x) та газоподібної (у) фаз
бінарної системи А – В за умови сталого тиску 21
Додаток 6. Дані для визначення складу пари над ідеальним
розчином двох рідин 27
Додаток 7. Дані для визначення температури кипіння системи, що
складається з двох нерозчинних одна в одній рідин 29
Додаток 8. Тиск насиченої водяної пари при різних температурах 29
Додаток 9. Температури початку та кінця кристалізації двоком-
понентних систем 30
Додаток 10. Дані для побудови кривих охолодження 34
Список рекомендованої літератури 35
