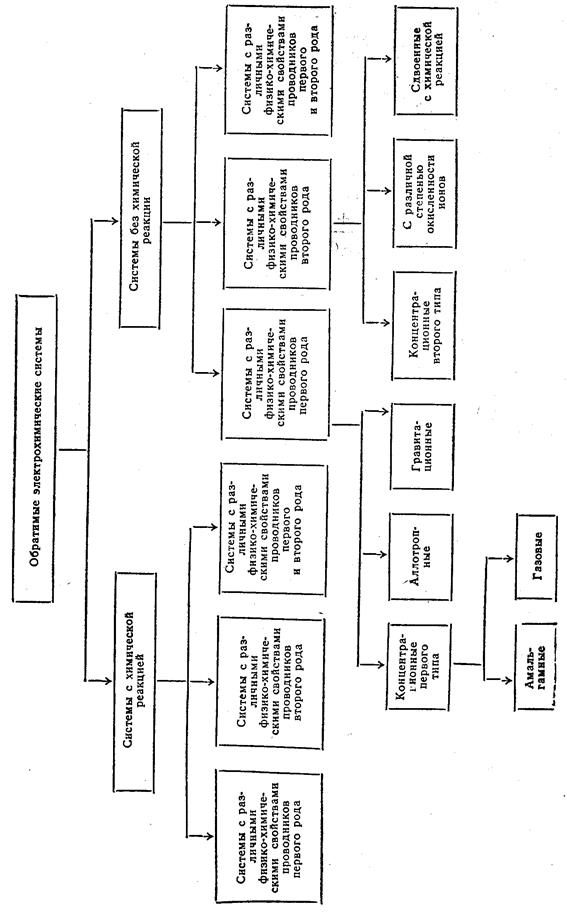
Классификация термодинамически обратимых электрохимических систем
Все обратимые электрохимические системы можно разделить на два больших класса (см. схему). К одному -классу относятся системы, в которых при замыкании внешней цепи начинают протекать разные восстановительная и окислительная электрохимические реакции. В результате их суммирования выявляется химическая реакция, идущая в системе. Такого типа системы называются электрохимическими системами с химической реакцией. Другому классу принадлежат системы, в которых окислительная электрохимическая реакция, протекающая при замыкании внешней цепи, — суть противоположно направленная восстановительная реакция. В таких системах химическая реакция отсутствует, и они называются электрохимическими системами без химических реакций.
В свою очередь, системы с химической реакцией могут быть разделены на три подкласса. В системах первого подкласса различные электрохимические реакции на электродах протекают только в результате различий в физико-химических свойствах проводников первого рода (простые системы), в системах второго подкласса — только благодаря различию в свойствах проводников второго рода, в системах третьего подкласса — из-за различий свойств проводников как первого, так и второго рода.
Электрохимические системы второго и третьего подклассов называются сложными электрохимическими системами с химической реакцией. В таких системах неизбежна граница раздела между проводниками второго рода.
Примером простой электрохимической системы с химической 'реакцией может служить рассмотренная выше система
(–) Cu | CuCl2 (aq) || CuCl2 (aq), AgCl (тв.) | Ag (+)
C1 C1
Классификация обратимых электрохимических систем
или
(–) Cd | CdCl2 | Cl2 (Pt) (+)
в которой правым электродом является насыщенная газообразным хлором (под определенным давлением) индифферентная платиновая пластина, не вступающая сама в электрохимическую реакцию, а электролитом — расплавленный хлорид кадмия либо раствор хлорида кадмия в воде или неводном растворителе. При замыкании внешней цепи в системе протекают реакции:
(–) Cd – 2е = Cd2+
(+) Cl2 + 2e = 2Cl–
__________________________
Cd+ C12 = Cd2+ + 2Cl– (CdCl2)
Отличительной особенностью простых электрохимических систем с химической реакцией является наличие только одного проводника второго рода и участие в электродных реакциях ионов разного знака. Так, если в восстановительной реакции участвуют катионы, то в окислительной будут участвовать анионы, и наоборот.
В сложных электрохимических системах, когда различаются только физико-химические свойства проводников второго рода, например, типа
(–)Ag | AgCl (тв.), НС1 || AgNO3 | Ag(+)
при замыкании внешней цепи будут протекать реакции:
(–) Ag + Cl– – e = AgCl (тв.)
(+) Ag+ + e = Ag
__________________________
Ag+ + Cl = AgCl (тв.)
Таким образом, в этой системе химическая реакция — суть реакция образования труднорастворимого соединения из ионов. Поскольку при работе системы ионы NO3– двигаются справа налево, замещая собою ионы С1– в соляной кислоте, то написанная выше химическая реакция эквивалентна реакции:
AgNO3 + HCl = AgCl (тв.) + HNO3
В сложных системах третьего подкласса с двумя разными проводниками второго рода и различными металлами типа
(–) Cd | CdSO4 (aq) || CuSO4 (aq) | Cu(+)
при замыкании внешней цепи начинают идти реакции
(–) Cd – 2e = Cd2+
(+) Cu2+ +2e = Cu
______________________
Cd + Cu2+ = Cd2+ + Cu
в результате которых концентрация сульфата кадмия увеличивается из-за перехода металлического кадмия в ионное состояние, а концентрация сульфата меди уменьшается благодаря переходу Сu2+ в металлическое состояние,
При перемене направления тока реакции в этой системе потекут в противоположном направлении.
Электрохимические системы без химических реакций можно также разделить на те же три подкласса (см. схему). Системы первого подкласса, в свою очередь, подразделяются на концентрационные (первого типа), аллотропные и гравитационные. Концентрационными системами первого типа являются амальгамные
(–) (Hg) Na | NaOH | Na (Hg) (+) С1 > С2
С1 С 2
и газовые
(–) (Pt) H2 | НСl | H2 (Pt) ( + ) Р1 > P2
| или |
P1 P2
(–) (Рt) С12 | НСl | Cl2 (Pt) (+) P1 < P2
Здесь С — концентрация; Р — давление.
В этих системах при замыкании внешних цепей идут реакции:
(–) (Hg) Na – e = Na+ + Hg
C1
(+) Hg + Na+ + e = Na (Hg)
С2
(–) (Pt) H2 + 2H2O – 2e = 2H3O+
(+) 2H3O+ + 2e= H2 (Pt) + 2H2O
(–) 2Cl– – 2e = Cl2 (Pt)
(+) (Pt) Cl2 + 2e = 2Cl–
Суммарным эффектом работы этих систем будет выравнивание концентраций металлического натрия в амальгамах, давления водорода и хлора в газовых фазах, контактирующих с платиной.
Работа аллотропных электрохимических систем основана на различиях в значениях энергий Гиббса разных аллотропных форм металла.
Одна из гравитационных электрохимических систем представлена на рис. 2.5.
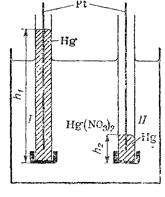
Рис. 2.5. Схема гравитационной электрохимической системы.
Две стеклянные трубки, затянутые с одного конца полупроницаемыми мембранами, пропускающими ионы ртути и не пропускающими металлическую ртуть, залиты последней, причем уровни ртути в обеих трубках h1и h2 различны. Трубки опущены в сосуд, в который налит водный раствор нитрата ртути. Если погрузить в трубки платиновые проволоки и замкнуть их через сопротивление, то в системе потекут реакции
Hg(I) – 2e = Hg2+
Hg2+ +2e = Hg(II)
_________________
Hg(I) = Hg(II)
т. е. ртуть из трубки, в которой уровень ее более высок, будет переходить в трубку с более низким уровнем.
В электрохимических системах без химической реакции с различными физико-химическими характеристиками проводников второго рода это различие может проистекать из-за разной концен- трации одного и того же электролита (концентрационные системы второго типа), например
(–) Cu | CuSO4 || CuSO4 | Cu (+) С1 < C2
(–) Ag | AgCl (тв.), HCl || НС1, AgCl (тв.) | Ag (+) C1 > C2
C1 C2
или из-за различной степени окисленности катиона или аниона в одном и том же электролите (системы с различной степенью окисленности) :
(–) Pt | FeSO4 || Fe2(SO4)3 | Pt (+)
В первом случае при замыкании внешней цепи начнутся реакции
(–) Cu – 2е = Сu2+
(+) Сu2+ + 2е = Сu
и
(–) Ag +Cl– – e = AgCl (тв.) (+) AgCl (тв.) + е = Ag + Сl–
т. е. будет происходить выравнивание концентраций сульфата меди и соляной кислоты в обоих растворах вследствие растворения металлов на левых электродах, осаждения их на правых электродах и переноса анионов справа налево через границу раздела.
В системе с разной степенью окисленности реакции будут выражаться уравнениями:
(–) Fe2+ – e = Fe3+
(+) Fe3+ +e = Fe2+
Через границу (например, анионообменную диафрагму) будут справа налево переходить анионы SO42–.В результате в левом растворе FeSO4 будет окисляться до Fe2(SO4)3, а в правом — Fe2(SO4)3 будет восстанавливаться до FeSO4, т. е. в обоих растворах концентрации исходных солей будут уменьшаться. И это будет происходить до тех пор, пока отношение концентраций Fе2(SO4)3 к FeSO4 в обоих растворах не станет равным. Это отношение будет таким же, каким оно получилось бы, если бы мы просто слили друг с другом оба раствора.
Электрохимическую систему без химической реакции можно получить, если соединить навстречу друг другу две простые электрохимические системы с химической реакцией одного подкласса, но с различной концентрацией электролита (т. е. положительный полюс одной системы подключить к положительному полюсу другой системы или отрицательный полюс одной системы подключить к отрицательному же полюсу другой системы), например:
(–) (Pt) H2 | HCl, AgCl (тв.) | Ag – Ag | AgCl (тв.), НС1 | H2 (Pt) (+) С1 < C2
P1 C1 C2 P1
или
(–)Hg | Hg2SO4 (тв.), H2SO4 | H2(Pt)–(Pt)H2 | H2SO4, Hg2SO4 (тв.) | Hg(+)C1>C2
C1 P1 P1 C2
Такие системы по сути дела состоят из двух электрохимических систем. Поэтому, если для них сохранить название «электрохимическая система», то входящие в них две электрохимические системы с химической реакцией следует называть электрохимическими подсистемами. Термин подсистема будет применяться только для тех электрохимических систем, которые входят в качестве составных частей сложных электрохимических систем, рассматриваемых как единое целое.
При замыкании внешней цепи в первой из этих систем начнутся реакции
| (в левой подсистеме) |
Н2 + 2Н2О – 2е = 2Н3О+
2AgCl (тв.) + 2е =2Ag + 2Сl–
Н2 + 2AgCl (тв.) + 2Н2О = 2Ag + 2Н3О+ + 2С1–
| (в правой подсистеме) |
2Н3О+ + 2е = Н2 + 2Н2О
2Ag + 2Сl– – 2е = 2AgCl (тв.)
2Н3О+ + 2Ag + 2Сl– = 2AgCl (тв.) + Н2 + 2Н2О
во второй системе
| (в левой подсистеме) |
2Hg + SO42– – 2е = Hg2SQ4 (тв.)
2Н3O+ +2е = Н2 + 2Н2O
2Hg + 2Н3O+ + SO42– = Н2 + Hg2SO4 (тв.) + 2Н2О
Hg2SO4 (тв.) + 2е = 2Hg + SO42– (в правой подсистеме)
2H2O + H2 – 2e = 2H3O+
______________________________________________
2Н2O + Hg2SO4 (тв.) + Н2 = 2Hg + 2Н3О+ + SO42–
и суммарным эффектом будет выравнивание концентраций кислот в обеих подсистемах.
Рассмотренные электрохимические системы называются сдвоенными с химической реакцией или концентрационными системами без переноса. Последнее название обусловлено тем, что в них не происходит переноса вещества от одного крайнего электрода к другому, хотя и имеется перенос веществ внутри каждой подсистемы.
Наконец, существуют системы без химической реакции, в ко-торых различаются физико-химические характеристики как проводников первого, так и второго рода. Примером может служить сдвоенная система
(–) (Рt) Н2 | НС1, AgCl (тв.) | Ag – Ag | AgCl (тв.), НС1 | H2 (Pt) (+)
P1 C1 C2 P2
в которой различны не только концентрации соляной кислоты в обеих подсистемах, но и давление водорода в контакте с платиновыми электродами.
