Приготовление раствора исходного вещества
1. Вычислить навеску, необходимую для приготовления 100,0 мл 0,05 н раствора Na2C2O4. Молярная масса эквивалента оксалата натрия вычисляют с использованием полуреакции:
С2О4 2- - 2е = 2СО2
М(Na2C2O4) = 134,00/2 = 67,00 г/моль
m(Na2C2O4)= C(1/2 Na2C2O4)*1/2 M (Na2C2O4)*Vм.к (5.1)
m(Na2C2O4)= 0,05*67*0,1=0,335 г.
где:
Vм.к. – объем мерной колбы в литрах;
С(1/2Na2C2O4) – концентрация приготовляемого раствора;
М(Na2C2O4) – молярная масса эквивалента оксалата натрия.
2. На аналитических весах взять точную навеску около рассчитанного количества и перенести ее без потерь в мерную колбу на 100,0 мл одним из способов, описанных в методе нейтрализации, растворить в теплой дистиллированной воде, охладить до комнатной температуры, довести раствор до метки и тщательно перемешать, предварительно закрыв колбу пробкой.
3. Вычислить титр и нормальность приготовленного раствора оксалата натрия по формулам:
Т = m(Na2C2O4)/100 (г/мл)
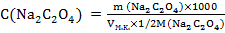 (5.2)
(5.2)
с точностью до четырех значащих цифр.
4. Для определения нормальности KMnO4 по оксалату натрия установить уровень жидкости на нуле по верхнему мениску.
5. В две конические колбы для титрования на 250 мл отмерить пипеткой на 15,00 или 20,00 мл аликвоту раствора оксалата натрия.
6. В эти же колбы прилить цилиндром по 15 мл 2н. раствора серной кислоты (нужно добавлять достаточное количество кислоты, так как она нейтрализуется в процессе титрования). В случае недостатка кислоты во время титрования образуется бурый осадок MnO2, что недопустимо!
7. Реакция между перманганатом и оксалатом идет очень медленно. Для ускорения ее непосредственно перед титрованием содержимое каждой колбы нагреть почти до кипения (до 70-800С), но не давать кипеть, чтобы не произошло разложения щавелевой кислоты.
8. Титровать горячий раствор оксалата натрия перманганатом калия медленно, обесцвечивая каждую каплю. Первые капли KMnO4 обесцвечиваются медленно, но как только образуется немного ионов Mn2+, являющихся катализатором данной реакции, дальнейшее обесцвечивание происходит практически мгновенно. Нужно уловить момент, когда одна лишняя капля перманганата окрасит раствор в бледно-розовый цвет, не исчезающий в течение 30 сек.
9. Записать полученный объем по бюретке (V1). Нагреть аликвоту оксалата во второй колбе и оттитровать таким же образом. Записать объем (V2) (разница между объемами не должна превышать 0,20 мл). Из двух отсчетов определить среднее арифметическое:
(V1 + V2)/2 = Vср. (5.3)
Вычислить нормальность перманганата калия по формуле:
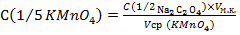 , моль/л (5.4)
, моль/л (5.4)
с точностью до четырех значащих цифр и показать результат преподавателю.
III. Определение каталазной активности почвы, подвергшейся нефтяному загрязнению по методу Джонсона и Темпле
Введение
Каталаза относится к классу оксидоредуктаз. Это двухкомпонентный фермент, состоящий из белка и простетической группы, содержащей железо, принадлежит к Fе - порфиринам. Каталаза содержится в живых клетках всех организмов, кроме облигатных анаэробов.
В процессе окисления ряда веществ в растениях под действием оксидаз образуется пероксид водорода, повышенные концентрации которого токсичны для организма. Под действием каталазы происходит обезвреживание пероксида водорода путем его разложения на воду и молекулярный кислород:
2Н2О2 → 2Н2О + О2.
Данный метод определения активности каталазы основан на определении количества пероксида водорода, разложившегося под действием фермента. Оставшийся, не разложенный пероксид водорода оттитровывают перманганатом в кислой среде.
Реакция идет по следующему уравнению:
2KMnO4 + 5H2O2 + H2SO4 = KHSO4 + 2MnO4 + 5O2 + 8H2O.
Порядок выполнения работы:
1. В коническую колбу емкостью 125 см3 помещают 2 г почвы, приливают 40 см3 дистиллированной воды и 5 см3 0,3%-й H2O2.
2. Колбу взбалтывают на ротаторе 20 мин.
3. Нерасщепленную часть перекиси стабилизируют добавлением 5 cm3 1,5 M серной кислоты.
4. Содержимое фильтруют через плотный фильтр.
5. Затем 25 cm3 фильтрата титруют 0,1 M KMnO4 до слабо-розовой окраски.
6. Точную начальную концентрацию использованной перекиси устанавливают титрованием перманганатом в кислой среде. Для этого 5 см3 0,3%-й перекиси смешивают с 40 см3 воды и 5 см3 1,5 M серной кислоты и 25 см3 этой смеси титруют 0,1 M марганцевокислым калием.
7. Из количества перманганата, израсходованного на титрование исходной перекиси водорода (А), вычитают количество перманганата, израсходованного для титрования аликвоты фильтрата (Б). Эта разница с учетом поправки к титру перманганата (T) отражает каталазную активность почвы, определяемую по формуле: (А- Б) ? Т.
Каталазную активность выражают в см3 0,1 M KMnO4 на 1 г почвы за 20 мин.
Контрольные вопросы:
1. Что такое каталаза?
2. Какое значение в жизни растении она имеет?
3. Какие методы защиты от антропогенного загрязнения существуют у растительных организмов?
ЛАБОРАТОРНАЯ РАБОТА 6.
