Глава 10. Химия радиоактивных элементов 2 страница
Полоний – серебристо – серый металл с желтоватым оттенком, напоминающий таллий и висмут, в темноте светится. Полоний легкоплавкий и легколетучий элемент с температурой плавления 2540С, кипения 9620С. На воздухе он быстро окисляется с образованием РоО2, взаимодействует с галогенами с образованием соединений типа РоГ4. Металлический полоний растворяется в азотной и соляной кислотах, при этом образуются соли РоCl4 и Po(NO3)4. Полоний дает изоморфные кристаллы с теллуратами свинца и калия.
В водных растворах полоний является сильнейшим коллоидообразователем, в области рН ≥ 1 все соли и комплексные соединения полония гидролизованы и образуют как истинные растворы, так и псевдоколлоиды. В области рН = 7.5 соли полония дают истинные коллоиды и хорошо адсорбируются на стекле и бумаге.
Для отделения полония от компонентов активного осадка радона и от больших количеств облученного висмута применяют электрохимические методы, экстракцию, хроматографию и соосаждение. В лабораторной практике отделение полония от висмута осуществляется соосаждением с элементарным теллуром при их совместном восстановлении, а также с помощью бестокового осаждения, используя более положительное значение потенциала выделения полония по сравнению со свинцом, висмутом и теллуром.
Процесс экстракции полония из расплавленного висмута при 400-5000С с гидроксидом натрия в инертной атмосфере является технологическим способом извлечения его из облученного висмута.
Людям далеким от радиохимии и ядерной физики покажется странным утверждение: сегодня полоний значительно более важный элемент, чем радий. Исторические заслуги радия бесспорны, но это прошлое. Полоний- элемент сегодняшнего и завтрашнего дня. Прежде всего, это относится к изотопу полония-210. Изотоп полоний-210 - чистый альфа-излучатель . Испускаемые им частицы тормозятся в металле и, пробегая в нем всего несколько микрон, растрачивают при этом свою энергию. Благодаря большому тепловыделению полоний в основном используют в качестве источника тепловой и электрической энергии в космических аппаратах. В принципе кроме полония-210 для работы на космических станциях в качестве источников энергии приемлемы плутоний-238, стронций-90, церий-144 и кюрий-244. Но у полония-210 есть важное преимущество перед остальными изотопами-конкурентами - самая высокая удельная мощность, 1210 вт/см3. Он выделяет так много тепловой энергии, что это тепло способно расплавить образец. Чтобы этого не случилось, полоний помещают в свинцовую матрицу. Образующийся сплав полония и свинца имеет температуру плавления около 600 °С - намного больше, чем у каждого из составляющих металлов. Мощность, правда, при этом уменьшается, но она остается достаточно большой - около 150 вт/см3.
Есть, правда, у полония-210 и ограничение. Относительно малый период его полураспада - всего 138 дней - ставит естественный предел срока службы радиоизотопных источников с полонием.
Полоний-210 находит также применение в качестве наиболее доступного б – источника. Такой диск из нержавеющей стали с нанесённым на него ничтожным количеством полония служит удобным источником б-частиц для научных исследований.

Рис. Источник б-частиц 
Кроме того, полоний находит применение для изготовления полоний – бериллиевых и полоний-борных источников нейтронов с малой гамма - активностью.
При работе с полонием необходимо соблюдать особую осторожность. Пожалуй, это один из самых опасных радиоактивных элементов. Максимально допустимым является содержание его в теле1.1·103 Бк, что эквивалентно 6.8·10-12г. Он легко проникает внутрь сквозь кожные покровы. Его активность так велика, что хотя он излучает только альфа-частицы, брать его руками нельзя, так как можно получить сильные ожоги кожи. Полоний опасен и на расстоянии, так как легко переходит в аэрозольную форму и заражает воздух. Поэтому работать с ним необходимо в камерах с отдельной фильтрационной системой. Соблюдая эти условия, легко защититься от альфа - излучения полония.
10.4 АСТАТ (85At)
Д. И. Менделеев оставил в таблице клетку для элемента с порядковым номером 85.
В 1940 г. Э. Сегре, К. Мак - Кензи и Д. Корсон на циклотроне Калифорнийского университета облучением мишени из висмута б – частицами получили искусственный элемент № 85:
| At Астат Astatine | [Xe] 6s2 4f14 5d10 6p |
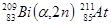
 или
или  Bi (a,3n)
Bi (a,3n)  At
At 
Позднее было доказано, что изотопы астата (215, 216, 218) образуются в семействах урана –235, 238, тория-232, но все они, являясь в- излучателями имеют очень короткие периоды полураспада.
Астат наименее распространенный элемент на нашей планете. В земной коре оценивается содержание астата в 69 мг в слое 1,6 км.
Астат – в переводе с греческого языка означает нестабильный.
Раньше его называли астатин, в настоящее время для стандартизации элемент называется астат.
Известно 24 изотопа астата с массовыми числами от 196 до 219. Наиболее важными из них являются долгоживущие изотопы -  с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества элемента. Как правило, исследования проводятся с концентрациями астата 10-11-10-15 моль/л при массовой удельной активности
с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества элемента. Как правило, исследования проводятся с концентрациями астата 10-11-10-15 моль/л при массовой удельной активности  7.4·1013 Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
7.4·1013 Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
Астат является наиболее тяжелым элементом группы галогенов. Свойства молекулярного астата напоминают свойства молекулярного йода, но как все тяжелые элементы обладает рядом металлических свойств. Нейтральный атом астата имеет электронную конфигурацию [Xe]4f145d106s26p5.
Степени окисления –1, +1, +3, +5 и, вероятно, +7. Наиболее устойчива из них -1. Подобно висмуту и полонию, астат может образовывать радиоколлоиды и сорбироваться на стекле и других материалах.
В соответствии с методами получения астата его приходится отделять от больших количеств облученного висмута, урана, тория, а также продуктов деления. В облученной альфа-частицами висмутовой мишени практически не содержатся радиоактивные примеси других элементов. Поэтому основная задача выделения астата сводится к сбросу макроколичеств висмута из расплавленной мишени путем дистилляции. Астат по аналогии с иодом возгоняется, на чем основано его отделение от мишени. Астат при этом либо адсорбируется из газовой фазы на платине или на серебре, либо конденсируется на стекле, либо поглощается растворами сульфита или щелочи.
Единственный метод определения астата является радиометрический. Изотопы 209, 210, 211At могут быть определены как по a- излучению, так и по g - или рентгеновскому К, L-излучению.
Элементарный астат хорошо растворим в органических растворителях, и с иодом в качестве носителя, легко ими экстрагируется. Коэффициент распределения у астата выше, чем у иода.
При действии сильных окислителей (HСlO4, K2S2O8, НIO  , и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO
, и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO  , который изоморфно соосаждается с AgIO3.
, который изоморфно соосаждается с AgIO3.
В виде иона астатида At- изоморфно соосаждается с AgI и TlI.
В организме астат ведет себя как йод (накапливается в щитовидной железе). На этом основано его использование в качестве радиофармацевтического препарата для лечения заболеваний щитовидной железы. Так как астат является альфа-излучателем, то его использование для этой цели предпочтительней, чем использование иода-131, который является источником жесткого бета-излучения. Выводится он из организма с помощью роданид-иона, дающего с астатом прочный комплекс.
10.5 РАДОН (86Rn)
| Rn Радон Radon | [Xe] 6s2 4f14 5d10 6p6 |
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-232 и урана-235 Р. Б. Оуэнс, У. Рамзай, Дж. Резерфорд и Ф. Дорн независимо друг от друга установили, что изотопы радия-226Ra , 224Ra ,223Ra в результате испускания a-частиц превращаются в изотопы элемента с порядковым номером 86-радон( 222Rn), торон ( 220Rn) , актинон(219Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222Rn с Т1/2=3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
В настоящее время известно 23 изотопа радона с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, протекающие при облучении ториевых мишеней протонами высоких энергий.
Определение молекулярной массы радона показало, что он является одноатомным газом.
Радон самый тяжелый элемент нулевой группы. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения -61,8 0С, затвердевающую при -71 0С. Твердый радон светится ярко-голубым цветом, который сравнивают с электрическим.
Исследования химических свойств радона показали, что радон и его изотопы являются химическими аналогами инертных газов. Его электронная конфигурация 5s2 5p65d 10 6s2 6p6, т.е. его внешние электронные уровни полностью заполнены, что и определяет инертность радона. В то же время, несмотря на то, что радон принадлежит к группе инертных газов, он образует вполне определенные группы соединений. Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон, подобно другим инертным газам, при действии сильных окислителей, например, жидкого фтора, фторидов, О2F2, при определенных условиях образует фториды-RnF2 , а также комплексные ионы типа RnF ×MeF6 , RnF2×2Sb F5 , RnF2×2Bi F5 и RnF2×I F5.
Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре.
Исторически первым и наиболее распространенным методом является радиометрический метод определения радона по радиоактивности продуктов его распада. 222Rn может быть определен и непосредственно по интенсивности собственного альфа- излучения. Удобным методом определения радона является его экстракция толуолом с последующим измерением активности толуольного раствора с помощью жидкостного сцинтилляционного счетчика.
Основная область применения радона - медицина. Радон применяютдля получения искусственных радоновых ванн при лечении ревматизма, радикулита, сердечнососудистых, кожных и ряда других заболеваний.
Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему. Опасен не сам радон, а продукты его распада. Все исследователи, работавшие с твердым радоном, подчеркивают непрозрачность этого вещества. Причина непрозрачности- моментальное осаждение твердых продуктов распада радона, которые являются б-, в-,г – излучателями. В то же время лечебный эффект радона обусловлен не самим радоном, а благодаря налету на теле продуктов его распада.
Применительно к радону эпитет «самый» можно повторять многократно: самый тяжелый, самый редкий, самый дорогой из всех известных газов на Земле.
10.6 ФРАНЦИЙ ( 87Fr)
| Fr Франций Francium | [Rn] 7s1 |
Среди элементов, стоящих в конце периодической системы Д. И. Менделеева, есть такие, о которых многое слышали и знают неспециалисты, но есть и такие, о которых мало, что сможет сказать и специалист. К числу первых относятся, например, радий и радон. К числу вторых - их сосед по периодической системе - франций. В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия.
Лишь в 1939 г. Маргарита Перей, ученица Марии Складовской-Кюри открыла элемент с порядковым номером 87, химически выделив его из продуктов распада ряда 235U. Он образуется при б- распаде  Ac. М. Перей назвала этот элемент в честь своей родины францием (Fr):
Ac. М. Перей назвала этот элемент в честь своей родины францием (Fr):

Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия. В природе франций в ничтожных количествах содержится во всех урановых рудах (1 атом Fr на 7,7×1014 атомов 235U или 3×1018 атомов природного урана).
В астоящее время известно 27 изотопов франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235U и 232Th. Из всех известных изотопов франция представляет интерес только 223Fr, как наиболее долгоживущий (период полураспада 22 мин.).
Кроме выделения из продуктов распада актиния, 223Fr получают путем облучения 226Ra нейтронами по схеме:
226Ra(n,g) 227Ra 
 Ac
Ac 
 Fr
Fr 
Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы. Нейтральный атом франция в основном состоянии имеет электронную конфигурацию[Rn]7s1. Единственной степенью окисления франция является +1.
Франций не может быть выделен в весомых количествах, так как периоды полураспада всех известных в настоящее время его изотопов слишком малы. У самого долгоживущего изотопа франция- 223Fr- период полураспада составляет всего 22 мин.
Согласно положению в периодической системе элементов, франций – один из самых электроположительных металлов. В химическом отношении франций - самый ближайший аналог цезия. Отсюда следует, что все характерные для цезия химические формы должны существовать и у франция. Большинство солей франция хорошо растворимо в воде. К трудно растворимым солям относятся перхлорат, хлороплатинат, пикратокобальтинитрит и некоторые другие соли, которые изоморфно соосаждаются с аналогичными солями цезия. Будучи самым активным щелочным металлом, франций проявляет пониженную способность к комплексообразованию и гидролизу.
Находясь в растворе в ультрамикроконцентрациях (10-9-10-13 г), франций может легко «потеряться», адсорбируясь на стенках сосудов, на поверхности осадков, на возможных примесях.
Поскольку франций не может быть получен в весомых количествах, его физико-химические характеристики найдены расчетным путем.
Химические свойства франция изучены только радиохимическими методами с использованием цезия в качестве специфического носителя. Массы франция в этих опытах не превышают 10-15г (массовая активность 223Fr составляет 1,7 ·1015Бк/мг). Достаточно сложной проблемой является отделение франция от специфического носителя цезия. В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал, чем цезий. Поэтому он может быть выделентолько на ртутном катоде.
Франций легко адсорбируется на ионообменных смолах КУ-1 и Дауэкс-50 (сульфокатионитах) из нейтральных или слабокислых растворов. С помощью этих смол франций легко отделяется от большинства химических элементов.
Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике сарком.
10.7 РАДИЙ (88Ra)
| Ra Радий Radium | [Rn] 7s2 |
Элемент № 88 был открыт Марией и Пьером Кюри в 1898 г вслед за полонием в минерале, известном под названием урановой смолки. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3O8, полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. Было обнаружено, что фракции содержащие сульфид висмута и сульфат бария, обладают радиоактивностью. Это подтверждало предположение, что новый элемент является аналогом бария. В дальнейшей работе с помощью дробной кристаллизации хлористого бария (более 10 000 ступеней), было выделено 90 мг хлорида радия высокой чистоты. Это позволило определить атомную массу радия и изучить его спектр. Новый химический элемент с порядковым номером 88 был назван супругами Кюри радием (radius-луч).
Таким образом, радий-226 является продуктом распада урана-238 В настоящее время известно 13 изотопов радия с массовыми числами от 213 до 230. Из них четыре встречаются в природе и являются членами естественных радиоактивных семейств. Наиболее долгоживущим и важным из природных изотопов радия является изотоп 226Ra с периодом полураспада1622 года. 226Ra является a - g- излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг радия. В верхнем слое Земной коры толщиной 1,6 км содержится 1,8×107 т 226Ra. Довольно много радия в некоторых природных водах – до 10-8г/л. В мировом океане содержится около 2·104 т радия.
Свежеполученный металлический радий - белый блестящий металл, темнеющий на воздухе с Ткип.=1140 С0и Тпл.=960 С0. Впервые металлический радий был получен М. Кюри и А. Дебьерном выделением на ртутном катоде при электролизе раствора RaCl2 с последующим разложением амальгамы радия в токе водорода при нагревании до 700 С0.
Радий типичный представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11 группы периодической системы. Нейтральный атом радия в основном состоянии имеет электронную конфигурацию [Rn]7s2. Единственной степенью окисления радия является +2. По своим химическим свойствам радий похож на барий, но химически более активен. Он энергично разлагает воду, давая гидроокись Ra(OH)2, более растворимую, чем Ва(ОН)2.
Ra +2Н2О= Ra(OH)2+ Н2 
Наиболее важными соединениями радия являются его галогениды: хлорид и бромид. Хорошо растворим в воде хлорид, бромид, иодид, нитрат и сульфид радия, плохо растворимы карбонат, сульфат, хромат, оксалат.
Все соли радия и бария изоморфны. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте. За счет самопоглощения б- и в-частиц, испускаемых при радиоактивном распаде 226Ra и его дочерних продуктов, каждый грамм 226Ra выделяет около 550 Дж (130 кал) теплоты в час, поэтому температура препаратов радия всегда немного выше окружающей.

Рис. Радий
Химия радия в водных растворах исследована с использованием микроколичеств этого элемента из-за его большой массовой радиоактивности (радиоактивность 1 г радия составляет 3,7×1010 Бк). Радий в растворах находится в виде ионов Ra2+.
В ряду щелочно-земельных металлов радий проявляет наименьшую склонность к комплексообразованию и гидролизу.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий образует комплексы с лимонной, молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2O3.
Радий сыграл огромную роль в исследовании строения атомного ядра, явления радиоактивности и становлении радиохимии и ядерной физики. Можно утверждать, что если бы 100 лет назад не был бы открыт элемент радий, то вряд ли прошлый век называли бы атомным. За открытие явления радиоактивности и радия Марии Склодовской - Кюри была дважды присуждена Нобелевская премия (первый раз по физике-1903 г., второй - по химии-1911 г.).
Основные области применения радия обусловлены его g - излучением (в методах неразрушающего контроля для определения дефектов литья, в толщиномерах, при разведке месторождений урана и т.д.).
Альфа- излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов.
В смеси с бериллием радий используют для изготовления нейтронных источников.
В медицине радий используют как источник радона.
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды. Из естественных радиоактивных изотопов наибольшее биологическое значение имеет долгоживущий 226Ra. Радий неравномерно распределен в различных участках биосферы. Накопление радия в органах и тканях растений подчиняется общим закономерностям поглощения минеральных веществ и зависит от вида растения и условий его произрастания. Как правило, в корнях и листьях травянистых растений радия больше, чем в стеблях и органах размножения; больше всего радия в коре и древесине. Среднее содержание радия в цветковых растениях 0,3-9,0·10-11 кюри/кг, в морских водорослях 0,2-3,2·10-11 кюри/кг.
В организм животных и человека поступает с пищей, в которой он постоянно присутствует (в пшенице 20-26·10-15 г/г, в картофеле 67-125·10-15г/г, в мясе 8·10-15 г/г), а также с питьевой водой. Суточное поступление в организм человека 226Ra с пищей и водой составляет 2,3·10-12 кюри, а потери с мочой и калом 0,8·10-13 и 2,2·10-12 кюри. Около 80% поступившего в организм радия (он близок по химические свойствам Са), накапливается в костной ткани. Содержание радия в организме человека зависит от района проживания и характера питания. Большие концентрации радий в организме вредно действуют на животных и человека, вызывая болезненные изменения в виде остеопороза, самопроизвольных переломов, опухолей. Содержание радия в почве свыше 1·10-7-10-8кюри/кг заметно угнетает рост и развитие
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
10.8 АКТИНОИДЫ (89Ас, 90Th, 91Pa, 92U, 93Np, 94Pu, 95Am, 96Cm, 97Bк, 98Cf, 99Es, 100Fm, 101Md, 102No, 103Lr)
ОБЩИЕ СВОЙСТВА АКТИНОИДОВ
Актиноидами называют группу элементов 7-го периода с порядковыми номерами от 89 (актиний) до 103 (лоуренсий), подобную группе лантаноидов. В группу актиноидов входят: торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий.
В таблице 9.1. представлены наиболее важные изотопы актиноидов:
Таблица 9.1. Наиболее важные изотопы актиноидов
| Изотоп | Период полураспада | Изотоп | Период полураспада | Изотоп | Период полураспада |
| 227Ac | 22 года | 244Pu | 7,6×107 лет | 251Cf | 660 лет |
| 232Th | 1.39×1010 лет | 241Am | 458 лет | 252Cf | 2.6 г |
| 231 Pa | 34300 лет | 241Am | 433 года | 253Es | 20,47 сут |
| 233 Pa | 27 сут | 243Am | 7600 лет | 254Es | 280 суток |
| 233U | 1.62×105 лет | 242Cm | 162,5 суток | 255Es | 39.3 сут |
| 235U | 7.13×108 лет | 244Cm | 19 лет | 257Fm | 94 cут |
| 238U | 4.5×109 лет | 247Cm | ³4×107 лет | 256Md | 75 мин |
| 235Np | 410 сут | 248Cm | 4,7×105 лет | 258Md | 56 сут |
| 237Np | 2.2×106 лет | 250Cm | 2×104 лет | 255No | 3.0 мин |
| 238Pu | 86,4 года | 247Bk | 1300 лет | 259No | 1.5 час |
| 239Pu | 24360 лет | 248Bk | 314 суток | 256Lr | 35 c |
| 242Pu | 3.79×105 лет | 24 9Cf | 352 г | 260Lr | 3 мин |
