Константы ионизации (рКа) наиболее распространенных кислот и оснований
| Кислоты | рКа | Основания | рКа |
| Соляная кислота | <0 | Гидроксид натрия | >14 |
| Фосфорная кислота (отрыв первого протона) | Этиламин | ||
| Уксусная кислота | Аммиак | ||
| Угольная кислота | Хинин, стрихнин | ||
| Фосфорная кислота (отрыв второго протона) | |||
| Синильная кислота, борная кислота | Анилин, пиридин | ||
| Фенол | |||
| Фосфорная кислота (отрыв третьего протона) | |||
| Глюкоза | п-Нитроанилин |
В настоящее время значения рКа установлены для многих соединений. Например, величина рКа около 5 (сравните с рКа уксусной кислоты) типична для большинства монокарбоновых кислот как алифатических, так и ароматических. Величина рКа 10 типична для фенолов. Кислоты, рКа которых выше 7, практически не изменяют цвета нейтральной индикаторной бумаги, а выше 10 – не имеют даже кислотного вкуса.
Для оснований характерны следующие закономерности. Величина рКа 11 (как, например, у этиламина) типична для алифатических, а значение рКа 5 – для ароматических, которые слабее алифатических. Величины рКа представляют собой десятичные логарифмы, следовательно, основность этиламина и анилина различается в миллион раз. Многие алкалоиды и другие биологически активные основания имеют значения рКа около 8. Основания, рКа которых ниже 7, практически не изменяют цвета нейтральной индикаторной бумаги.
Введение в молекулу электрондонорных групп (например, СН3) увеличивает ее основность и уменьшает кислотность, а электронакцепторных (например, NH2) – ослабляет основность и усиливает кислотность.
Степень ионизации любого вещества можно рассчитать при известных величинах рН раствора и рКа вещества с помощью выражений:
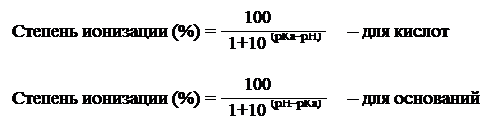 | (2.4) (2.5) |
Эти уравнения показывают, что степень ионизации данной кислоты (основания) зависит от рН. Эта зависимость не является линейной, а выражается сигмовидной кривой (рис. 2.1).
|
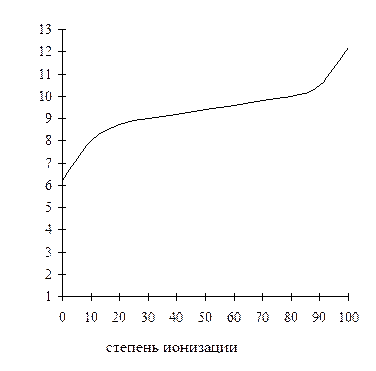
Рис. 2.1. Зависимость степени ионизации молекулы
ксенобиотика от рН
Анализ этой кривой показывает, что небольшое изменение рН в определенной области может вызывать сильные изменения ионизации, особенно если значение рН раствора близко к величине рКа исследуемого вещества.
Значение рН, при котором кислота или основание ионизированы наполовину, эквивалентно их рКа. Если рН на одну единицу ниже, чем рКа, то кислота ионизирована на 9 %, а основание – на 91 %.
Связана ли степень ионизации с биологическими эффектами, вызываемыми ксенобиотиками, т. е. с биологической активностью ксенобиотиков?
Действительно, оказалось, что в зависимости от степени ионизации ксенобиотики обладают различной биологической активностью и их можно разделить на три большие группы:
1. Ксенобиотики, обладающие большей биологической активностью в ионизированном состоянии.
2. Ксенобиотики, более активные в неионизированном состоянии.
3. Ксенобиотики, проявляющие биологическое действие в виде ионов и неионизированных молекул.
Проиллюстрируем это на примерах действия некоторых ксенобиотиков на живые организмы.
Ксенобиотики, обладающие большей биологической активностью в ионизированном состоянии. В тридцатых годах нашего столетия было обнаружено, что многие органические катионы обладают антибактериальной активностью. Известно, что алифатические амины, существующие при рН 7 главным образом в виде катионов, проявляют бактерицидное действие, в отличие от ароматических аминов, которые существуют при рН 7 в основном в виде неионизированных молекул и этим действием не обладают. Однако тогда не связывали антисептическое действие с наличием органических катионов. Предполагалось, что антибактериальная активность зависит от наличия гидроксильных ионов, способных при взаимодействии аминов с водой сдвигать рН раствора в щелочную область. Таким образом, наличие бактерицидного эффекта объяснялось щелочностью антисептических растворов. Однако не учитывалось обстоятельство, что те же основания, находящиеся в забуферном растворе, также обладают бактерицидными свойствами. Существенный вклад в решение этой проблемы был внесен в 30-х гг. CC в.: было высказано предположение о том, что антибактериальная активность трифенилметановых красителей объясняется взаимодействием катиона красителей с определенными анионными группами на поверхностях бактерий.
Хотя тогда не знали степени ионизации исследуемых красителей (по чисто техническим причинам), но заключение было сделано правильное: соли многих сильных оснований могут обладать антибактериальным действием, так как они способны образовывать достаточное количество катионов при физиологических значениях рН. Было также доказано, что при повышении рН среды антибактериальное действие усиливается за счет повышения степени ионизации (анионной) рецепторов бактерий. Однако это увеличение щелочности не следует доводить до начала подавления ионизации самого антисептика.
Первое строгое доказательство взаимосвязи между ионизацией и биологическим действием было получено в 40-х гг. при работе с аминоакридинами. Хотя уже ранее, в 1913 г., шотландский патолог Броунинг предложил использовать аминоакридины в качестве антибактериальных средств при ранениях. Выяснилось, что один из них (профлавин или 3,6-диаминоакридин) токсичен по отношению к широкому ряду грамположительных и грамотрицательных бактерий, но безвреден для ткани человека.
Так вот, исследования серии аминоакридинов, проведенные Альбертом с сотрудниками в 1941 г., показали, что существует количественная связь между их антибактериальным действием и степенью ионизации по катионному типу. Позднее эта корреляция была подтверждена и расширена на примере многих других соединений.
Ксенобиотики, более активные в неионизированном состоянии. Неионизированные вещества могут обладать очень сильным физиологическим действием (эфир, хлороформ и др.). В этом можно убедиться на примере ингибирования клеток яиц иглокожих салициловой кислотой (рис. 2.2).
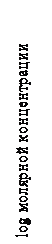  |
| Рис.2.2. Влияние рН на концентрацию салициловой кислоты (рКа=3,0), необходимую для подавления деления клеток яиц морского ежа |
В 1921 г. Вермст обнаружил, что многие слабые кислоты наиболее полно проявляют физиологическую активность при наименее ионизированных значениях рН.
Исследования проводились в интервале рН от 5 до 8. Степень (количество) ионизированных молекул растет в направлении увеличения рН. Оказалось, что кислота наиболее активна при рН 5. В этом случае количество неионизированной салициловой кислоты (рКа 3,0) составляет 0,99 %, что значительно больше, чем при остальных исследуемых значениях рН.
Самое простое объяснение заключается в том, что нейтральные молекулы, а не анионы салициловой кислоты ингибируют деление клеток. Можно было бы сдвинуть интервал исследуемых рН в более кислую область, т. е. в ту область, где будет присутствовать большее количество неионизированных молекул кислоты. Однако при снижении рН в такую кислую область возникает ряд затруднений: во-первых, организм может проявлять чувствительность к изменению рН среды; во-вторых, снижение рН может привести к изменению ионизации мест связывания и соответственно изменению сродства к агенту.
При изучении действия слабых кислот на биологические объекты доказано, что количество вещества, необходимое для достижения эффекта, остается постоянным независимо от рН среды при условии, что рН по меньшей мере на одну единицу ниже, чем рКа; в этом случае не происходит ионизации токсического агента. Этот вывод подтверждается данными, приведенными на рис. 2.3.
|
|
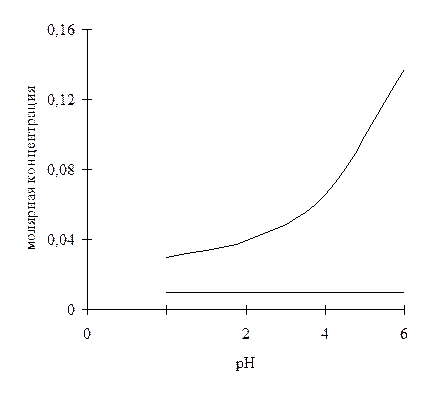
Рис.2.3. Влияние рН на концентрации фенола (рКа 9,9)
(1) и уксусной кислоты (рКа 4,8) (2), необходимые для
ингибирования роста плесневых грибов
В других опытах было также доказано, что эффективность слабых оснований возрастает с повышением рН, т. е. пропорционально снижению их ионизации. Аналогичным образом эффективность слабых кислот, как отмечалось, повышается при уменьшении рН, что также связано с уменьшением ионизации.
Но подобные эксперименты не дадут окончательного ответа, если не будет осуществлен контроль, позволяющий выяснить, не влияют ли изменения рН на подопытный организм.
В этой связи рассмотрим опыт по выявлению наркотизирующего действия разных веществ на червя Areniсola. Опыты с неэлектролитами (табл. 2.7), т. е. неионизирующими веществами, показали, что рН среды не влияет на тест-объект.
Таблица 2.7
