Практические задания по количественному анализу
2.2.1. Тема: Методы кислотно-основного титрования.
Цель: Овладеть навыками титриметрического анализа методами нейтрализации
В основе методов кислотно-основного титрования (нейтрализации) лежат реакции нейтрализации.
В зависимости от рабочего раствора различают два вида методов нейтрализации:
- Ацидиметрия - рабочим раствором является раствор сильной кислоты (НСI или H2S04). Определяют основания или соли образованные сильным основанием и слабой кислотой.
- Алкалиметрия - рабочим раствором является раствор щелочи (NaOH или КОН). Определяют кислоты или соли образованные сильной кислотой и слабым основанием.
1. Задание: Определение массовой доли соляной кислоты НСl в растворе.
Методика:Приготовить разведение 1:100.В коническую колбу поместить 1 мл разведения раствора соляной кислоты НСl , добавить 1-2 капли индикатора метилового оранжевого и титровать 0,1 М раствором гидроксида NаОН до изменения окраски от розовой до желтой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
HCI + NaOH=
2.Выполнить расчеты по результатам титрования:
СЭ(NаОН) · МЭ(НСI) где СЭ(NаОН) – молярная концентрация
T(НСI) = ---------------------------------- , эквивалента рабочего раствора
1000 NаОН (СЭ(NаОН) = 0,1 М);
МЭ(НСI) – молярная масса эквивалента кислоты хлористоводородной(г/моль) ;
Т(НСl) · Vср (NаОН) · К(NаОН) ·100% VК.
ω%(НСI) = ----------------------------------------------------------- · ------,
q(НСI) VП.
где ω%(НСI) – массовая доля кислоты хлористоводородной в растворе(%);
Т(НСl) – титр кислоты хлористоводородной (г/мл);
Vср(NаОН) – средний объём рабочего раствора натрия гидроксида, который был израсходован на титрование разведения раствора кислоты хлористоводородной (мл);
К(NаОН) – поправочный коэффициент к концентрации рабочего раствора натрия гидроксида, если не обозначен на этикетке рабочего раствора принимают за единицу, т.е. К = 1);
q(НСI) – навеска определяемого раствора, т.е. количество разведения кислоты хлористоводородной взятое на титрование (мл);
VК – объём колбы, т.е. объём мерной колбы в которой готовили разведение (мл);
VП. – объём пипетки (мл), количество раствора кислоты хлористоводородной взятое для приготовления разведения.
2. Задание: Определение массовой доли борной кислоты Н3ВО3 в растворе.
Методика:В коническую колбу поместить 1 мл раствора борной кислоты Н3ВО3, добавить пальчиковым мерным цилиндром 1 мл глицерина нейтрализованного по фенолфталеину и 1-2 капли индикатора фенолфталеина, титровать 0,1 М раствором гидроксида NаОН до изменения окраски от бесцветной до розовой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
Н3ВО3 + NaOH=
2. Выполнить расчеты по результатам титрования:
СЭ (NаОН) · МЭ(Н3ВО3)
T(Н3ВО3) = ---------------------------------- ,
Т(Н3ВО3) · Vср (NаОН) · К(NаОН) ·100%
ω%( Н3ВО3) = -------------------------------------------------------
q(Н3ВО3)
3. Задание: Определение массовой доли натрия гидрокарбоната NaHCO3 в растворе.
Методика:В колбу для титрования поместить 1 мл раствора натрия гидрокарбоната NaHCO3, добавить 1-2 капли индикатора метилового оранжевого и титровать 0,1 М раствором гидроксида НСI до изменения окраски от жёлтой до розовой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
NaHCO3 + НСI =
2. Выполнить расчеты по результатам титрования:
СЭ(1(НСI) · МЭ(NaHCO3)
T ( NaHCO3) = -----------------------------------,
Т(NaHCO3) · Vср (НСI) · К(НСI) ·100%
ω%( NaHCO3) = -------------------------------------------------- .
q(NaHCO3)
2.2.2. Тема: Методы окислительно-восстановительного титрования (редоксиметрия).
Цель: Овладеть навыками титриметрического анализа методами редоксиметрии
В основе методов окислительно-восстановительного титрования лежат окислительно-восстановительные реакции (реакции, идущие с изменением степеней окисления реагирующих веществ). При помощи титрованных растворов окислителей определяют количественно содержание восстановителей и наоборот.
Редоксиметрия подразделяется на ряд методов: перманганатометрию, йодометрию, хроматометрию, броматометрию и нитритометрию.
4. Задание: Определение массовой доли перекиси водорода Н2О2 в растворе.
Определение основано на окислении перекиси водорода перманганатом калия до молекулярного кислорода.
Методика:Приготовить разбавленный раствор перекиси водорода Н2О2 1:100. В колбу для титрования поместить 1 мл разведения перекиси водорода пипеткой и 1 мл 2 М раствора Н2SО4. Титровать 0,1 М раствором КMnО4 до слабо-розового окрашивания. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, проходящей при титровании, составить электронный баланс и уравнять:
Н2О2 + КMnО4 + Н2SО4 =
2.Выполнить расчеты по результатам титрования:
СЭ(КMnО4) · МЭ(Н2О2)
Т(Н2О2) = --------------------------------- ,
Т(Н2О2)· V(КMnО4) ·100% V к
ω%( Н2О2) = ------------------------------------- · ----- .
q(Н2О2) · V п
5. Задание: Определение массовой доли железа (II) в растворе сульфата железа(II)FeSО4.
Методика:В мерную колбу на 100 мл поместить 5 мл раствора сульфата железа неизвестной концентрации, добавить 1 мл разбавленной серной кислоты Н2SО4 и довести до метки водой. В колбу для титрования поместить 2 мл разведения и титровать 0,1 М раствором КМnО4 до слабо - розового окрашивания. Титровать до трех сходящихся результатов.
1.Дописать уравнение реакции, происходящее при титровании, составить электронный баланс и уравнять:
FeSО4 + КMnО4 + Н2SО4 =
2.Выполнить расчеты по результатам титрования:
СЭ(КMnО4) · МЭ(FeSО4)
Т(FeSО4) = --------------------------------------,
Т(FeSО4) · V(КMnО4) ·100% V к
ω%(FeSО4) = ------------------------------------- · -----.
q(FeSО4) V п
6. Задание: Определение массовой доли йода I2 в спиртовом растворе.
Метод йодометрии можно использовать для определения массовой доли йода в лекарственных препаратах: 2,5 %, 5 % и 10 % спиртовых растворах йода (вариант прямого титрования).
Методика определение йода:в колбу для титрования поместить 1 мл 5% спиртового раствора йода, 5 мл 10 % раствора калия иодида и 15 мл дистиллированной воды. Титровать 0,1 М раствором тиосульфата натрия без индикатора до соломенно-жёлтого цвета, затем добавить 1 мл 1% раствора крахмала и титровать до полного обесцвечивания раствора. Титровать до трёх сходящихся результатов.
1. Дописать уравнение реакции, происходящее при титровании, составить электронный баланс и уравнять:
Nа2S2О3 + I2 =
2. Выполнить расчеты по результатам титрования:определить титр йода и массовую долю йода в спиртовом растворе йода.
7.Задание: Определение массовой доли тиосульфата натрия Nа2S2О3 в растворе.
Метод йодометрии можно использовать для определения массовой доли тиосульфата натрия в растворе (вариант прямого титрования).
Методика:В колбу для титрования поместить 1 мл раствора тиосульфата натрия Nа2S2О3. Титровать 0,1 М раствором йода без индикатора до соломенно-жёлтого цвета, затем добавить 1 мл 1% раствора крахмала и титровать до полного обесцвечивания раствора. Титровать до трёх сходящихся результатов.
1.Дописать уравнение реакции, происходящее при титровании, составить электронный баланс и уравнять:
Nа2S2О3 + I2 =
2.Выполнить расчеты по результатам титрования:определить титр и массовую долю тиосульфата натрия в растворе.
2.2.3. Тема: Осадительное титрование. Аргентометрия.
Цель:Овладеть навыками титриметрического анализа методами редоксиметрии
В основе методов осаждения лежат реакции, идущие с образованием осадка. Рабочим раствором является титрованный раствор нитрата серебра.
В зависимости от применяемого индикатора в аргентометрии различают следующие методы:
- Метод Мора, основанный на реакции между ионами серебра и галогенид - ионами в присутствии индикатора - раствора калия хромата. Определяют хлориды и бромиды.
- Метод Фольгарда (тиоцианатометрия, роданометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа (III) в качестве индикатора(железоаммонийные квасцы). Определяют бромиды.
- Метод Фаянса, основан на применении адсорбционных индикаторов(эозинат натрия). Определяют йодиды.
8.Задание: Определение массовой доли натрия хлорида в растворе методом Мора.
Методика:В колбу для титрования поместить 1 мл раствора натрия хлорида, 1-2 капли раствора индикатора хромата калия К2СrО4, 5 мл воды. Титровать 0,1 М раствором нитрата серебра до грязно - розового окрашивания осадка. Титровать до трех сходящихся результатов.
1. Дописать уравнения реакций, проходящие при титровании в молекулярном и ионном виде:
NaCI + AgNO3 =
AgNO3 + K2CrO4 =
2. Выполнить расчеты по результатам титрования:определитьтитр имассовую долю натрия хлорида в растворе.
9. Задание: Определение массовой доли калия иодида концентрации в растворе методом Фаянса.
Методика:В колбу для титрования поместить 1 мл раствора калия иодида, добавить 1,5 мл раствора разведенной уксусной кислоты, 1-2 капли 0,1 % раствора эозината натрия и титровать 0,1М раствором нитрата серебра до розово-малинового осадка. Титровать до трех сходящихся результатов.
1. Дописать уравнения реакций происходящие при титровании:
KI + AgNO3 =
2. Выполнить расчеты: определить титр и массовую долю калия йодида в растворе.
10.Задание: Определение массовой доли натрия бромида в растворе методом Фольгарда.
Определение основано на осаждении, бромид - ионов Вr- избытком 0,1 М раствора нитрата серебра АgNО3 в азотнокислой среде, не прореагирующую часть АgNО3 титровать раствором роданида калия или аммония в присутствии индикатора насыщенного раствора железоаммонийных квасцов
Методика:в колбу для титрования поместить 0,5 мл раствора натрия бромида, 1-2 мл разбавленного раствора азотной кислоты, 2 мл 0,1 М раствора нитрата серебра АgNО3, 1-2 капли индикатора насыщенного раствора железоаммонийных квасцов и титровать избыток АgNО3 0,1 М раствором роданида калия или аммония до красной окраски раствора. Титровать до трех сходящихся результатов.
1. Переписать уравнения реакции, происходящие при титровании:
NaВr + АgNО3 = АgВr↓ + NaNО3 + (АgNО3)избыток
АgNО3 + КSСN = КNО3 + АgSСN↓
в конечной точке титровании:
2FеNН4(SО4)2 + 6КSСN = 2Fе(SСN)3↓ + 3К2SО4 + (NН4)2SО4
2. Выполнить расчетмассовой доли натрия бромида в растворе по формуле:
T (AgNO3/NaВr) · [V(АgNО3) · K(АgNО3) -V(КSСN ) · K(КSСN)] · 100%
ω%( NaВr ) = ------------------------------------------------------------------------------------------------
q(NaВr)
2.2.4. Тема: Комплексонометрия. Трилонометрия.
Цель: Овладеть навыками титриметрического анализа методом комплексонометрии
Коплексонометрическое титрование (или комплексонометрия) основано на образовании прочных комплексных соединений хелатного типа ионов металлов с Трилоном Б. В качестве индикатора используют кислотный хром тёмно-синий. Титрование проводят в аммиачно-буферной среде. Определяют количественное содержание солей двухвалентных металлов (кальция, магния, цинка и др.)
11.Задание: Определение массовой доли цинка сульфата в растворе.
Методика: В колбу для титрования поместить 1 мл раствораZnSO4, 5 мл воды, 2 мл аммиачного буферного раствора и несколько крупинок индикатора кислотного хрома темно-синего, титровать 0,1 М раствором Трилона Б до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании:
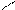 СН2-СООNа
СН2-СООNа
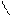 СН2 - N
СН2 - N
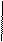 СН2-СООН + ZnSO4=
СН2-СООН + ZnSO4=
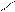 СН2- СООН
СН2- СООН
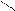 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчеты: определить титр и массовую долю цинка сульфата в растворе.
12.Задание: Определение массовой доли кальция хлорида в растворе.
Методика:В колбу для титрования поместить 1 мл раствора кальция хлорида, 1 мл аммиачного буферного раствора, несколько крупинок индикатора кислотного хрома темно-синего, титровать до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании:
 СН2-СООNа
СН2-СООNа
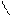 СН2 - N
СН2 - N
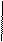 СН2-СООН + СаСl2 =
СН2-СООН + СаСl2 =
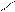 СН2- СООН
СН2- СООН
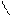 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчет: определить титр и массовую долю кальция хлорида в растворе.
13. Задание: Определение массовой доли магния сульфата в растворе.
Методика: В колбу для титрования поместить 1 мл раствора магния сульфата, 1 мл аммиачного буферного раствора, несколько крупинок индикатора кислотного хрома темно-синего, титровать до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании.
 СН2-СООNа
СН2-СООNа
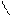 СН2 - N
СН2 - N
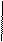 СН2-СООН + MgSO4 =
СН2-СООН + MgSO4 =
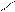 СН2- СООН
СН2- СООН
 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчет: определить титр и массовую долю магния сульфата в растворе.
2.2.5. Тема:Физико - химические методы анализа. Определение процентной концентрации однокомпонентных веществ в растворе методом рефрактометрии.
Цель: Овладеть навыками работы с рефрактометром и определения концентрации веществ методом рефрактометрии
