Гесс заңының салдарын мысалдар келтіре отырып дәлелдеңіз.
Химиялық термодинамиканың 1 заңына сүйеніп Гесс өзінің заңын былай тұжырымдады: реакцияның жылу эффектісі тек қана алғашқы заттар мен реакция өнімдерінің табиғатына және бастапқы заттар мен реакция өнімдірінің соңғы және алғашқы күйлеріне тәуелді, реакция жүретін жолдарына тәуелді емес. Мысалы, 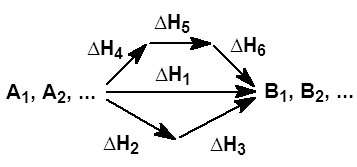 Суретте Гесс заңының мағынасы сызбанұсқа түрінде көрсетілген.Мысалы, алғашқы А және Б заттар реакция нәтижесінде С мен Д заттарды береді делік. Егер
Суретте Гесс заңының мағынасы сызбанұсқа түрінде көрсетілген.Мысалы, алғашқы А және Б заттар реакция нәтижесінде С мен Д заттарды береді делік. Егер 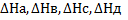 әрбір заттың түзілу жылулары болса, Гесс заңы бойынша
әрбір заттың түзілу жылулары болса, Гесс заңы бойынша 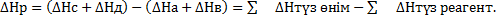 Бұдан шығатын қорытынды: тәжірибе жасамай ақ реакцияның жылу эффектісін есептеуге болады. Гесс заңы бойынша:
Бұдан шығатын қорытынды: тәжірибе жасамай ақ реакцияның жылу эффектісін есептеуге болады. Гесс заңы бойынша: 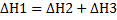 яғни реакцияның жылу эффектісі аралық сатылардың жылу эффектілерінің қосындысына тең. Гесс заңынан мынадай маңызды қорытынды шығады; реакцияның жылу эффектісі реакция өнімдерінің түзілу жылулары мен алғашқы заттардың түззілу жылуларының алгебралық айырмасына тең.
яғни реакцияның жылу эффектісі аралық сатылардың жылу эффектілерінің қосындысына тең. Гесс заңынан мынадай маңызды қорытынды шығады; реакцияның жылу эффектісі реакция өнімдерінің түзілу жылулары мен алғашқы заттардың түззілу жылуларының алгебралық айырмасына тең.
27. Газ күйіндегі және ұшқыш заттардың молекулалық массасын табу әдістері.Газ күйіндегі заттардың молекулалық массасын табудың әдістерімен тансысалық. Авагадро заңына сүйене отырып, газды басқа газбен салыстырғандағы тығыздығынан молекулалық массасын есептеп шығаруға болады. Бірдей жағдайда, газдардың бірдей көлеміндеріндегі молекулалар саны тең болатынын білеміз. Олай болса, көлемдерін бірдей етіп алған екі газдың массаларының қатынасы, олардың молярлық массаларының қатынасындай болады: 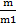 =
= 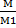 мұнда m-бір газдың, m1-екінші газдың массалары, М мен М1- солардың молярлық массалары. Көлемдерін бірдей етіп алған екі газды бірдей жағдайда өлшегендегі массаларының қатынасы сол газдың біреуінің екіншісімен салыстырған тығыздығы деп аталады. Салыстырмалы тығыздықты Д әрпімен белгілесек , жаңағы жазыған теңдеу мынадай түрге көшеді: D=
мұнда m-бір газдың, m1-екінші газдың массалары, М мен М1- солардың молярлық массалары. Көлемдерін бірдей етіп алған екі газды бірдей жағдайда өлшегендегі массаларының қатынасы сол газдың біреуінің екіншісімен салыстырған тығыздығы деп аталады. Салыстырмалы тығыздықты Д әрпімен белгілесек , жаңағы жазыған теңдеу мынадай түрге көшеді: D= 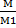 M=D*M1 Яғни, газдың молярлық массасы басқа газбен салыстырғандағы тығыздығы мен сол басқа газдың молярлық массасының көбейтіндісіне тең. Іс жүзінде газдардың тығыздығын не сутекпен, немесе ауамен салыстырып табады. Сонда молярлық массаны есептеп шғарудың формулалары мынадай болады: М=2*D г/моль (сутек арқылы) М=29*D г/моль (ауа арқылы) 1-мысал. Аммиактың сутек арқылы табылған тығыздығыы 8,5.Молярлық массаны табыңыз: Шешуі: М=2*8,5=17 г/моль Бірақ бір газдың молекулалық массасын табу үшін белгілі бір көлемін алып өлшегенде қалыпты жағдайдан басқа жағдайда өлшейміз, ондайда газдың көлемі, әрине, қалыпты жағдайындағыдан басқаша, оның қылпты жағдайындағы көлемін табу үшін Бойль-Мариот пен Гей-Люссактың заңдарын біріктірген Клапейрон теңдеуін пайдаланады PV=
M=D*M1 Яғни, газдың молярлық массасы басқа газбен салыстырғандағы тығыздығы мен сол басқа газдың молярлық массасының көбейтіндісіне тең. Іс жүзінде газдардың тығыздығын не сутекпен, немесе ауамен салыстырып табады. Сонда молярлық массаны есептеп шғарудың формулалары мынадай болады: М=2*D г/моль (сутек арқылы) М=29*D г/моль (ауа арқылы) 1-мысал. Аммиактың сутек арқылы табылған тығыздығыы 8,5.Молярлық массаны табыңыз: Шешуі: М=2*8,5=17 г/моль Бірақ бір газдың молекулалық массасын табу үшін белгілі бір көлемін алып өлшегенде қалыпты жағдайдан басқа жағдайда өлшейміз, ондайда газдың көлемі, әрине, қалыпты жағдайындағыдан басқаша, оның қылпты жағдайындағы көлемін табу үшін Бойль-Мариот пен Гей-Люссактың заңдарын біріктірген Клапейрон теңдеуін пайдаланады PV= 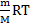 Бұл теңдеуді пайдаланып, олярлық массасын тікелей есептеп шығаруға болады. М=
Бұл теңдеуді пайдаланып, олярлық массасын тікелей есептеп шығаруға болады. М= 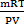
28. Резерфорд ұсынған атомның ядролық моделін, олардың жетістіткері мен кемшіліктерін дәлелдеңіз.Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы шамамен 10−15 м өте аз көлемге жинақталған деген қорытындыға келді. Бұл орталық бөлшекті Резерфорд ядро деп атады. Атомның массасы түгел дерлік ядрода шоғырланған. Ядроныайнала әр түрлі орбиталармен электрондар қозғалып жүреді. Ең шеткі электрон орбитасының радиусы атомның радиусына тең, Ra≈10−10 м. Бұл үлгі Күн жүйесініңқұрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі "бос" болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап. Атомның ішіндегі бос кеңістік "өте үлкен". Сондықтан, фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де, шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесіп, кері ұшады. Мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады. Жоғарыда біз тәжірибеге тек сапалық талдау жүргіздік. Резерфорд сонымен қатар өз моделінің және Томсон моделінің негізшде есептеу жұмыстарын жүргізді, олардың нәтижесі Резерфорд үлгісінің дұрыстығын көрсетті. Бірақ классикалық физика тұрғысынан мұндай атомның орнықты болуы мүмкін емес. Бұдан бұрын айтылғандай, зарядталған бөлшек үдемелі қозғалса, міндетті түрде сәулеленуі (электромагниттік толқындар шығаруы) керек. Бұл сәулеленудің жиілігі электронның ядро маңында айналу жиілігіне тең болуы тиіс. Электрон ядроны айнала дөңгелек орбитамен қозғалса, оның центрге тартқыш үдеуі бар. Олай болса, электрон сәуле шығара отырып, өз энергиясын азайтуы тиіс. Энергияның (орбиталық жылдамдықтың) азаюы электронның ядроға кулон күшінің әсерінен біртіндеп жақындап, ақыры оған құлап түсуіне әкеп соғады. Бұған бар болғаны 10−8 с-ка тең уақыт кетеді екен және классикалық теория бойынша мұндай атомның сәулелену спектрі тұтас болу керек, ал шын мәнінде атомдық спектрдің сызықтық болатынын алдыңғы тақырыпта айтып кеттік. Сайып келгенде, бұл жерде классикалық физиканың заңдары жүрмейтін болып шықты. Тіпті жоғарыда әңгіме болған атомның планетарлық моделі, дәл айтқанда ол бар болғаны нағыз атомның механикалық үлгісі екеніне біртіндеп көзіміз жетеді.
29)Гайтлер-Лондон еңбегіне сай валенттік байланыс (ВБ) түзілуін талдаңыз.Ковалентті байланыстың табиғатын қарастыруда қазіргі уақытта екі әдіс қолданылады-валенттік байланыс әдісі және молекулалық орбитальдар әдісі. Екі бөлшектің электрон бұлттары бүркеісп, жүйенің толық энергиясы азайғанда болатын екі атомның әрекеттесуін химиялық байланыс дейміз. 1927 жылы Гейтлер және Лондон сутегі молекуласы үшін Шредингер теңдеуін жуық шамамен шешті. Олар Шредингер теңдеуі бойынша байланыстың екі түрлі сипатын – энергия мен ядро – аралық ұзындықты есептеді. Бұл есептеулер іс жүзіндегі нәтижелермен бірдей болып шықты. Олар сутек атомының электронының 1s түріндегі толқындық функциясын алды. Егер екі атом бір-біріне әсер етпейтін қашықтықта болса, екі атомның толқындық функцияларының көбейтіндісі арқылы жазылады.
ВБ-әдісі молекулада атомдар жұбы бір немесе бірнеше ортақ электрондық жұптар арқылы ұсталып тұрады деген ұғымға негізделген. Неғұрлым атомдардың электрондық бұлттары көбірек айқасатын болса, атом арасындағы химиялық байланыс соғұрлым мықты болады. Әдетте екі атомды қосатын сызық бойындағы электрон бұлттарының айқасуы біршама жақсы болады. Сонымен, спиндері қарама-қарсы электрон бұлттары бір-бірімен айқасып химиялық байланыс түзіледі де, спиндері параллель электрон бұлттары арасындағы тығыздық кеміп химиялық байланыс түзілмейді. Егер атомдар арасында бір ортақ жұп болса, коваленттк байланыс бірлік, екі жұп болса – екілі және үш жұп болса – үштік байланыс болады. Электрон бұлттарының айқасуы бойынша σ, π, δ – байланыстар түзіледі. Электрон бұлттары атомдарының центрлерін байланыстыратын түзу бойынша айналса, σ-байланыстар түзіледі. Егер р- немесе d-бұлттары атомдарды байланыстыратын түзудің екі жағында айналса, онда π-байланыстар түзіледі, σ үнемі дара байланыс. Еселі байланыстардың біреуі σ-байланыс, ал басқалары π-байланыстар.1928 жылы неміс ғалымдары В.Гейтлер және Ф.Лондон валенттік байланыстар (ВБ) әдісін ұсынып, онымен сутек молекуласына кванттық механикапық есептеулерін жүргізді. Кейінірек бұл әдіс Слейтер, Ван Флек, Л.Полинг еңбектерінде жетіле түсті. Валенттік байланыстар әдісі келесі ережелерге негізделген:
1. Байланыстарды түзуге тек сыртқы электрон кабатындағы электрондар (валеннтік электрондар) катысады;
2. Химиялык байланыстарға түсуші атомдар өзара электрондарымен алмасады да, бұл электрондар байланыстырушы жұптарды түзеді;
3. Химиялық байланыс Паули қағидасына сәйкес, тек антипараллельді спиндегі электрондар арасында ғана түзіледі, мұндайда атом ядроларының арасында электрондық тығыздық жоғарылаған аймақ пайда болады.
4. Химиялык байланыстың сипаттамалары (энергиясы, ұзындығы, үйектігі және т.б.) атомдык орбитальдардың қайта жабылу типімен анықталады;
5. Молекулалар түзілген кезде электрондық құрылым (сырткы кабаттан басқасы) және әрбір атомның химиялық өзінділігі сақталынады.
Валенттік байланыс теориясына сәйкес коваленттік байланыстар әрекеттесуші атомдардың АО максималды кайта жабу жағына бағытталған.
Химиялық байланыстарды түзумен қатар атомның қосып алу және баска атомдардың белгілі санының орнын басу қабілеттілігін валенттілік деп атайды. Валенттік байланыстар әдісінің алмасымдық механизміне орай ортак электрондық жұп (коваленттік байланыс) түзуге әрбір атом жұптаспаған бір электроннан береді. Валенттік байланыстар әдісінде алмасымдык механизміндегі валенттіліктің сандык өлшемі ретінде атомның негізгі немесе қоздырылған күйде болатын тұтаспаған электрондар санын есептейді. Бұл сырткы электрондық қабаттың жұптаспаған электрондары з- және р-элементте, сі-элементтердің сыртқы және оның ішкері жағындағы қабатта, сол сиякты элементтердің сыртқы үш кабаттарында болады (орналасады).
Атомның қоздырылған күйге ауысуы элемент валенттілігінің артуына және ауыспалы валенттіліктің бар болуына мүмкіндік жасайды. Мысалы оттек пен фтор атомдарындағы электрондық жұптар бөліне (ажыраса) апмайды, өйткені екінші қабатта бос орбитальдар жоқ. Олардан өзгеліктері, күкірт пен хлор ЗД-қабатшаның бос орбиталіне ажыраса алады, тиісінше күікірт 1 және 2 валенттіліктен (негізгі күйінде) басқа тағы да 4 және 6 валенттілікте (қоздырылған күйінде) болады, ал хлор 1 валенттіліктен (негізгі күйінде) басқа 3,5 және 7 валенттілікте (коздырылған күйінде) болады.
1.ВБ әдісі көптеген молекулалардың геометриялық құрылысын түсіндіруге мүмкіндік береді.
2.Гибридті орбиталдардың кеңістікте орналасуы өзара электрон бұлттарының приципіне бағынады.
3.Гибридтеліну коволентті баланыстың ерекше қасиеті байланыстың бағытталынуын сипаттайды.Ковалентті байланыстың иондық байланыстан басты айырмашылығы иондық байланысқа бағытталу қасиеті тән еме
30)Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмін талдаңыз NH4+ мысалында.
Химиялық байланыстың табиғаты-химияның ең негізгі мәселелерінің бірі.Коваленттік байланысты екі түрге бөледі: полярлы және полярлы емес. Молекулалардың атомдардан электрондар жұбы арқылы түзілуін ковалентті байланыс деп атайды. Бұл байланыс екі түрлі механизм бойынша түзіледі:алмасу механизмі - әр элемент байланысқа өзінің эектронын береді, мысалы,сутегі молекуласы түзілгенде Н× + ×Н ® Н : Н; Коваленттік байланыс сонымен қатар донорлы-акцепторлы механизммен түзілуі мүмкін. Донорлы-акцепторлы байланыс – бұл жағдайда химиялық байланыс бір атомның қос электронды бұлты (донор) мен басқа атомның бос орбиталь (акцептор) арқылы түзіледі.Бұл жағдайда химиялық байланыс бір атомның екі электрон бұлттары мен басқа атомның бос орбиталі нәтижесінде түзіледі (NH4+).ВБ әдісі бойынша коваленттік байланыс қосылатын атомдардың жалқы электроны орбитальдарының бүркесуі нәтижесінде жасалады.Жалқы электронды орбитальдар бүркескенде қосылушы екі атомның екеуіне де ортақ электрон жұбы түзіледі.Ортақ жұп қосылатын атомдардың біреуінің қос электронды орбиталі екіншісінің бос орбиталімен бүркескенде де түзіледі.Бұның мысалы ретінде аммоний ионының түзілуін келтіруге болады:
 +
+ 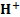 = NH4+
= NH4+
Аммоний ионы аммиак молекуласы сутек ионын қосып алғанда түзілетіндіктен аммиак молекуласы мен сутек ионының электрондық құрылысын еске түсіреміз.
2S 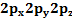
Азот атомының жалқы электронды 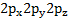 орбитальдары үш сутек атомының 1S-орбитальдарымен бүркескенде түзіледі.Аммиак молекуласындағы азот атомының байланыс түзуге қатыспаған қос электронды 2S–орбиталі бар, яғни пайдаланылмаған электрон жұбы бар. Сутек атомынығ 1 S-орбиталі бос.Сутек катионының бос рбиталі аммиак молекуласындағы азот атомының қос электронды орбиталімен жұптасып,олардың арасындағы коваленттік байланыс түзіледі.
орбитальдары үш сутек атомының 1S-орбитальдарымен бүркескенде түзіледі.Аммиак молекуласындағы азот атомының байланыс түзуге қатыспаған қос электронды 2S–орбиталі бар, яғни пайдаланылмаған электрон жұбы бар. Сутек атомынығ 1 S-орбиталі бос.Сутек катионының бос рбиталі аммиак молекуласындағы азот атомының қос электронды орбиталімен жұптасып,олардың арасындағы коваленттік байланыс түзіледі.
| H |
| H |
| HhHH |
| N |
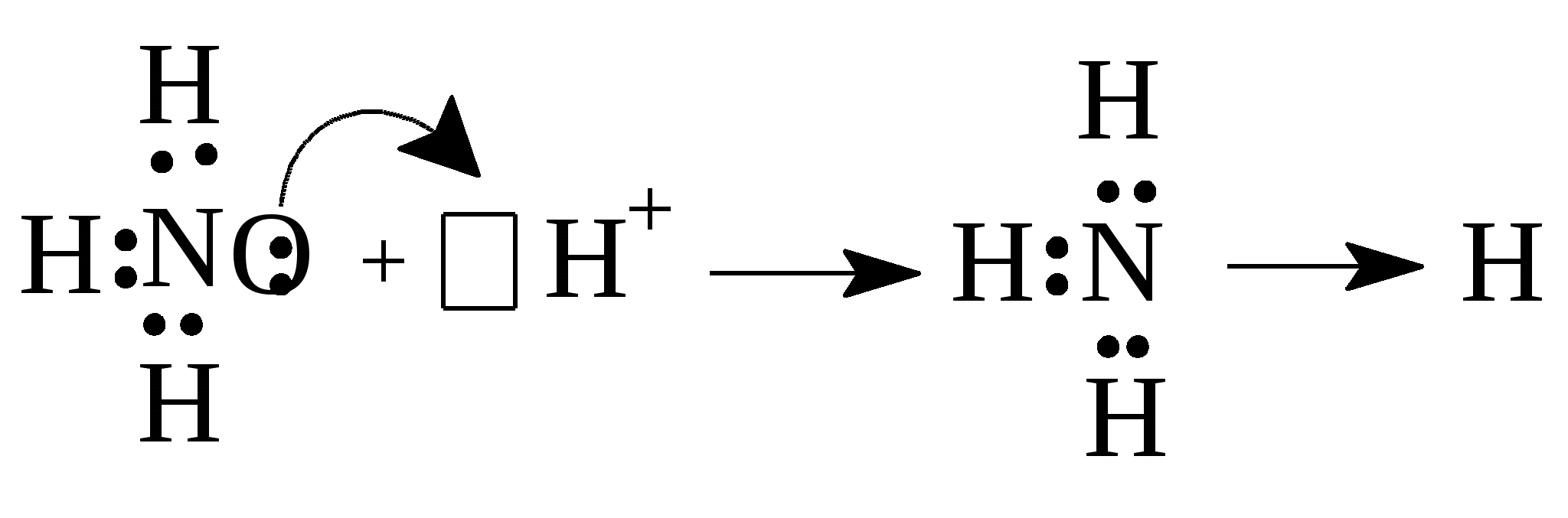
Сутекионының алдындағы ұяшық сутек ионының бос орбиталі бар дегенді білдіреді.Аммоний ионында төртковаленттік байланыс бар:оның үшеуі жалқы электронды орбитальдың ,ал төртіншісі қос электронды орбиталь мен бос орбитальдің бүркесуі арқылы жасалған.Бір атомның қос электронды жұбы екінші атомның бос орбиталімен бүркескенде(жұптасқанда )түзілетін коваленттік байланыс доноры-акцепторлы не болмаса координациялық байланыс деп те аталады.Донор –бұл қос екі электрондық бұлты бар атом, ал акцептор –бұл электрон жұбын қабылдауға қабілетті бос орбиталы бар бөлшек.Біздің жағдайымызда донор-аммиак молекуласындағы азот,акцептор-сутек катионы. Донорлық-акцепторлық механизм -бір атомның электрон жұбы (донор) ортақ болады, ал екінші атомнан бос орбитал ( акцептор) болады: Н+ + :NH3 ® NH+4 . Бұл жағдайда химиялық байланыс бір атомның екі электрон бұлттары мен басқа атомның бос орбиталі нәтижесінде түзіледі.
