Потенциал – определяющие компоненты природных вод
Основные компоненты, определяющие окислительно – восстановительный потенциал природной воды, следующие: растворенный кислород и соединения железа (III) (в присутствии этих компонентов среда считается окислительной), а также органические вещества, сероводород и соединения железа (II) (в присутствии этих компонентов среда считается восстановительной).
Кислород. Если потенциал природной воды определяется растворенным кислородом, то он лежит в районе верхней границы устойчивости водных растворов. Кислород является потенциал –определяющим компонентом в водах, имеющих хороший контакт с атмосферой. Причем, поскольку кислород в воде расходуется, а его диффузия происходит достаточно медленно, то чем хуже происходит перемешивание, тем ниже потенциал природной воды. Если в воде, даже находящейся в контакте с воздухом, растворено много органических веществ или сероводорода, растворенный кислород полностью восстанавливается до воды и тогда потенциал определяется органическими веществами или сероводородом.
Органические вещества. В случае, если в воде растворено или взвешено большое количество органических веществ, они становятся потенциал – определяющим компонентом. Значение Е такой воды может колебаться в весьма широких пределах (нижние 3/4 всей области устойчивости воды), причем Е зависит от свойств конкретных органических веществ. Наиболее низок потенциал, задаваемый органическими веществами в донных отложениях, куда затруднен
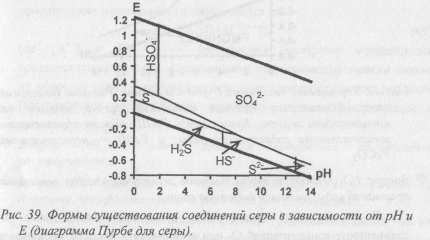
Соединения серы. При разложении органических веществ в воду может переходить сероводород. Если его растворено много, он определяет потенциал природной воды. Потенциал таких вод лежит у нижней границы устойчивости водных растворов, в области существования сероводорода и сульфидов (Рис.), причем, в зависимости от рН, H2S существует в форме кислоты или в форме HS– (Рис.). Сульфат – ион не определяет потенциал, поскольку его восстановление кинетически заторможено. В редких случаях потенциал может определять мелкодисперсная сера. SO2, попав в воду, выступает преимущественно как восстановитель, однако эта форма в водных растворах термодинамически неустойчива.
Соединения железа. Иногда потенциал природной воды определяют соединения железа (Рис.). Если в воде присутствуют ионы Fe3+, то ее потенциал лежит у верхней границы устойчивости воды. Однако, поскольку гидратированный ион [Fe(H2O)6]3+ — довольно сильная кислота (по Бренстеду –Лоури), этот ион (обычно его обозначают Fe3+) может присутствовать только в сильнокислых средах. В нейтральных и основных средах Е может определяться нерастворимым Fe(OH)3, однако такая ситуация редка, поскольку восстановление Fe(OH)3 происходит очень медленно.
Ион Fe2+ может определять низкий потенциал природной воды даже в слабощелочной области. В частности, этот ион может существовать в гидрокарбонатной буферной системе. Fe(OH)2 иногда тоже может служить потенциал – определяющим компонентом, поскольку его окисление происходит существенно быстрее, чем восстановление Fe(OH)3.

В случае, если концентрация соединений железа мала по сравнению с концентрацией 02 или органических веществ, соединения железа перестают определять потенциал, и сами переходят в форму, наиболее устойчивую при условиях, задаваемых другими компонентами. В частности, если красные, то есть содержащие Fe(III), глины находятся в контакте с органическими веществами (например, если на этих глинах лежит болотная почва или торф), то железо восстанавливается до Fe(II), например:
HFeSiO4 + «С»+ СО2 + Н2О –» Fe2+ + НСО3– + Si02.
Если раствор, содержащий железо (II), выходит на поверхность, то железо (II) окисляется кислородом воздуха:
4Fe2+ + О2 + 10Н2О = 4Fe(OH)3 + 8H+.
Со временем Fe(OH)3 теряет воду и образуется болотная руда (Fe2O3):
2Fe(OH)3 = Fe2O3 + ЗН2О.
