Растворимость газа в жидкости прямо пропорциональна парциальному давлению данного газа над поверхностью жидкости Р
P = k· X,
где k – коэффициент пропорциональности, зависящий от вида газа, растворителя и температуры, и являющийся мерой растворимости газа; Х – мольная доля газа в жидкости.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и в отсутствие химического взаимодействия между молекулами растворяемого газа и растворителем. В области низких и умеренных давлений растворимость газов всегда растет с повышением давления (рис. 3а). При очень высоких давлениях растворимость может достигнуть максимума (рис. 3б). Это обусловлено тем, что изменение объема жидкости в результате растворения в ней газа при очень высоких давлениях становится соизмеримым с объемом растворенного газа.
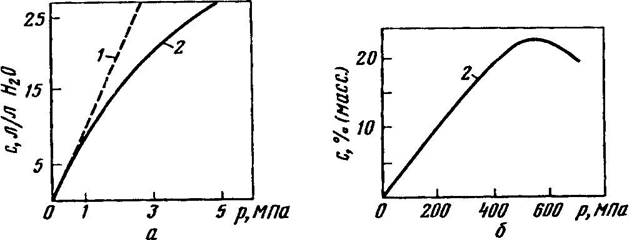
Рис. 3. Зависимость растворимости СO2 воде при 15°С (a) и N2 в жидком диоксиде серы при 25°С (б) от давления:
1 - по закону Генри; 2 - экспериментальные данные
Применительно к процессу растворения газа при небольших давлениях закон Генри можно сформулировать так: объем газа, растворяющегося при данной температуре в определенном количестве растворителя, не зависит от давления газа (это непосредственно следует из закона Бойля -Мариотта).
2. Растворимость жидкостей в жидкостях
При растворении жидкостей друг в друге наблюдают три случая:
а) жидкости, смешиваемые в неограниченных количествах (спирт – спирт, спирт – вода);
б) практически нерастворимые друг в друге жидкости (бензин –вода);
в) ограниченно растворимые жидкости (эфир – вода, фенол – вода).
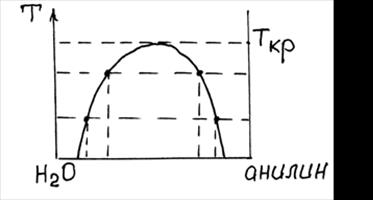 Растворимость жидкости в жидкости растет с температурой и при некоторой температуре наблюдается полная взаимная растворимость. Температура, при которой ограниченно растворимые жидкости полностью растворяются, называется критической (рис. 4). Ниже Ткр, в зависимости от состава, растворимость изменяется.
Растворимость жидкости в жидкости растет с температурой и при некоторой температуре наблюдается полная взаимная растворимость. Температура, при которой ограниченно растворимые жидкости полностью растворяются, называется критической (рис. 4). Ниже Ткр, в зависимости от состава, растворимость изменяется.
Рис. 4. Изменение раствори-
мости ограниченнораствори-
мых жидкостей при повыше-
нии темературы
3. Растворимость твердых веществ в жидкостях
В соответствии со значениями растворимости различают вещества
а) хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (более 1,0 г на 100 г воды);
б) малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (0,1 г - 1,0 г на 100 г воды);
в) практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя (менее 0,1 г на 100 г воды).
Растворимость - наиболее изученное свойство растворов. Качественная характеристика растворимости различных веществ при комнатной температуре приведена в таблице растворимости, количественная характеристика - в справочных таблицах по значениям растворимости. Для различных веществ она колеблется в значительных пределах. В табл. 3 указана растворимость некоторых веществ в одном растворителе (в воде), а в табл. 4 - растворимость одного вещества (иодида калия) в различных растворителях.
Таблица 3
Растворимость некоторых веществ в воде при 20°С
| Вещество | Растворимость, г на 100 г H2O | Вещество | Растворимость, г на 100 г H2O |
| C6H12O6 (глюкоза) | CaCO3 | 0,0013 | |
| NaCl | AgI | 0,00000013 | |
| H3BO3 |
Таблица 4
Растворимость иодида калия в различных растворителях при 20°С
| Растворитель | Растворимость, % (масс.) | Растворитель | Растворимость, % (масс.) |
| H2O | 59,1 | CH3NO2 | 0,307 |
| NH3(ж) | 64,5 | н-C4H9OH | 0,20 |
| C2H6O2 (этиленгликоль) | 33,01 | С5H5CN | 0,05 |
| CH3OH | 14,97 | C6H5NO2 | 0,00016 |
| CH3COCH3 | 1,302 | CH3COOC2H5 | 0,00012 |
Абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость крайне незначительна.
Если ввести в систему, состоящую из двух несмешивающихся жидкостей, растворимое в них вещество, то оно распределится между этими жидкостями так, что при данных температуре и давлении отношение его концентраций в этих растворителях c1 и с2 остается неизменным (независимо от общего количества распределенного вещества), т. е.
c1/c2 = K
Константа равновесия К в данном случае называется коэффициентом распределения, а приведенное соотношение представляет собой закон распределения. Уравнение справедливо при условии одинакового молекулярного состава растворенного вещества в обеих фазах (должны отсутствовать как диссоциация, так и ассоциация молекул).
На законе распределения основана широко применяемая в промышленности экстракция - процесс извлечения вещества из раствора в слой другой, не смешивающейся с раствором жидкости (экстрагента).
С изменением температуры растворимость твердых веществ изменяется в зависимости от соотношения ∆Hраств и ∆Hсольв.
Растворимость твердых веществ обычно увеличивается с ростом температуры (рис. 5) и лишь для некоторых веществ (CaSO4, Li2CO3) наблюдается обратное. На кривой растворимости сульфата натрия имеется излом, соответствующий 32,4°С. До этой температуры насыщенный раствор находится в равновесии с осадком кристаллогидрата Na2SO4·10Н2O, выше ее - с безводной солью. Резкое изменение хода кривой растворимости сульфата натрия обусловлено значительной эндотермичностью процесса растворения кристаллогидрата и экзотермичностью растворения безводной соли.

Рис. 5. Зависимость растворимости некоторых солей от температуры
Твердые растворы могут образовываться при кристаллизации жидких расплавов или при растворении газов в твердых веществах. Наиболее распро-страненным типом твердых растворов являются растворы замещения, реже встречаются твердые растворы внедрения.
Твердые растворы замещения образуются, если атомы растворяющего А и растворяемого Б элементов по своим размерам отличаются незначительно; в этом случае в кристаллической решетке атомы элемента А частично замещают-ся атомами элемента Б (рис. 6a). Если же атомы растворяемого элемента B заметно меньше атомов элемента А, то при кристаллизации расплава атомы ве-щества B размещаются в пустотах кристаллической решетки элемента А и обра-зуется твердый раствор внедрения (рис. 6b).
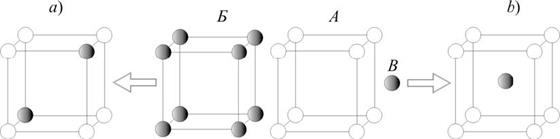
Рис. 6. Схемы образования растворов замещения (a) и внедрения (b)
Вещества, образующие твердые гомогенные системы при любом соотно-шении компонентов (т. е. неограниченно растворимые друг в друге), встреча-ются редко (обычно это твердые растворы замещения). Достаточно редко встречаются и вещества, практически полностью не растворимые друг в друге в твердом состоянии. Чаще наблюдается ограниченная взаимная растворимость веществ, охватывающая более или менее широкий интервал составов.
