Экзамена по дисциплине Общая химия. Биоорганическая химия
ОБРАЗЕЦ ЭКЗАМЕНАЦИОННОГО БИЛЕТА
по дисциплине «Общая химия. Биоорганическая химия»
(факультет: медико-профилактический; курс – первый)
Билет состоит из двух (тестовой и творческой) частей.
Тестовая часть включает 25 тестовых заданий
Тестовая часть билета
Вариант 1.
1. Концентрация ионов водорода в содержимом тонкого кишечника (рН = 8,0) равна:
1) 1.10−14 2) 1.10−8 3) 1.10−6 4) 1.10−4
2. Молярная масса эквивалента хлорида алюминия в реакции образования диакватетрагидроксоалюмината
составляет: 1) М(Х)/6 2) М(Х)/3 3) М(Х) 4) М(Х)/4
3. Число катионов, образующихся при диссоциации 90,2 г фосфата натрия (α= 0,86), равно:
1) 9,93.1023 2) 2,85.1023 3) 9,3.1023 4) 6,6.1023
4. рН основного буфера вычисляется по формуле:
1) 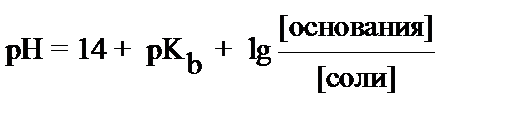 2)
2) 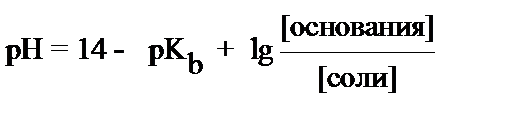
3) 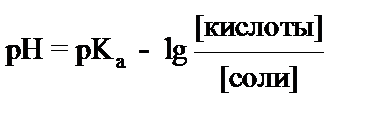 4)
4) 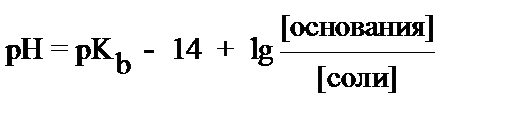
5. В большей степени подвергается гидролизу натриевая соль:
1) родановодородной кислоты (Ka =1,4.10−1)
2) уксусной кислоты (Ka = 1,75.10−5)
3) муравьиной кислоты (Ka = 1,77.10−4)
4) циановодородной кислоты (Ka = 6,5.10−10)
6. Одномоляльные водные растворы нелетучих неэлектролитов кипят при:
1) 0,52 0С 2) 100,520С. 3) 273 К 4) 273,52 К
7. Осмос – это:
1) односторонняя диффузия молекул растворителя через полупроницаемую перегородку в сторону раствора с большей концентрацией
2) односторонняя диффузия молекул растворенного вещества через полупроницаемую перегородку в сторону раствора с большей концентрацией
3) односторонняя диффузия молекул растворителя через полупроницаемую перегородку в сторону раствора с меньшей концентрацией
4) диффузия молекул растворителя и растворенного вещества через полупроницаемую перегородку в направлении выравнивания концентраций раствора
8. Плазма крови начинает замерзать при 272,41К (−0,590С). К(Н2О) = 1,860. Моляльная концентрация веществ в плазме при 370С (310К) составляет (в моль/кг):
1) 0,32 2) 3,2 3) 0,032 4) 32
9. В насыщенном растворе электролита CaSO4 при постоянной температуре:
1) ПР = [Ca2+].[SO42−]
2) ПР = [Ca2+].[2SO42−]
3) ПР > [Ca2+].[SO42−]
4) ПР < [Ca2+].[SO42−]
10. Открытой называется такая система, для которой:
1) Dm = 0; DU = 0; 2) Dm ¹ 0; DU ¹ 0; 3) Dm = 0; DU ¹ 0; 4) Dm ¹ 0; DU=0;
11. Укажите математическое выражение второго закона термодинамики применительно к
изолированным системам:
1) DG = DH – T.DS 2) H = U + pV 3) dS.T > dQ 4) S = k.lnW
12. Следствие из закона Гесса применительно к реакциям сгорания выражается уравнением:
1) DHр = SDHсгор. исх. в-в – SDHсгор. прод. реакции
2) DHр = SDHсгор. прод. реакции – SDHсгор. исх. в-в
3) DHр = SDHсгор. исх. в-в + SDHсгор. прод. реакции
4) DHр = SDHсгор. прод. реакции . SDHсгор. исх. в-в
13. Измерение скорости химической реакции основано на определении концентрации вещества,
которую определяют:
1) измерением показателя преломления в ходе реакции;
2) измерением угла вращения плоскости поляризации в ходе реакции;
3) измерением электропроводности раствора в ходе реакции;
4) всеми перечисленными способами.
14. На энергетической диаграмме эндотермической реакции, протекающей с образованием переходного комплекса (рис. б) энергии активации соответствует: 1) энергия Е1 2) энергия Е2 3) энергия Е3 4) энергия Е4 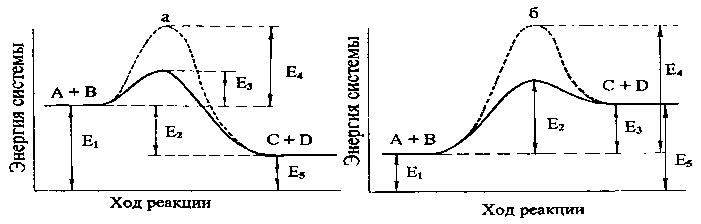 |
15. Верны ли следующие суждения?
А. Действие катализатора основано на снижении энергию активации.
Б. Гомогенные реакции протекают быстрее, чем гетерогенные.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны.
16. Физическая адсорбция на твердой поверхности часто происходит за счет:
1) образования ионной связи;
2) образования ковалентной связи;
3) образования полярно-ковалентной связи;
4) образования водородной связи.
17. Укажите формулу, соответствующую теории адсорбции Фрейндлиха:
1) 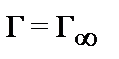 2)
2) 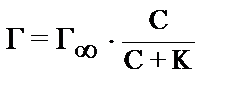 3) Г = K. С1/n 4)
3) Г = K. С1/n 4) 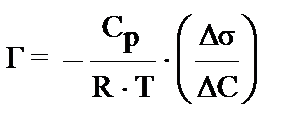

18. Согласно правилу Дюкло и Траубе при замене пропионовой кислоты (С2Н5СООН) капроновой кислотой (С5Н11СООН) поверхностная активность жирных кислот в среднем:
1) возрастает в 9 раз;
2) возрастает 3 раза;
3) возрастает 27 раз;
4) уменьшается 9 раз;
19. Адсорбция и адсорбционные явления:
1) объясняют образование, разрушение и свойства коллоидных систем;
2) лежат в основе хроматографического метода разделения веществ, в водоподготовке;
3) имеют место при очистке некоторых фарм.препаратов, в производстве маргарина, жирных масел;
4) наблюдаются во всех перечисленных случаях.
20. Укажите свойство, характерное суспензиям:
1) размер частиц 1-100 нм
2) частиц невидны в обычный микроскоп
3) свойственна опалесценция и эффект Фарадея-Тиндаля
4) обнаруживается броуновское движение
21. Электрофорез — это движение под действием электрического тока:
1) молекул жидкости
2) молекул растворенного вещества
3) молекул растворителя
4) коллоидных частиц
22. Строение мицеллы выражается формулой {mAgCl.nCl-.(n-x)K+}.xK+. Какой из
электролитов обладает наименьшей коагулирующей способностью?
1) Na2SO4 2) MgSO4 3) K3[Fe(CN)6] 4) K4[Fe(CN)6]
23. Какое вещество при добавлении к коллоидному раствору может повысить устойчивость лиофобных частиц к коагулирующему действию электролитов?
1) хлорид натрия 2) глюкоза 3) этанол 4) желатин
24. В каком ряду соединений указаны только вещества, относящиеся к углеводам?
1) целлюлоза, полипептид, галактоза
2) сахароза, крахмал, гидролаза
3) глюкоза, фруктоза, целлюлоза
4) рибоза, крахмал, глицерин
А25. Качественная реакция на обнаружение глюкозы:
1) обесцвечивание бромной воды
2) реакция «серебряного зеркала»
3) взаимодействие с металлическим натрием
4) взаимодействие с раствором хлорида железа (III)
В творческой частиэкзаменационного билета 5 вопросов: из них 2 – теоретические основы поверхностных явлений и химии дисперсных систем и 3 расчётныx задания по определенным темам.
Вариант 1.
1. Какие силы могут действовать между молекулами или ионами адсорбента и адсорбтива? Виды адсорбции. Привести примеры.
2. Какие вещества в организме проявляют свойства полуколлоидов? Какое значение в жизнедеятельности имеет образование ими коллоидных мицелл? Как используют полуколлоиды в медицине?
3. Расчетное задание по темам «Способы выражения концентрации растворов, вычисление активности ионов в растворах, концентрации ионов водорода и рН, диссоциация, гидролиз, буферные растворы, растворимость веществ и произведение растворимости», например (приведены типовые задания):
3.1. В растворе содержатся ионы кальция, свинца и стронция с концентрацией 1 .10−3 моль/л. В этот раствор по каплям внесли раствор сульфата натрия до концентрации этой соли до 1.10−3 моль/л. На основе расчетов докажите возможность выпадения солей в осадок и их последовательность осаждения. ПР[CaSO4] = 2,4.10−5; ПР[PbSO4] = 1,3.10−8; ПР[SrSO4] = 7,6.10−7.
3.2. Степень и константа диссоциации электролитов. В 0,2 М растворе фосфористой кислоты концентрация ионов водорода равна 0,05 моль/л. Вычислите константу и степень диссоциации кислоты, предполагая, что второй протон не отщепляется.
3.3. При исследовании активности трансфераз динитрофенилгидразиновым методом применяют фосфатный буфер. Для его приготовления смешивают 160 мл 0,1 М раствора дигидрофосфата калия KH2PO4 и 840 мл 0,1 М раствора гидрофосфата натрия Na2HPO4. Вычислите рН буферного раствора. рK2(Н3РО4) = 7,21.
4. Расчетное задание по темам «Коллигативные свойства растворов, кинетика химических реакций и термохимические расчеты», например (приведены типовые задания):
4.1.Исходя из термохимических уравнений:
2KClO3(тв) = 2KCl(тв) + 3O2(г), ∆Н = − 98,8 кДж
KClO4(тв) = KCl(тв) + 2O2(г), ∆H = 33 кДж.
Вычислите тепловой эффект реакции 4KClO3(тв) = KCl(тв) + 3KClO4(тв). Будет ли при этом выделяться теплота?
4.2. Температура кипения раствора, содержащего 6,4 г адреналина в 360 г CCl4 на 0,49 градусов выше температуры кипения чистого CCl4. Какова молярная масса адреналина (Е(CCl4) = 5,02 кг.К/моль).
4.3. Равновесие в системе N2 + 3H2 Û 2NH3 устанавливается при следующих концентрациях: [N2] = 0,02 моль/л, [H2] = 3 моль/л, [NH3] = 0,5 моль/л. Вычислите константу равновесия и начальные концентрации исходных веществ. В каком направлении протекает данная реакция при стандартных условиях.
5. Расчетное задание по темам «Поверхностные явления. Физико-химические свойства дисперсных систем», например (приведены типовые задания):
5.1. Строение лиофобных коллоидных частиц. Напишите формулу мицеллы золя йодида серебра, полученного добавлением к 30 мл 0,006 М раствора йодида калия 40 мл 0,004 М раствора нитрата серебра. Укажите способ получения золя.
5.2. Уравнение и изотерма Ленгмюра. Экспериментально установлено, что величина максимальной адсорбции на угле составляет 3.10-3 моль/г. Какова адсорбция пропионовой кислоты из раствора, в котором установилась равновесная концентрация 0,1 моль/л, если масса адсорбента 1 г, а константа равновесия 6.10-2 моль/л?
5.3. Правило Шульца-Гарди. Пороги коагуляции некоторого золя электролитами KNO3, Mg(NO3)2, AlCl3 равны 50; 0,8 и 0,06 ммоль/л соответственно. Как относятся между собой величины коагулирующих способностей этих электролитов? Укажите коагулирующие ионы и знак заряда гранулы коллоидной частицы.
ОЦЕНКА ОТВЕТА
экзамена по дисциплине Общая химия. Биоорганическая химия
1. Вопросы по тестовой части 25 : Правильный ответ – 2 балла
Всего: 25х2 = 50 баллов
2. Вопросы творческой частиэкзамена оцениваются 10 баллами (шагом 2,5 балла)
Всего: 5 х10 = 50 баллов
