Стереоспецифичность к D-сахарам
Стереоспецифичность к L-аминокислотам.
Стереоспецифичносгь кα- иβ-гликозидным связям.Фермент амилаза действует только на а-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями.
Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов.
Если стерерокаталитическая специфичность – субстрат просто не должен иметь стереоизомеры.
ВОПРОС № 39
Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения энергетики химических реакций и с точки зрения событий в активном центре.
 E ¯ энергию активации, т.е. ¯ высоту энергетического барьера, в результате доля реакционноспособных молекул, следовательно V реакции. Реакция, катализируемая Е, имеет более низкую энергию активации.
E ¯ энергию активации, т.е. ¯ высоту энергетического барьера, в результате доля реакционноспособных молекул, следовательно V реакции. Реакция, катализируемая Е, имеет более низкую энергию активации.
 катализируемая Е и некатализируемая им реакции имеют одинаковую величину изменения свободной энергии (ΔG).
катализируемая Е и некатализируемая им реакции имеют одинаковую величину изменения свободной энергии (ΔG).
Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня Еа. Точнее, она разбивается на несколько низких значений, которые легче преодолеть Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции.
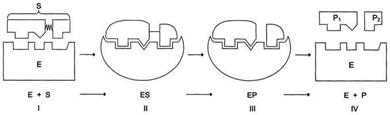
В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений - фермент-субстратный комплекс ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции.
Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов.
Сходство ферментов с небиологическими катализаторами заключается в том, что:
- ферменты катализируют энергетически возможные реакции;
- энергия химической системы остаётся постоянной;
- в ходе катализа направление реакции не изменяется;
- ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
- скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
- ферменты обладают высокой специфичностью;
- ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН;
- скорость ферментативной реакции может регулироваться.
Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт.
1)Кислотно-основный катализ
2)Ковалентный
3)С ионами Ме
4)Электростатический
5)За счет эффектов ориентации и сближения
6)С преимущественным образованием промежуточного комплекса
Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента
ВОПРОС № 40
Сравнение множества клеток самых разных типов показывает, что набор содержащихся в них ферментов во многом сходен. По-видимому, во всех живых организмах протекают в основном одни и те же метаболические процессы; некоторые различия, касающиеся конечных продуктов обмена, отражают скорее наличие или отсутствие того или иного фермента, нежели изменение общего характера метаболизма.
Однако в характере метаболизма, химическом составе и строении различных тканей и различных организмов имеются и бесспорные различия. Что касается метаболизма, то особенности его в соответствующих органах или тканях, несомненно, определяются набором ферментов. Различия в химическом составе органов и тканей тоже зависят от их ферментного состава, в первую очередь от тех ферментов, которые участвуют в процессах биосинтеза.
Ферментный состав различных клеток неодинаков. Ферменты, выполняющие функцию жизнеобеспечения клетки, находятся во всех клетках организма. В процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза, участвующая в гидролизе моноэфиров ортофосфорной кислоты, - в клетках простаты. Это так называемые органоспецифичные ферменты.
Если говорить об узко специализированных клетках, то ферментов, выполняющих функции в этих клетках, находится больше, чем в других клетках. Например, в клетках сердечной мышцы имеется повышенное количество ферментов креатинкиназы и аспартатаминотрансферазы, в клетках печени - аланинаминотрансферазы и аспартатаминотрансферазы, в остеобластах - щелочной фосфатазы и т.д.
ВОПРОС № 41
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных "сценариев".
Нарушение образования конечных продуктов.Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов
Накопление субстратов-предшественников.При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний
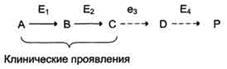
Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях. У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов предшественников.Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
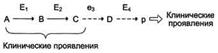
Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы . Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
В клинической практике широко применяется количественное определение диастазы (панкреатической амилазы) в моче. Появление этого фермента в моче связано с деструкцией клеток поджелудочной железы при различной патологии и попадании фермента в кровь, а затем через почки в мочу
Принцип метода: α-амилаза гидролизует крахмал с образованием конечных продуктов, не дающих цветной реакции с йодом. При взаимодействии крахмала с йодом образуется окрашенный комплекс, оптическая плотность которого при 640 нм пропорциональна концентрации негидролизированного крахмала. Активность α-амилазы оценивают по уменьшению интенсивности окраски
Берем 2 пробирки. Прогреваем и вносим компоненты в термостате при температуре 37 градусов. 1 пробирка – без мочи (холостая), вторая – с мочой. Выдерживаем время. Вносим соляной кислоты раствор и в 1 пробирку – мочу. Затем в обе йод. Определяем оптические плотности проб. Зная их, можно рассчитать активность амилазы.
ВОПРОС № 42
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
ВОПРОС № 43
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях:
· заместительная терапия - использование ферментов в случае их недостаточности;
· элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:
Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкоз-ных клетках дефектного фермента аспарагинсинтетазы, катализирующего реакцию синтеза аспарагина.
Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате - нарушение метаболизма клетки.
ВОПРОС № 44
До недавнего времени ферменты служили лишь объектом исследования в клинической биохимии, и лишь сравнительно недавно они стали использоваться, как аналитические реагенты, то есть как реактивы для количественного определения других веществ.
Преимущества ферментативных методов исследования: высокая точность, специфичность (в силу специфичности используемых ферментов), чувствительность. К этим «трем китам», на которых стоят ферментативные методы, следует добавить простоту проведения анализа, значительное сокращение времени исследования и, часто, отсутствие необходимости построения калибровочных графиков.
На использовании в качестве индикаторного фермента глюкозо-6- фосфатдегидрогеназы (Г6ФДГ) основан самый точный метод из всех существующих методов определения глюкозы. Здесь реакция идет по схеме:
Глюкоза + АТФ =(гексокиназа)= глюкозо-6-фосфат + АДФ
Глюкозо-6-фосфат + НАДФ = (Г6ФДРГ)=НАДФН
Эта реакция сопровождается накоплением НАДФН и, следовательно, возрастанием оптической плотности при 340 нм. Регистрируется спектрофотометрическими методами. Расчет содержания глюкозы в анализируемом образце может быть произведен.
Другой подход к определению глюкозы основан на использовании сопряженной системы глюкозооксидаза + пероксидаза и более широко известен. При участии глюкозооксидазы глюкоза окисляется кислородом воздуха с образованием перекиси водорода, количество которой определяется по ее способности в присутствии пероксидазы окислять диамины с образованием окрашенных продуктов.
Известны лабораторные методы определения содержания мочевины в моче, основанные на её гидролизе в присутствии соевой уреазы с последующим измерением количества аммиака, выделившегося в результате реакции.
Определение содержания этанола связано с использованием алькогольдегидрогеназы, катализирующей окисление первичных до альдегидоа. Нашло применение в судебно-медицинской практике.
| Глюкозооксидаза | Определение концентрации глюкозы в крови |
| Холестеролоксидаза | Определение холестерина в крови |
| Липаза | Определение триацилглицеринов в крови |
| Уреаза | Определение мочевины в крови |
ИММОБИЛИЗОВАННЫЕФЕРМЕНТЫ (от лат. immobiiis - неподвижный) - препараты ферментов, молекулы к-рых связаны с матрицей, или носителем(как правило, полимером), сохраняя при этом полностью или частично свои каталитич. св-ва. Иммобилизованные ферменты обычно не раств. вводе; между двумя фазами возможен обмен молекулами субстрата, продуктов каталитич. реакции, ингибиторов и активаторов. Преимуществом метода захвата является то, что фермент сохраняется в естественном состоянии.
Иммобилизованные ферменты применяют в произ-ве L-аминокислот, 6-аминопенициллановой к-ты, из к-рой получают полусинтетич. пенициллины, в синтезе преднизолона, для удаления лактозы из продуктов питания, используемых больными с лактазной недостаточностью, в изготовлении ферментных электродов для экспресс-определения мочевины, глюкозы и др. в-в, для создания аппаратов "искусств. почка" и "искусств. печень", для удаления эндотоксинов, образующихся в процессе заживления ран и ожогов, при лечении нек-рых онкологии, заболеваний и др. Большое значение приобрели в клинич. и лаб. практике иммуноферментные методы анализа, в к-рых также используются иммобилизованные ферменты.
ВОПРОС № 45
Ферменты обнаруживают и оценивают по двум критериям: по появлению продуктов реакции или по исчезновению субстратов. Ферменты проявляют специфичность в отношении субстратов и типа реакции.
Активность ферментов зависит от температуры, рН среды, концентрации субстрата [S] и концентрации фермента [Е].
Количественная оценка активности ферментов в биологических жидкостях (кровь, моча, слюна) широко используются в клинической практике для диагностики и дифференциальной диагностики заболеваний. Как правило, активность ферментов увеличивается при заболеваниях печени, инфаркте миокарда и других видах патологии. При диагностике болезней, связанных с врожденной недостаточностью метаболизма, определение активности ферментов становится единственным критерием болезни.
Количественная оценка активности ферментов основывается на измерении количества образовавшегося продукта реакции или убыли субстрата в единицу времени, отнесенного к 1 мг белка или 1 мл биологической жидкости.
Единицы активности
Международная единица активности (МЕ или Е или U (unit) - количество фермента, которое катализирует превращение 1 мкмоля вещества за 1 мин (мкмоль/мин):
1 мкмоль превращенного субстрата
1 МЕ = —————————————
1 мин
В системе единиц СИ – катал (кат) -количество Е, которое превращает 1 моль S за 1 секунду (1 моль/с).
Количество превращенного субстрата
п катал = ———————————————
Время (с)
Удельная активность Е -– число единиц ферментативной активности на 1 мг белка (мкмоль/мин/мг)
Количество превращенного субстрата (мкмоль)
Уд. ак = ————————————————
Время (мин) ´ масса белка (мг)
ВОПРОС № 46
Влияние pH среды. В 3 пробирки 3 раствора с разными pH (кисл, нейтр, щел). Затем слюну и крахмал. Через некое время йодом обнаруживают крахмал и исследуют зависимость активности амилазы от pH. Где нет окраски – расщепление крахмала. Для амилазы оптимум – рН=7,0.
Термолабильность. 2 пробирки с крахмалом. В одну – обычную слюну, в другую – прокипяченную 3 минуты (инактивированную). Проверяем окрашиванием йодом.
Специфичность. Вдве пробирки (№1 и №2) вносят раствора крахмала, в две другие (№3 и №4) - раствора сахарозы. Затем в пробирки №1 И №3 добавляют раствора слюны, а в пробирки №2 и №4-такое же количество раствора сахаразы. Перемешивают и оставляют в термостате или на водяной бане 15 минут при температуре 37°С. После этого с содержимым всех четырех пробирок проделывают реакции с йодом и Троммера. № 1 - нет окрашивания (разложение крахмала). № 2 – синее окрашивание. № 3 – нет окрашивания (сахароза не разложилась). № 4 – гидрат закисис меди желтого цвета.
