Химическая связь и строение молекул
Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. По характеру распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать межмолекулярные взаимодействия: водородная связь и (или) вандерваальсовые силы.
Основными характеристиками химической связи являются:
1. Энергия химической связи ЕА – В , кДж/моль – это мера прочности связи, которая определяется работой, необходимой для разрушения данной связи, или энергией, которая выделяется при образовании связи из отдельных атомов. Чем больше ЕА – В, тем прочнее (устойчивее) частица.
Для молекул типа А2 (например, Н2 или N2) энергия связи равна энергии, которая затрачивается на распад 1 моль молекул типа А2 до атомарного состояния. Для многоатомных молекул типа АВn (например, СН4 или NH3) принято говорит о средней энергии связи 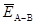 , которая может быть определена по формуле
, которая может быть определена по формуле
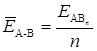
 (15)
(15)
где 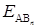 - энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
- энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
Для расчета энергии одной связи необходимо 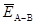 (в кДж/моль) разделить на постоянную Авогадро NА.
(в кДж/моль) разделить на постоянную Авогадро NА.
Разрыв связи в молекуле может быть осуществлен:
1) гомолитически, то есть с образованием атомов АВ ® А + В
2) гетеролитически, то есть с образованием ионов АВ ® Аz+ + Bz-.
При изменении энергий связей в рядах однотипных соединений можно отметить следующие закономерности:
- чем больше разность между электроотрицательностями (DЭО) элементов, тем больше энергия связи между их атомами (правило Полинга);
- чем больше размеры атомов, тем меньше энергия связи;
- энергия связи в кристалле всегда больше, чем в соответствующей молекуле;
- энергия диссоциации по гомолитическому механизму ниже, чем по гетеролитическому.
2. Длина связи lА-В, нм – это расстояние между ядрами химически связанных атомов. Эта характеристика зависит от размеров электронных оболочек и степени их перекрывания. Между длиной связи и ее энергией имеется определенная корреляция: чем меньше длина связи, тем больше энергия связи.
3. Угол связи или валентный угол – это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов,. Его определяют с учетом гибридизации центрального атома в молекуле.
Ковалентная связь (КС) – тип связи, который возникает при обобществлении электронов взаимодействующих атомов. Для описания такого вида связи используют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания АО;
3. КС тем прочнее, чем больше область АО.
КС может возникнуть:
1. По обменному механизму за счет объединения одноэлектронных АО внешнего энергетического уровня по одному со стороны каждого атома:
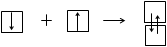
Число одноэлектронных АО может увеличиваться при переходе атома в возбужденное состояние;
2. По донорно-акцепторному механизму за счет объединения пары электронов одного атома (донора) и свободной АО другого атома (акцептора):

Основными свойствами КС являются насыщаемость, направленность и полярность. Общее число КС, которое способен образовать атом, ограничено числом его АО (свободных и занятых), использование которых энергетически выгодно. Для элементов первого и второго периодов энергетически выгодно использование АО только внешнего энергетического уровня. Начиная с третьего и далее периодов кроме s– и p–орбиталей внешнего уровня в образовании КС могут участвовать d–орбитали внешнего и предвнешнего энергетических уровней. Таким образом, максимальное число КС у каждого атома ограничено его валентными возможностями, то есть связь насыщаема.
Для обеспечения наиболее полного перекрывания электронных облаков взаимодействующие атомы вынуждены располагаться в пространстве относительно друг друга определенным образом – направленно. По типу перекрывания (направленности) различают:
1. s-связь – перекрывание АО происходит вдоль оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению только одной области перекрывания. К образованию такого вида связи способны электронные облака любой формы. Например, sр-р перекрывание образуется таким образом:

2. p-связь – перекрывание АО происходит по обе стороны от оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению двух областей перекрывания. Например, pр-р перекрывание:

К образованию такого вида связи не способны s-электронные облака;
3. d-связь – перекрывание двух d-орбиталей, находящихся в параллельных плоскостях, с образованием четырех областей перекрывания.
Возникновение p- и d-связей происходит только в том случае, когда взаимодействующие атомы уже связаны s-связью. Наложение p- и d-связей на s-связь приводит к повышению кратности связи (иначе порядка связи n), то естькуменьшению межъядерного расстояния.
Например, в молекуле N2 между атомами азота связь тройная (NºN) – одна s 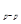 и две p
и две p  .
.
Направленность КС придает многоатомным частицам определенную форму – конфигурацию, от которой с учетом гибридизации АО зависит внутренняя структура вещества.
Гибридизацией АО называют процесс смешения нескольких различных по форме и энергии АО данного атома, который сопровождается образованием такого же числа новых, одинаковых по форме и энергии гибридных АО, располагающихся в пространстве относительно друг друга таким образом, чтобы обеспечить более полное перекрывание с АО соседних атомов в частице.
В процессе гибридизации могут участвовать как одноэлектронные АО, так и АО занятые спаренными электронами. Одноэлектронные гибридные АО способны образовать связи с другими атомами и определяют тем самым геометрическую форму молекулы или иона, поэтому их называют связывающими. Двухэлектронные гибридные АО обычно не участвуют в образовании связей (исключение – донорно-акцепторный механизм), называются несвязывающими (при записи формулы молекулы их обозначают Ё) и не учитываются при выявлении геометрической формы образовавшейся частицы. В табл.5 приведены наиболее распространенные виды гибридизаций АО и формы молекул, которые им соответствуют.
Таблица 5
