Влияние поляризации ионов на свойства веществ
Представления о поляризации ионов помогают объяснить различия в свойствах многих однотипных веществ. Например, сравнение хлоридов натрия и калия с хлоридом серебра показывает, что при близких ионных радиусах поляризуемость катиона Ag+, имеющего 18-рси меньшей растворимости хлорида серебра в воде.
Взаимная поляризация ионов облегчает разрушение кристаллов, что приводит к понижению температур плавления веществ. По этой причине температура плавления TlF (327 oС) существенно ниже, чем RbF (798 oC). Температура разложения веществ также понижатся с усилением взаимной поляризации ионов. Поэтому иодиды обычно разлагаются при более низких температурах, чем остальные галогениды, а соединения лития - термически менее устойчивы, чем соединения других щелочных элементов.
Деформируемость электронных оболочек сказывается и на оптических свойствах веществ. Чем более поляризована частица, тем ниже энергия электронных переходов. Если поляризация мала, возбуждение электронов требует более высокой энергии, что отвечает ультрафиолетовой части спектра. Такие вещества обычно бесцветны. В случае сильной поляризации ионов возбуждение электронов происходит при поглощении электромагнитного излучения видимой области спектра. Поэтому некоторые вещества, образованные бесцветными ионами, окрашены.
19. Типы кристаллических решеток. Антизотропия. Полиморфизм.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле .Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами.. Большинство кристаллических органических соединений имеют молекулярную решетку.
Анизотропи́я (от др.-греч. ἄνισος — неравный и τρόπος — направление) — неодинаковость свойств среды (например, физических: упругости, электропроводности, теплопроводности,показателя преломления, скорости звука или света и др.) по различным направлениям внутри этой среды; в противоположность изотропии.
В отношении одних свойств среда может быть изотропна, а в отношении других — анизотропна; степень анизотропии также может различаться.
Частный случай анизотропии — ортотропия (от др.-греч. ὀρθός — прямой и τρόπος — направление) — неодинаковость свойств среды по взаимно перпендикулярным направлениям.
Примеры
Анизотропия является характерным свойством кристаллических тел (точнее — лишь тех, кристаллическая решетка которых не обладает высшей — кубической симметрией). При этом свойство анизотропии в простейшем виде проявляется только у монокристаллов. У поликристаллов анизотропия тела в целом (макроскопически) может не проявляться вследствие беспорядочной ориентировки микрокристаллов, или даже не проявляется, за исключением случаев специальных условий кристаллизации, специальной обработки и т. п.
Причиной анизотропности кристаллов является то, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния (а также некоторые не связанные с ними прямо величины, например, поляризуемость или электропроводность) оказываются неодинаковыми по различным направлениям. Причиной анизотропии молекулярного кристалла может быть также асимметрия его молекул. Макроскопически эта неодинаковость проявляется, как правило, лишь если кристаллическая структура не слишком симметрична.
Помимо кристаллов, естественная анизотропия — характерная особенность многих материалов биологического происхождения, например, деревянных брусков.
Анизотропия свойственна жидким кристаллам, движущимся жидкостям (неньютоновским — особенно).
Анизотропией особого рода в масштабах всего кристалла или его областей обладают ферромагнетики и сегнетоэлектрики.
Во многих случаях анизотропия может быть следствием внешнего воздействия (например, механической деформации, воздействия электрического или магнитного поля и т.д.). В ряде случаев анизотропия среды может в какой-то степени (а в некоторой слабой степени — часто) сохраняться после исчезновения вызвавшего ее внешнего воздействия.
ПОЛИМОРФИЗМ (от греч. polymorphos-многообразный), способность твердых в-в и жидких кристаллов существовать в двух или неск. формах с разл. кристаллич. структурой и св-вами при одном и том же хим. составе. Такие формы наз. полиморфными модификациями. Взаимные превращения полиморфных модификаций наз. полиморфными переходами. Полиморфизм простых в-в принято называть аллотропией, но понятие полиморфизма не относят к некристаллич. аллотропным формам (таким, как газообразные О2 и О3). Полиморфизм широко распространен в самых разнообразных классах в-в. Типичный пример полиморфных форм - модификации углерода: алмаз и лонсдейлит, в к-рых атомы объединены ковалентными связямив пространств. каркас; графит, в структуре к-рого имеются слои наиб. прочно связанных атомов; карбин, построенный из бесконечных линейных цепочек. Эти модификации резко различаются по св-вам. В случае молекулярных кристаллов (в частности, орг. в-в) полиморфизм проявляется в разл. упаковке молекул, имеющих одинаковую структурную ф-лу; здесь переход от одной модификации к другой осуществляется без разрываковалентных связей, но конформация молекул может существенно меняться (конформационный полиморфизм)
20. Аморфное состояние вещества
. АМО́РФНОЕ СОСТОЯ́НИЕ, твердое конденсированное состояние вещества, характеризующееся изотропиейфизических свойств, обусловленной неупорядоченным расположением атомов и молекул. Кроме изотропии свойств (механических, тепловых, электрических, оптических и т. д.) для аморфного состояния вещества характерно наличие температурного интервала, в котором аморфное вещество при повышении температуры переходит в жидкое состояние. Этот процесс происходит постепенно: при нагревании аморфные вещества в отличие от кристаллических, сначала размягчаются, затем начинают растекаться и, наконец, становятся жидкими, т. е. аморфные вещества плавятся в широком интервале температур.
Изотропия свойств характерна и для поликристаллического состояния (см.Поликристаллы), но поликристаллы имеют строго определенную температуру плавления, что позволяет отличать поликристаллическое состояние от аморфного.
В аморфных веществах, в отличие от кристаллических, отсутствует дальний порядок в расположении частиц вещества, но присутствует ближний порядок, соблюдаемый на расстояниях, соизмеримых с размерами частиц. Поэтому аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул.
Структурное отличие аморфного вещества от кристаллического обнаруживается с помощью рентгенограмм. Монохроматические рентгеновские лучи, рассеиваясь на кристаллах, образуют дифракционную картину в виде отчетливых линий или пятен (см.Дифракция рентгеновских лучей). Для аморфного состояния это не характерно.
В отличие от кристаллического состояния, аморфное состояние вещества не является равновесным. Оно возникает в результате кинетических факторов и со структурной точки зрения эквивалентно жидкому состоянию: аморфное вещество представляет собой переохлажденную жидкость, обладающую очень большой вязкостью. Обычно аморфное состояние образуется при быстром охлаждении расплава, когда не успевает пройти кристаллизация вещества. Такой процесс характерен для получения стекол, поэтому аморфное состояние часто называют стеклообразным состоянием. Однако чаще всего даже самое быстрое охлаждение недостаточно быстро для того, чтобы помешать образованию кристаллов. В результате этого большинство веществ получить в аморфном состоянии невозможно.
Самопроизвольный процесс перестройки аморфного вещества в равновесную кристаллическую структуру за счет диффузионных тепловых смещений атомов практически бесконечен. Но иногда такие процессы можно достаточно легко осуществить. Например, аморфное стекло после выдержки при определенной температуре «расстекловывается», т.е. в нем появляются мелкие кристаллики и стекло мутнеет.
В природе аморфное состояние менее распространено, чем кристаллическое. В аморфном состоянии находятся: опал, обсидиан, янтарь, смолы природные, битумы. В аморфном состоянии могут находиться не только вещества, состоящие из отдельных атомов и обычных молекул, такие, как стекла неорганические и жидкости (низкомолекулярные соединения), но и вещества, состоящие из длинноцепочечных макромолекул — высокомолекулярные соединения, или полимеры (см. аморфные полимеры). Физические свойства аморфных веществ сильно отличаются от кристаллических, благодаря чему они нашли широкое применение в промышленности (см. аморфные и стеклообразные полупроводниковые материалы, аморфные магнетики,аморфные металлы).
ФУНКЦИИ состояния
Внутренняя энергия является функцией состояния системы. Она обозначается буквой U. Абсолютное значение внутренней энергии системы не поддается экспериментальному определению. Однако на практике можно измерить изменение внутренней энергии системы.
Существуют два основных способа передачи энергии системе или от нее - передача теплоты и выполнение работы.
22. Условия самопроизвольного протекания реакции
По мере накопления сведений были обнаружены реакции, которые протекают самопроизвольно и сопровождаются тем не менее поглощением энергии извне (понижается температура реакционной системы). К таким физико-химическим процессам относится растворение нитратов в воде, например нитрата калия.
Понять возможные причины таких процессов помогли следующие наблюдения. Если добавить каплю чернил в стакан с водой, постепенно вся вода окрасится в цвет чернил. Если в комнате не наводить порядок, то наступит хаотический беспорядок. Разобрать какую-нибудь вещь на составные части, например механические часы, куда проще, чем собрать.
Таких примеров можно привести тысячи. Все они демонстрируют стремление систем (система – часть материального мира, являющаяся предметом наблюдения, исследования) к беспорядку, при условии их изолированности. Под изолированной понимают систему, полностью отделенную от своего окружения. Между изолированной системой и окружением не происходит никакого обмена ни веществом, ни энергией. На практике изолированная система практически недостижима. При поступлении в систему вещества либо энергии извне в ней можно навести порядок.
Мерой беспорядка служит физическая величина – энтропияS: чем выше значение энтропии, тем больше беспорядка, и чем оно ниже, тем больше порядка.
Перемешанные чернила можно удалить из раствора добавлением активированного угля. Порядок в комнате можно навести, приложив усилия. Часы можно отремонтировать, пригласив часового мастера.
Все изложенные выше наблюдения могут помочь сформулировать (в одном из многочисленных эквивалентных вариантов) второй закон термодинамики: в изолированной системе самопроизвольно протекающие процессы увеличивают энтропию системы.(На основании второго закона термодинамики возникла теория тепловой смерти Вселенной.)
Следствие из второго закона термодинамики – высокая степень упорядоченности в системе возможна при поступлении энергии и вещества из-за пределов системы.
Третий закон термодинамики устанавливает, что энтропия физической системы при стремлении температуры к абсолютному нулю не зависит от параметров системы и остается неизменной. (В формулировке М.Планка энтропия S = 0 при T = 0 К.)
Для самопроизвольного протекания реакции требуется, с одной стороны, уменьшение суммы энтальпий: если сумма энтальпий образования продуктов меньше суммы энтальпий образования реагентов, т.е.  Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным (
Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным (  S > 0).
S > 0).
Энергия Гиббса
Возможно несколько вариантов изменения сумм энтальпий образования и энтропий веществ в ходе процесса.
1.  Н < 0,
Н < 0,  S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
2.  Н > 0,
Н > 0,  S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
3.  Н < 0,
Н < 0,  S < 0. Уменьшение
S < 0. Уменьшение  Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение
Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение  S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
4.  Н > 0,
Н > 0,  S > 0. Увеличение
S > 0. Увеличение  Н не способствует самопроизвольному протеканию реакции, однако возрастание
Н не способствует самопроизвольному протеканию реакции, однако возрастание  S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
Роль арбитра, определяющего возможность самопроизвольного протекания реакции при постоянном давлении, играет энергия Гиббса:
 G =
G =  Н – T
Н – T  S,
S,
где T – абсолютная температура, К.
При  G < 0 реакция может протекать самопроизвольно, а при
G < 0 реакция может протекать самопроизвольно, а при  G > 0 реакция термодинамически запрещена. Если
G > 0 реакция термодинамически запрещена. Если  G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
Самопроизвольное протекание эндотермической реакции возможно лишь тогда, когда она сопровождается значительным увеличением энтропии. Примером такого процесса является взаимодействие гексагидрата дихлорида кобальта с хлористым тионилом, сопровождающееся ярко выраженным эндотермическим эффектом (  Н = +400 кДж/моль, наблюдается обледенение). Уравнение реакции
Н = +400 кДж/моль, наблюдается обледенение). Уравнение реакции
СоСl2•6Н2О + 6SOCl2 = CoCl2 + 6SO2 + 12HCl
вскрывает причину протекания такого сильно эндотермического процесса: на 1 моль прореагировавшего кристаллогидрата образуется 18 моль (!) газообразных веществ.
Возможность или невозможность протекания реакции устанавливают с помощью уравнения Гиббса следующими способами.
1. Для температуры 25 °С на основе табличных данных рассчитывают  G0 по соотношению:
G0 по соотношению:
 G0 =
G0 =  Н0– 298
Н0– 298  S0.
S0.
2. Для температуры, отличающейся от 25 °С, расчет проводят по соотношению:
 G =
G =  G0 + RTlnKр.
G0 + RTlnKр.
Kр при данной температуре можно найти, преобразовав выражение для равновесия
 G = 0
G = 0 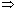
 G0 + RTlnKр = 0
G0 + RTlnKр = 0
к виду:
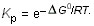
Это соотношение позволяет получить значение константы равновесия при любой температуре.
3. Для окислительно-восстановительных реакций выражение для энергии Гиббса при стандартных условиях принимает следующий вид:
 G0 = –nF
G0 = –nF 
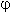 0,
0,
где n – количество передаваемых электронов, F – постоянная Фарадея ( 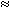 96 500 Кл/моль),
96 500 Кл/моль),

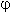 0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
4. Из условия равновесия реакции (  G = 0) имеем:
G = 0) имеем:
0 =  Н – T
Н – T  S.
S.
Отсюда Т =  Н/
Н/  S – температура, при которой реакция находится в состоянии равновесия.
S – температура, при которой реакция находится в состоянии равновесия.
Термодинамические расчеты позволяют оценить, например, возможность восстановления водородом некоторых элементов из их оксидов (табл. 6.2).
Таблица 6.2
