Завдання 3. Визначення вмісту оцтової кислоти в оцеті
1.Підготовка до роботи скляного електроду і настроювання приладу за буферними розчинами – див. Завдання 1.
2.Встановлення точної концентрації робочого розчину натрію гідроксиду – див. Завдання 2.
3.У мірну колбу місткістю 100 см3 вносять піпеткою 10 см3 досліджуваного оцету, розбавляють дистильованою водою до мітки і добре перемішують. Після цього 10 см3 розчину піпеткою переносять в стакан для титрування і проводять титрування, як описано в Завданні 2.
Вміст оцтової кислоти (в г/100 см3), розраховують за формулою:
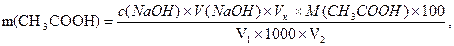
де V1 – об’єм розбавленого розчину оцету, взятого для титрування, см3;
V2 - об’єм досліджуваного розчину оцету, взятого для титрування, см3.
Завдання 4. Визначення вмісту HCl і CH3COOH у суміші
Порядок визначення – див. Завдання 2.
При титруванні суміші кислот (HCl і CH3COOH) розчином натрію гідроксиду отримують криву титрування з двома скачками титрування: перший скачок в області 2,5-3,5 рН – відповідає відтитруванню більш сильної хлоридної кислоти HCl, другий – в області 8-10 рН – відповідає відтитруванню ацетатної кислоти CH3COOH.
Вміст кожної кислоти у розчині розраховують за формулами:
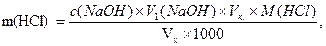
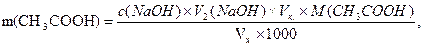
де V1 і V2– середній об’єм розчину натрію гідроксиду, що пішов на титрування відповідно HCl і CH3COOH, см3;
Vx - об’єм досліджуваного розчину, взятого для титрування, см3.
ЛІТЕРАТУРA
1.Аналітична хімія: Навчальний посібник/ О.М.Гайдукевич, В.В.Болотов, Ю.В.Сич та ін. –Х.: Основа, Видавництво НФАУ, 2000. –432 с.
2.Пономарев В.Д. Аналитическая химия: В двух ч. –М.: Высшая школа, 1982. –Ч.1. –304 с; Ч.2. –303 с.
3.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
4.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Общие теоретические основы. Качественный анализ. М.: Высшая школа, 2001. –604 с.
5.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Количественный анализ. Физико-химические методы анализа -М.: Высшая школа, 2001. –645 с.
6.Конспект лекцій.
7.Основы аналитической химии: В 2-х кн. Учеб. для вузов/ Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. –М.: Высшая школа, 1996. –Кн.1. –383 с.; Кн.2. –461 с.
8.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия: В 2-х кн. –М.: Химия, 1990. –Кн.1. –480 с.; Кн.2. –460 с.
9.Лурье Ю.Ю. Справочник по аналитической химии. –М.: Химия, 1989. –447 с.
10.Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа. –М.: Высшая школа, 1991. –256с.
11.Скуг Д., Уэст Д. Основы аналитической химии: В 2-х кн. –М.: Мир, 1979. –Кн.1. –480 с.; Кн.2. –430 с.
12.Васильев В.П. Аналитическая химия: В 2-х кн. –М.: Высшая школа, 1989. –Кн.1. –319 с.; Кн.2. –383 с.
13.Державна Фармакопея України. –1-е вид. –Харків: РІРЕГ, 2001. –Доповнення 1. -2004. -520 с.
14.Кількісний аналіз. Титриметричні методи аналізу / В.В.Петренко, Л.М.Стрілець, С.О.Васюк – Запоріжжя, 2006. -215 с.
ЗАНЯТТЯ №36
ТЕМА: Електрохімічні методи аналізу. Кондуктометричний метод кількісного аналізу. Визначення вмісту сульфатної та ацетатної кислот в суміші. Контроль засвоєння змістових модулів 7-8.
АКТУАЛЬНІСТЬ:Кондуктометричний аналіз характеризується високою чутливістю, селективністю, експресністю, об’єктивністю, можливістю автоматизації і комп’ютеризації процесу. Все це зумовлює використання даного методу в аналітичній та фармацевтичній практиці.
НАВЧАЛЬНІ ЦІЛІ: Сформувати теоретичні та практичні знання по визначенню концентрації та ідентифікації речовин за допомогою методу кондуктометрії, вміння застосовувати його в кількісному аналізі.
ЗНАТИ: -техніку виконання операцій в методі кондуктометрії;
-розрахунки процентного вмісту досліджуваної речовини за
результатами аналізу;
-загальну характеристику та класифікацію кондуктометричних
методів аналізу;
-правила кондуктометричного титрування;
-теоретичні основи кондуктометрії;
-одиниці вимірювання провідності;
-методику кондуктометричних визначень;
-приклади визначень кондуктометричним методом.
ВМІТИ:-проводити і обгрунтовувати вибір речовин для конкретного випадку
кондуктометричного визначення;
-розраховувати значення концентрації речовин за допомогою
методу кондуктометрії;
-кількісно визначати речовини, які застосовуються у фармації,
методом кондуктометрії;
-визначати чистоту і тотожність лікарських препаратів;
-розв’язувати задачі на визначення вмісту речовин в розчинах за
допомогою кондуктометричного методу;
-розраховувати значення питомої та еквівалентної електричної
провідності;
-використовувати методи прямої кондуктометрії,
низькочастотного та високочастотного кондуктометричного
титрування для визначення фізичних та хімічних характеристик
речовин;
-робити висновки з результатів аналізу і оформляти їх у
вигляді протоколу.
