Кислоты и основания льюиса
Дж. Льюисом была предложена более общая теория кислот и оснований. Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.). Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3).
Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду - способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь.
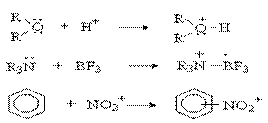
Кислотно-основное взаимодействие по Льюису - доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса:
Единой шкалы для сравнения силы кислот и оснований Льюиса не существует, так как их относительная сила будет зависеть от того, какое вещество взято за стандарт (для кислот и оснований Бренстеда таким стандартом является вода). Для оценки легкости протекания кислотно-основного взаимодействия по Льюису Р. Пирсоном была предложена качественная теория «жестких» и «мягких» кислот и оснований (табл. 4.1).
Табл. 4.1
Жесткие и мягкие кислоты и основания
| Жесткие | Промежуточные | Мягкие |
| Кислоты | ||
| H+, Na+, K+, Mg2+, Ca2+, Al3+, Fe3+, BF3, AlCl3, RC+=O | Cu2+, Fe2+, Zn2+, R3C+ | Ag+, Hg2+, I2 |
| Основания | ||
| H2O, OH-, F-, ROH, RO-, R2O, NH3, RNH2 | ArNH2, Br-, C5H5N | R2S, RSH, RS-, I-, H-, C2H4, C6H6 |
Жесткие основания обладают высокой электроотрицательностью и низкой поляризуемостью. Они трудно окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют низкую энергию.
Мягкие основания имеют низкую электроотрицательность и высокую поляризуемость. Они легко окисляются. Их высшие занятые молекулярные орбитали (ВЗМО) имеют высокую энергию.
Жесткие кислоты имеют высокую электроотрицательность и низкую поляризуемость. Они трудно восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют низкую энергию.
Мягкие кислоты обладают низкой электроотрицательностью и высокой поляризуемостью. Они легко восстанавливаются. Их низшие свободные молекулярные орбитали (НСМО) имеют высокую энергию.
Самая жесткая кислота - Н+, самая мягкая – СН3Hg+. Наиболее жесткие основания – F- и OH-, наиболее мягкие – I- и Н-.
Принцип жестких и мягких кислот и оснований Пирсона (принцип ЖМКО): жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями. Это выражается в больших скоростях реакций и в образовании более устойчивых соединений, так как взаимодействие между близкими по энергии орбиталями эффективнее, чем взаимодействие между орбиталями, значительно различающимися по энергии.
Принцип ЖМКО используют для определения преимущественного направления конкурирующих процессов (реакции элиминирования и нуклеофильного замещения, реакции с участием амбидентных нуклеофилов); для направленного создания детоксикантов и лекарственных препаратов.
