Ышқылдар мен негіздердің протолиттік теориясы. Автопротолиз
Қышқылдар мен негіздердің классикалық ұғымы швед химигі Ааррениус ұсынған электролиттік диссоциация теориясына негізделген. Бұл теория бойынша қышқылдар құрамында сутегі бар заттар, диссоциацияланғанда сутегі ионы мен аниондарға ыдырайды.
HA↔ Н+ + А-
Ал негіздер құрамында гидроксил топшасы бар заттар, суда ерігенде гидроксил ионы мен катиондарға ыдырайды.
BOH↔В+ +ОН-
Аррениус теориясының негізгі кемшілігі – диссоциациялану процесіне еріткішің әсерінің ескерілмеуі. Бұл теория сусыз ертінділерге қолданылмайды.
1923 жылы Бренстед және Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Бұл теория бойынша протонды бөліп шығаратын заттар қышқылдар қатарына жатады, протонды қосып алатын заттар – негіздер. Сонымен негіз мынадай реакцияға қатысады:
Қышқыл ↔ негіз +протон
А ↔ В + Н+
Әр қышқылға сәйкес негіз пайда болады. Бір протолиттік жүйеге сәйкес қышқыл мен негізді қосарласқан жұп дейді. Мысалы:
А↔ В + Н +
НСІ↔ СІ – +Н+
Н2 SО4↔ НSО4-+Н+ (5.1)
НSО4-↔ ↔ SО42- +Н+
Н3 РО4 ↔ Н2 РО4-+Н+
Н2РО4-↔ НРО42-+Н+
NН4+ ↔ NН3 +Н+
АІ(Н2О)63+ ↔ АІ(ОН)(Н2О)52+ + Н+
Қышқыл деген ұғым НСІ, Н2SО4 сияқты бейтарап молекулалардан басқа зарядталған НSО4-, NН4+ бөлшектерге де қатысты. Сондықтан қышқылдар бейтарап, анионды және катионды болып бөлінеді. Өзін қышқыл және негіз түрінде көрсететін бөлшектер де болады, олар – амфолиттер.
Реалды жағдайда қышқылды-негіздік реакция екі қосарласқан жұптың арасында жүреді. Жұптың біреуі протонды береді (донор), ал екіншісі оны қосып алады (акцептор). Хлорлы сутегінің судағы ертіндісінде:
НСІ↔ СІ- +Н+
Н+ +Н2О ↔ Н3О
НСІ +Н2О ↔ Н3О++СІ- (5.2)
Бұл жағдайда НСІ протонның доноры (қышқыл), ал Н2О протонның акцепторы (негіз).
Аммиактың судағы ертіндісінде жүретін реакция:
Н2О ↔ ОН- +Н+
Н++ NН3 ↔ NН4+
Н2О+ NН3 ↔ NН4++ОН- (5.3)
Бұл жағдайда протонның доноры су (қышқыл), ал оның акцепторы NН3 (негіз).
Сол сияқты (5.1) теңдіктері:
Н2 SО4 + Н2О ↔ НSО4- + Н3О+
Н SО4- +Н2О ↔ SО42- +Н3О+ (5.4)
Н3РО4+Н2О↔ Н2РО4- +Н3О+
Н2РО4- + Н2О↔ НРО42-+ Н3О+
NН4+ + Н2О↔ NН3 +Н3О+
АІ(Н2О)63++ Н2О↔[АІ(ОН)( Н2О)5]2++ Н3О+
(5.2), (5.4) реакцияларда судың молекуласы протонның акцепторы ролін атқарып тұр, сондықтан ол негіздік қасиет көрсетеді. (5.3) және мына реакцияларда:
Н2О + СО32- ↔НСО3- +ОН-
Н2О + Н2РО4-↔Н3РО4+ОН-
Н2О + +СН3СОО- ↔ СН3СООН + ОН- (5.5)
судың молекуласы протонның доноры болғандықтан қышқылдық қасиет көрсетіп тұр.
Келтірілген мысалдарда Н2РО4- қышқылдық және негіздік қасиет көсетеді:
Н2РО4- + Н2О↔ НРО42-+ Н3О+
Н2О + Н2РО4-↔ Н3РО4+ОН-
Мұндай заттар амфолиттер деп аталады.
Протолиттік теорияның маңызды жетістігіне еріткіштің қышқылды-негіздік тепе-теңдіккке тигізетін әсерін ескеруі жатады. Жалпы түрде қышқыл мен негіздің диссоциациялануын былай жазуға болады:
НА +НSоlv↔ Н2Sоlv++А-, немесе А- + НSоlv ↔ НА +Sоlv-
Протонның бір заттан екінші затқа ауысуы газ түріндегі және қатты фазаларда да жүреді.
Қышқылдық та, негіздік те қасиет көрсететін еріткіштерді амфипротты, не амфипротонды еріткіштер дейді. Мысалы, таза суда мынадай протолиттік реакция жүреді:
Н2О + Н2О ↔ Н3О+ + ОН- (5.6)
Протонның бірдей бөлшектердің арасында бірінен біріне ауысуын автопротолиздену, не қышқылды – негіздік диспропорциялану процесі деп атайды. Таза суда Н3О+ және ОН- иондарының концентрациялары бірдей. Судың концентрациясы тұрақты болғандықтан (55.3 моль/л) (5.6) реакциясының тепе – теңдік константасы:
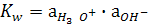 (5.7)
(5.7)
Бұл константаны автопротолиздану, не судың иондық көбейтіндісі (КW) дейді. Автопротолиздену тепе-теңдігі солға қарай ығысқандықтан Н3О+, ОН- иондарының активтіктері аз. Сондықтан тәжрибеде бұл мәндердің теріс логарифмін пайдаланған ыңғайлы:
-lg КW= p КW ; -lg 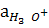 = pH; -lgaОН-= pОН
= pH; -lgaОН-= pОН
(5.7) теңдігі былай жазылады:
pКW = pH + pОН (5.8)
(5.6) автопротолиздану реакциясы жүргенде бірдей мөлшерде Н3О+ және ОН- иондары пайда болады. Сондықтан ортаның бейтараптығы осы екі иондардың активтіктерінің теңдігімен анықталады:
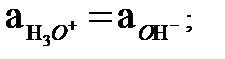 pH = pOH =
pH = pOH =  pКW
pКW
Егер гидроксоний ионының активтігі гидроксил ионның активтігінен көп болса орта қышқылдық болады:
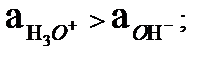 pH < pОH
pH < pОH
Керісінше гидроксил ионның активтігі гидроксоний ионның активтігінен көп болса орта негіздік (сілтілік) болады :
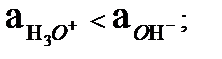 pH > pОH
pH > pОH
КW мәні температураға байланысты:
| Температура, 0С | |||||
| p КW | 14,92 | 14,0 | 13,26 | 12,60 | 12,26 |
25 0С-та КW =1,10-14
Таза суда және сұйытылған сулы ертінділерде активтікті концентрациямен ауыстыруға болады:
КW =[ Н3О+].[ОН -] (моль2/л2)
Қарапайым түрінде: КW =[ Н+].[ОН -]
[ Н+] = [ОН-] = 10 -7 ; -lg КW= -lg [ Н+] +(-lg [ОН-])
pКW = pH+рОН = 14 – автопротолиз константасының көрсеткіші.
Амфипротты еріткіштерге (Hsolv) сәйкес автопротолиздану реакциясының жалпы түрі:
НSolv+ Hsolv ↔ H2solv+ + Solv-
Автопротолиз реакциясында ерткіштің бір молекуласы қышқыл, екінші молекуласы негіз рөлін атқарады. Сондықтан Hsolv- Solv- және Hsolv- H2solv+ әрқайсы қосарласқан қышқылды негіздік жұп құрайды. H2solv+иондарын лионий иондары, ал Solv- лиат иондары дейді. Автопротолиз константасы лионий және лиат иондарының активтіктерінің көбейтіндісіне тең:
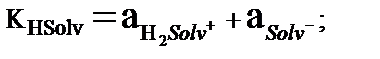
Автопротолиз константасы еріткіштің өте маңызды термодинамикалық сипаттамасы. Автопротолиз көрсеткіші pКHsolv = – lg KHsolv тікелей еріткіштің қышқылдық шкаласының кеңдігін көрсетеді. Егер қышқылдық аралығын
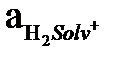 =I-ден
=I-ден 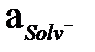 =I дейін алсақ, рН мәндерінің аралығы 0-ден pK Hsolv дейін болады, яғни бұл аралық суға 14,00 тең, метанолға 17,31 –ге тең, сірке қышқылына 12,22-ге тең, т.б.
=I дейін алсақ, рН мәндерінің аралығы 0-ден pK Hsolv дейін болады, яғни бұл аралық суға 14,00 тең, метанолға 17,31 –ге тең, сірке қышқылына 12,22-ге тең, т.б.
