Участие рецепторов в трансмембранной передаче сигнала
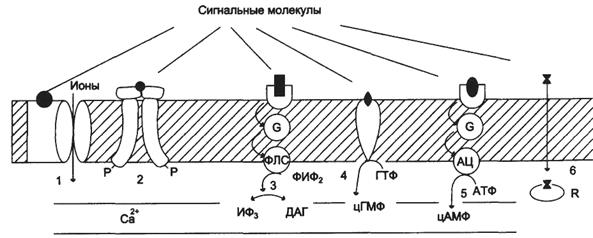 |
1). Рецепторы, связанные с ионными каналами (рецептор ГАМК);
2). Рецепторы, с тирозинкиназной активностью (рецептор инсулина);
3). Рецепторы, активирующие инозитолтрифосфатную систему (α1-адренорецептор - у гепатоцитов);
4). Рецепторы, с гуанилатциклазной активностью (гуанилатциклаза, рецептор ПНФ);
5). Рецепторы, активирующие аденилатциклазную систему (β-адренорецепторы);
6). Рецепторы, связывающие гормон в цитозоле или ядре (рецептор кортизола).
По механизму передачи сигнала рецепторы делятся на 4 типа:
1). Рецепторы, связанные с ионными каналами.Это интегральные мембранные белки, состоящие из нескольких субъединиц, полипептидная цепь которых несколько раз пересекает клеточную мембрану. Они имеют центр связывания сигнальной молекулы и ионный канал. При связывании с сигнальными молекулами у этих рецепторов открываются или закрываются ионные каналы. Действуют они очень быстро в течениемиллисекунд.
Эти рецепторы обеспечиваю синаптическую передачу в электрически возбудимых клетках. Например, катионные ацетилхолиновые никотиновые рецепторы скелетных мышц.
2). Рецепторы, с ферментативной активностью. Имеют разнообразное строение, регулируют клеточное деление, дифференцировку, развитие иммунного ответа.
Рецепторы с ферментативной активностью бывают 3 видов:
а). Рецепторы, с тирозинкиназной активностью (тирозиновые протеинкиназы). Это каталитические рецепторы, фосфорилирующие по тирозину белки-мишени. Их активируют инсулин, макрофагный колониестимулирующий фактор, тромбоцитарный производный фактор роста.
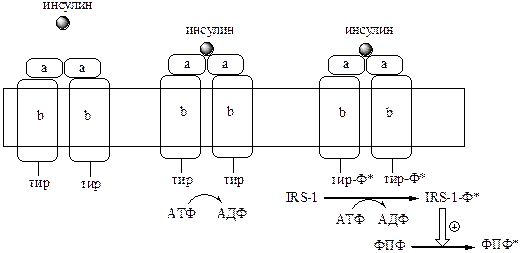
Например, мембранный рецептор инсулина, он является гликопротеином, который состоит из 2 α и 2 β субъединиц связанных дисульфидными связями. α субъединицы связывают инсулин, а β субъединицы обладают тирозинкиназной активностью. После присоединения гормона к α субъединицам, β субъединицы сначала фосфорилируют друг друга, а затем белок IRS-1 (insulin receptor substrate), который активирует функциональные ферменты (фосфопротеинфосфатаза). ФПФ в свою очередь дефосфорилирует и инактивирует инсулиновый рецептор.
б). Рецепторы, с фосфатазной активностью (тирозиновые протеинфосфотазы). Это каталитические рецепторы, дефосфорилирующие по тирозину белки-мишени (например, ФПФ).
в). Рецепторы с гуанилатциклазной активностью (гуанилатциклазы ГЦ).Это каталитические рецепторы, превращающие ГТФ в цГМФ, есть в сердце, легких, почках, надпочечниках, эндотелии кишечника, сетчатке и т.д.
Эти рецепторы находятся на мембране и в цитоплазме:
Мембранная ГЦ – гликопротеин (180кДа), имеет 3 домена: внеклеточный рецепорный, трансмембранный и внутриклеточный каталитический. Активируется предсердным натрийуретическим фактором (АНФ), термостабильным токсином грамотрицательных бактерий, эндотелийпроизводным фактором, ацетилхолином+Са2+, серотонином, гистамином и т.д. Существует 3 вида.
Цитоплазматическая ГЦ состоит из α и β субъединиц и содержит гем, активируется оксидом азота NO (а также Н2О2, О2, жирными кислотами и продуктами ПОЛ).
3). Рецепторы, сопряженные с G-белками (GPCRот англ. G – protein coupled receptor), по строению их еще называют серпантинными.
| Это мономерные интегральные мембранные белки, полипептидная цепь которых 7 раз пронизывает клеточную мембрану. Внеклеточный домен GPCR обеспечивает взаимодействие с гормоном, а внутриклеточный - контакт с G-белками. В настоящее время открыто более 200 видов GPCR. К GPCR относятся: α и β рецепторы. К GPCR присоединяются: адреналин (рецепторы α1 и α2, β1 и β2), ацетилхолин (рецепторы М1, М2, М3, М4), серотонин (1А, 1В, 1С, 2), дофамин (Д1 и Д2), АКТГ, ТТГ, ФСГ, ЛГ, хорионический гонадотропин, простагландины, гастрин, холецистокинин, нейропептид Y, нейромедин К, вазопрессин, ангиотензин, вещество К, вещество Р, или нейрокинин 1, 2 и 3 типа, тромбин, интерлейкин-8, глюкагон, кальцитонин, секретин, соматолиберин, ВИП, гипофизарный аденилатциклазактивирующий пептид, глютамат (MG1 – MG7), аденин. | 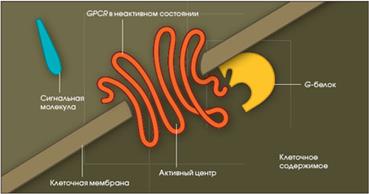 |
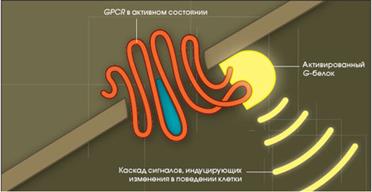 |
GPCR через G-белки активируют аденилатциклазную и инозитолтрифосфатную системы. GPCR инактивируются:
1. путем ухода сигнальной молекулы из активного центра рецептора;
2. путем фосфорилирования рецепторов протеинкиназами и последующего присоединения специального белка (например, β-аррестин);
GPCR участвуют почти во всех жизненно важных процессах, протекающих в организме: они поддерживают работу сердца, органов пищеварения и дыхания, мозговую деятельность.
Примерно половина современных лекарств взаимодействуют с GPCR.
4). Ядерные и цитоплазматические рецепторы. Находятся в цитоплазме или ядре, при взаимодействии с гормоном, образуют комплекс, который присоединяется к регуляторной нуклеотидной последовательности в ДНК, изменяет доступность промотора для РНК-полимеразы, соответственно меняет скорость транскрипции мРНК и трансляции новых ферментов.
Ядерные и цитоплазматические рецепторы содержат ДНК-связывающий домен, характеризующийся наличием двух структур «цинковых пальцев». Особенностью цитоплазматических рецепторов является связь с белком-шапероном, который стабилизирует их структуру.
Разные клетки организма, в зависимости от функций, имеют определенный набор рецепторов. На мембране одной клетки может быть более десятка разных типов рецепторов.
Регуляторные белки
G-белки - универсальные посредники, передающие сигнал от рецепторов к ферментам клеточных мембран.
В настоящее время известно более 50 G-белков:
· Gs-белок активирует аденилатциклазу. Масса 80000-90000Да.
· Gi-белок ингибирует аденилатциклазу. Масса 80000-90000Да. Через рецептор, активируется соматостатином.
· Gq-белок активирует фосфолипазу С.
· G-белки влияют на активность фосфодиэстеразы, фосфолипазы А2, некоторые типы Са2+- и K+-каналов.
· G-белки также обеспечивают передачу сигнала в сенсорных клетках (фоторецепторных, обонятельных и вкусовых): Свет → родопсин → Gt → ФДЭцГМФ → (цГМФ→ГМФ)
G-белки олигомеры, состоят из 3 субъединиц α, β, γ.
β-субъединицы (35000 Да) у Gs- и Gi-белков одинаковы.
α- субъединицы (41000 Да у Gi, 45000 Да у Gs) кодируются разными генами и обеспечивают специфический ответ (“+” или “-”).
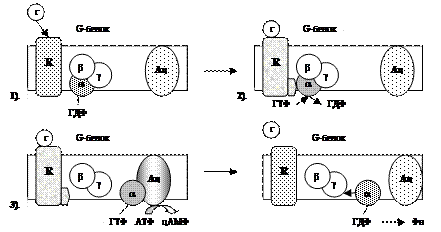 | 1). Гормон (Г), взаимодействуя с рецептором (R), изменяет его конформацию. 2). Гормон-рецепторный комплекс, взаимодействуя с G-белком, уменьшает у α-субъединицы (α) сродство к ГДФ и увеличивает сродство к ГТФ. 3). Присоединение ГТФ к α-субъединице (в присутствии Mg2+) вызывает в G-белке изменение конформации и диссоциацию его на субъединицы: α-субъединицу (α-ГТФ) и димер βγ. α-ГТФ имеет высокое сродство к аденилатциклазе (Ац), его присоединение приводит к активации последней. 4). α-субъединица катализирует распад ГТФ до ГДФ + Фн. α-ГДФ имеет низкое сродство к Ац и высокое к димеру βγ. Отделение α-ГДФ от Ац инактивирует последнюю. |
STATбелки.
