Окисление органических соединений.
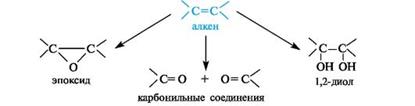
Окисление двойных углерод-углеродных связей в зависимости от условий может приводить к эпоксидам, 1,2-диолам (гликолям) или карбонильным соединениям - продуктам расщепления двойной связи.
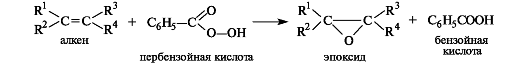
Эпоксиды образуются при обработке алкенов пероксидными соеди- нениями, например пербензойной кислотой.
1,2-Диолы (гликоли) могут быть получены в результате гидролиза эпоксидов в кислой или щелочной среде.
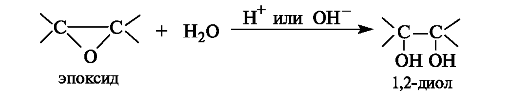
Непосредственно из алкенов 1,2-диолы образуются под действием водного раствора перманганата калия на холоду (реакция Вагнера).
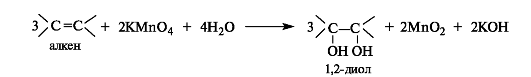
Внешние проявления реакции - исчезновение пурпурной окраски перманганата калия и образование коричневого осадка оксида марганца(IV). Эту реакцию можно использовать как качественную для обнаружения алкенов, а также для их отличия от спиртов, поскольку спирты в таких условиях не окисляются.
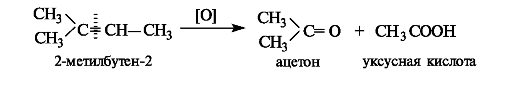
В более жестких условиях расщепляется углерод-углеродная связь и образуются кетоны и/или карбоновые кислоты.
Спирты(первичные и вторичные) по сравнению с углеводородами окисляются в значительно более мягких условиях. Альдегид, образующийся при этом из первичного спирта, легко окисляется далее в карбоновую кислоту.
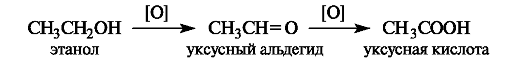
Особым случаем окисления является дегидрирование, когда субстрат теряет два атома водорода, что эквивалентно потере двух протонов и двух электронов (2Н+ и 2е-) или протона и гидрид-иона (Н и Н ).
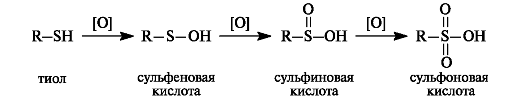
Тиолыпри окислении образуют ряд продуктов последовательного окисления - сульфеновые, сульфиновые и сульфоновыекислоты. В этом состоит их отличие от спиртов, у которых окислению подвергается атом углерода.
Использование мягких окислителей (пероксид водорода, кислород воздуха) приводит к образованию дисульфидов. Реакция окисления тиолов и обратный ей процесс восстановления имеют важное значение в биологических системах.
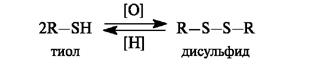
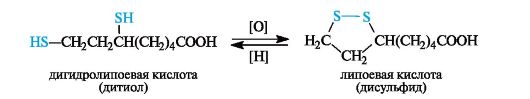
Примером дисульфида, участвующего в биохимическом окислении, может служить липоевая кислота,имеющая в составе пятичленное кольцо с дисульфидной группировкой. Восстановленная форма - дигидролипоевая кислота- представляет собой дитиол.
Сульфиды,как и тиолы, окисляются достаточно легко. Первичными продуктами окисления являются сульфоксиды, которые далее могут быть окислены в сульфоны.
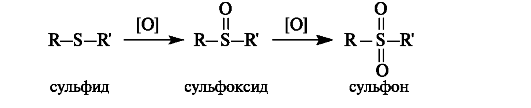
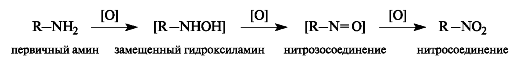
Аминылегко окисляются; конечными продуктами при окислении первичных аминов RNH2 являются нитросоединения RNO2.На промежуточных стадиях образуются замещенный гидроксиламин RNHOH и нитрозосоединение RN=O.
Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.
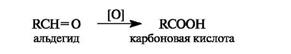
Оксид серебра в виде аммиачного комплекса [Ag(NH3]2OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название - реакция «серебряного зеркала».
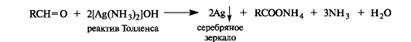
Так же легко альдегиды окисляются гидроксидом меди(II) в щелочной среде.
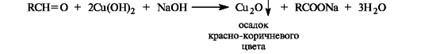
Обе эти реакции часто используют как качественные для обнаружения альдегидной группы, хотя они неспецифичны по отношению к альдегидам: окислению указанными реагентами подвергаются, например, многоатомные фенолы, аминофенолы, ароматические амины, гидроксикетоны и другие легкоокисляющиеся соединения.
Окислительно-восстановительные реакции.Реакции этого типа свойственны двухатомным фенолам с орто- и пара-положением гидроксильных групп в бензольном кольце. Среди продуктов окисления таких двухатомных фенолов особый интерес представляют хиноны.
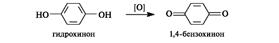
Хиноны содержат своеобразную систему сопряженных связей, называемую хиноидной группировкой, включающую две двойные связи в цикле и двойные связи двух карбонильных групп.
1,2-Бензохинон(о-бензохинон) и 1,4-бензохинон(п-бензохинон) - простейшие представители хинонов, образующиеся при окислении пирокатехина и гидрохинона соответственно. Наиболее важны 1,4-хиноны, обычно называемые просто хинонами.
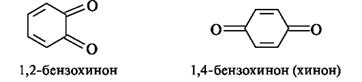
Окисление гидрохинона в хинон in vivo происходит с участием пероксида водорода под действием фермента.
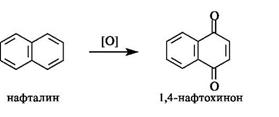
При окислении нафталина образуется 1,4-нафтохинон,являющийся структурным фрагментом витаминов группы K (см. 15.4).
Хиноны - сильные окислители. Принимая два электрона и два протона, они восстанавливаются в соответствующие гидрохиноны.

Окислительно-восстановительная система хинон-гидрохинон играет важную роль в организме. По отношению к большинству органических субстратов эта система выступает в роли окислителя.
С химической точки зрения производными 1,4-бензохинона являются убихиноны,называемые еще коферментом Q. Функционирование убихинонов в организме основано на их способности легко и обратимо превращаться в восстановленные формы (см. 15.4).
Структурный фрагмент о-хинона содержится в составе окисленной формы флавоноидов. Пирокатехиновая группировка в структуре
таких важных биологически активных веществ, как флавоноиды, обусловливает их способность к участию в окислительно-восстано- вительных реакциях в организме (см. 15.5).
Реакции окисления используют для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча, кровь).
В молекуле моносахарида окислению может подвергаться любой атом углерода, но легче всего окисляется альдегидная группа альдоз в открытой форме.
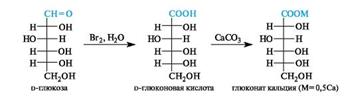
Мягкими окислителями (бромная вода) можно окислить альдегидную группу в карбоксильную, не затрагивая других групп. При
этом образуются альдоновые кислоты. Так, при окислении d-глюкозы бромной водой получается d-глюконовая кислота. В медицине используется ее кальциевая соль - глюконат кальция.
Действие более сильных окислителей, таких, как азотная кислота, перманганат калия, и даже ионов Cu2+ или Ag+ приводит к глубокому распаду моносахаридов с разрывом углерод-углеродных связей. Углеродная цепь сохраняется только в отдельных случаях, например при окислении d-глюкозы в d-глюкаровую кислоту или d-галактозы в галактаровую (слизевую) кислоту.

Получающаяся галактаровая кислота трудно растворима в воде и выпадает в осадок, что используется для обнаружения галактозы указанным методом.
Альдозы легко окисляются комплексными соединениями меди(11) и серебра - соответственно реактивами Фелинга и Толленса (см. также 5.5). Такие реакции возможны в связи с присутствием альдегидной (открытой) формы в таутомерной смеси.
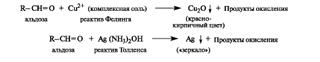
Благодаря способности восстанавливать ионы Cu2+ или Ag+ моносахариды и их производные, содержащие потенциальную альдегидную группу, называют восстанавливающими.
Гликозиды не проявляют восстановительной способности и не дают положительной пробы с этими реактивами. Однако кетозы способны восстанавливать катионы металлов, так как в щелочной среде они изомеризуются в альдозы.
Прямое окисление звена СН2ОН моносахаридов в карбоксильную группу невозможно из-за присутствия более склонной к окислению альдегидной группы, поэтому для превращения моносахарида в уроновую кислоту окислению подвергают моносахарид с защищенной альдегидной группой, например, в виде гликозида.
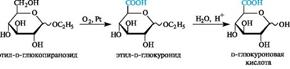
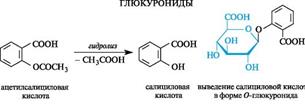
Образование гликозидов глюкуроновой кислоты - глюкуронидов- является примером биосинтетического процессаконъюгации, т. е. процесса связывания лекарственных средств или их метаболитов с биогенными веществами, а также с токсичными веществами с последующим выведением из организма с мочой.