Периодичность свойств элементов
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие, как атомный радиус, энергия ионизации, энергия сродства к электрону, электроотрицательность.
Атомный радиус. Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому введены два условных понятия атомных радиусов:
- эффективный;
- орбитальный.
Эффективный атомный радиус определяется экспериментально (из спектрографических данных) как ½ расстояния между центрами ядер двух соседних атомов в молекуле или кристалле.
Орбитальный атомный радиус – это расстояние от ядра атома до наиболее удаленного максимума электронной плотности.
 |
Атомные радиусы элементов периодически изменяются в зависимости от величины заряда ядра (рис. 2.5):
1. В периоде атомные радиусы с ростом порядкового номера уменьшаются (от щелочного металла к инертному газу). Атом Na имеет радиус 1,8 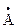 , Mg – 1,6
, Mg – 1,6 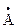 , Сl – 0,73
, Сl – 0,73 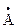 .Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая превалирует над силами взаимного отталкивания электронов.
.Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая превалирует над силами взаимного отталкивания электронов.
Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d – и f – элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. Это уменьшение называется соответственно d – и f – сжатием.
2. В пределах каждой подгруппы элементов радиусы, как правило, увеличиваются при увеличении номера периода (или Z), так как возрастает число энергетических уровней.
У элементов III группы наблюдается исключение из этого правила – радиус атома галлия Ga (1,22 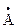 ) меньше радиуса атома алюминия Al (1,26
) меньше радиуса атома алюминия Al (1,26 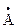 ). Причина кроется в том, что в 4-м периоде между s – и p – элементами расположены десять d – элементов, поэтому свойства галлия не укладываются в ряд B – Al – Ga, зато для триады B – Al – Sс атомные радиусы возрастают в соответствии с общим правилом, хотя B и Al p – элементы, а Sc d – элемент. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах s – и p – элементов больше такового в подгруппах d – элементов, например в V группе1:
). Причина кроется в том, что в 4-м периоде между s – и p – элементами расположены десять d – элементов, поэтому свойства галлия не укладываются в ряд B – Al – Ga, зато для триады B – Al – Sс атомные радиусы возрастают в соответствии с общим правилом, хотя B и Al p – элементы, а Sc d – элемент. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах s – и p – элементов больше такового в подгруппах d – элементов, например в V группе1:
p – элементы d - элементы
Z r, нм Z r, нм
As……….33 0,148 V…………23 0,134
Sb……….51 0,161 Nb……….41 0,145
Bi………..83 0,182 Ta……….73 0,146
Как видно, в подгруппе мышьяка при переходе от As к Bi атомный радиус увеличивается на 0,034 нм, а в подгруппе ванадия при переходе от V к Ta – всего на 0,012 нм.
Существенно подчеркнуть еще одну особенность для подгрупп d – элементов. Увеличение атомных радиусов в подгруппах d – элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы d – элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f – сжатием2, вызванным заполнением 4f – подуровня у f – элементов 6-го периода. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов для d – элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Радиусы ионов отличаются от радиусов атомов, т. к. они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов.
Энергия ионизации. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией ионизации I1:
 .
.
В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в кДж/моль, либо в эВ/атом (1эВ = 1,6∙10-19 Дж).
Энергия ионизации характеризует восстановительную способность элемента или его металлические свойства (см. р. 9.2). Первая энергия ионизации (рис. 2.6) определяется электронным строением элементов и ее изменение имеет периодический характер:

1. В периоде слева направо первая энергия ионизации возрастает и восстановительные свойства элементов убывают. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода, что обусловлено возрастанием заряда ядра и уменьшением размеров атомов.
Наряду с резко выраженными максимумами и минимумами на кривой энергии ионизации наблюдаются слабо выраженные, что можно объяснить с помощью двух взаимосвязанных представлений: об экранировании заряда ядра и о проникновении электронов к ядру.
Эффект экранирования заряда ядра обусловлен наличием в атоме между данным электроном и ядром других электронов, которые экранируют, ослабляют воздействие на этот электрон положительного заряда ядра и тем самым ослабляют связь его с ядром. Понятно, что экранирование возрастает с увеличением внутренних электронных слоев.
Эффект проникновения электронов к ядру обусловлен тем, что, согласно квантовой механике, все электроны (даже внешние) определенное время находятся в области, близкой к ядру. Поэтому можно сказать, что внешние электроны проникают к ядру через слои внутренних электронов.
Концентрация электронной плотности у ядра (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s - электрона, меньше – для р – электрона, еще меньше для d – электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s>3p>3d.
Эффект проникновения увеличивает прочность связи внешних электронов с ядром. Этим, в частности, определяется порядок заполнения в многоэлектронных атомах s-, p-, d-, f- …орбиталей при данном n.
Можно также сделать вывод, что вследствие более глубокого проникновения s – электроны в большей степени экранируют ядро, чем р – электроны, а последние – сильнее, чем d – электроны, и т. д.
Влияние на прочность связи электронов с ядром оказывает также взаимное отталкивание электронов одного и того же уровня и в особенности одной и той же орбитали.
 |
Воспользуемся сказанным для объяснения рис. 2.6. Как видно, внутренние максимумы на кривой первой энергии ионизации соответствуют элементам, у которых внешние уровни завершены – (Be, Mg, Zn) или заполнены наполовину – p3 (N,P,As), что свидетельствует о повышенной устойчивости подобных конфигураций:
Следующий непосредственно затем минимум отвечает появлению электрона в новом, более далеком от ядра р – подуровне (B, Al, Ga), экранированном от ядра конфигурацией s2, либо взаимным отталкиванием двух электронов одной и той же р – орбитали (O, S, Se):

В соответствии с особенностями электронных структур у элементов d(f) – семейства энергии ионизации близки.
2. В главных подгруппах сверху вниз с увеличением порядкового номера первая энергия ионизации уменьшается и восстановительные свойства элементов увеличиваются, что обусловлено увеличением размеров атомов и усиливающимся (по мере увеличения числа электронных слоев) экранированием заряда ядра электронами, предшествующими внешним электронам.
3. В подгруппах d – элементов при переходе от 3d – к 5d – элементу энергии ионизации увеличиваются, что видно, например, на элементах V группы.
| р – элементы | d – элементы | ||||
| Z | I1, эВ | Z | I1, эВ | ||
| As………... | 9,82 | V……….... | 6,74 | ||
| Sb………... | 8,64 | Nb……….. | 6,88 | ||
| Bi………... | 7,29 | Ta………... | 7,89 |
Повышение энергии ионизации в подгруппах d – элементов можно объяснить эффектом проникновения электронов к ядру. Так, если у d – элементов 4-го периода 4s – электроны попадают под экран 3d – электронов, то у элементов 6-го периода 6s – электроны попадают уже под двойной экран 5d – и 4f – электронов. Отсюда при переходе от 4-го к 6-му периоду прочность связи внешних s – электронов с ядрам повышается, а поэтому и энергия ионизации d – элементов возрастает.
Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй I2, третьей I3 и более высокой энергией ионизации, поскольку можно удалить 1, 2, 3… - электрона из атома.
Энергия ионизации увеличивается в следующем порядке:I1< I2< I3<…< In , т. к. удаление электрона от электронейтрального атома происходит легче, чем от иона.
Энергия сродства к электрону(сродство к электрону). Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону E. Сродство к электрону выражается в кДж/моль или эВ/атом. Сродство к электрону характеризует окислительные или неметаллические свойства атома элемента. Принимая электроны, атом превращается в отрицательно заряженный ион по схеме:
 .
.
Надежные значения сродства к электрону найдены лишь для небольшого числа элементов. Понятно, что сродство к электрону зависит от электронной конфигурации атома, и в характере его изменения с увеличением порядкового номера элемента наблюдается отчетливо выраженная периодичность (рис. 2.7). Сравнение с изменением энергии ионизации показывает, что максимумы и минимумы на кривой сродства к электрону смещены по сравнению с кривой энергии ионизации на один элемент влево.
В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают (исключение для N и P). В подгруппах сверху вниз сродство к электрону, как правило, уменьшается.
Как следует из данных табл. 2.3 и рис. 2.7, наибольшим сродством к электрону обладают р – элементы VII группы. Наименьшее и даже отрицательное сродство к электрону имеют атомы с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar, Kr) или с наполовину заполненным р – подуровнем (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных электронных конфигураций.
Выделением энергии сопровождается присоединение одного электрона к атомам кислорода, серы, углерода и некоторым другим. Таким образом, для указанных элементов силы притяжения к ядру дополнительного электрона оказываются большими, чем силы отталкивания между дополнительным электроном и электронной оболочкой атома.

Таблица 2.3
Сродство к электрону (Е) атомов некоторых элементов
| Элемент | Е, эВ | Элемент | Е, эВ | Элемент | Е,эВ |
| H | 0,754 | N | -0,21 | Al | 0,52 |
| He | -0,22 | O | 1,467 | Cl | 3,61 |
| Li | 0,59 | F | 3,45 | K | 0,52 |
| Be | -0,19 | Ne | -0,57 | Br | 3,54 |
| B | 0,3 | Na | 0,34 | I | 3,29 |
| C | 1,27 | Mg | -0,22 |
Присоединение последующих электронов, т. е. двух, трех электронов и более к атому, согласно квантово-механическим расчетам, невозможно. Поэтому одноатомные (простые) многозарядные анионы (О2-, S2-, N3-) в свободном состоянии существовать не могут.
Электроотрицательность.Электроотрицательность (ЭО) элемента характеризует способность его атомов притягивать к себе электроны, участвующие в образовании химических связей с другими атомами в молекуле, ионе. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен), электроотрицательность атома ЭО может быть выражена как полусумма его энергии ионизации и сродства к электрону:  . Имеется около 20 шкал электроотрицательностей, в основу расчета значений которых положены разные свойства вещества. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково. В шкале относительных электроотрицательностей (ОЭО) по Полингу (рис. 2.8) электроотрицательность фтора принята равной 4,0.
. Имеется около 20 шкал электроотрицательностей, в основу расчета значений которых положены разные свойства вещества. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково. В шкале относительных электроотрицательностей (ОЭО) по Полингу (рис. 2.8) электроотрицательность фтора принята равной 4,0.

Как видно из приведенных данных, в периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падения. Наименьшими значениями электроотрицательности характеризуются s – элементы I группы, а наибольшими – р – элементы VII группы.
