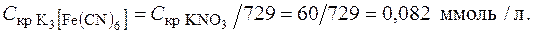Электрического слоя на границе раздела фаз
Стабилизацию дисперсных систем методом введения ПАВ или электролитов-стабилизаторов называют коллоидной защитой.
В соответствии с правилом Фаянса – Панета на поверхности коллоидных частиц происходит специфическая адсорбция (хемосорбция) ионов, находящихся в избытке, которые достраивают решетку твердой фазы или образуют с ионами решетки трудно растворимые соединения.
Процессы адсорбции сопровождаются возникновением на границе раздела фаз двойного электрического слоя (ДЭС) – тонкого поверхностного слоя из пространственно разделенных электрических зарядов противоположного знака. По аналогии с конденсатором вводится понятие внутренней обкладки ДЭС, находящейся в поверхностном слое со стороны твердой фазы, и внешней обкладки ДЭС, находящейся со стороны жидкости.
Ионы, образующие внутреннюю обкладку, вызывают возникновение межфазного потенциала и называются потенциалопределяющими. Ионы внешней обкладки называются противоионами.
Стабилизация коллоидных систем сопровождается образованием мицелл золя. Мицелла – комплекс, в состав которого входит твердая частица дисперсной фазы с окружающим ее двойным электрическим слоем (рис. 4).
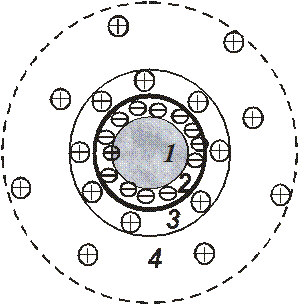
Рис. 4. Схема строения коллоидной мицеллы
На рисунке рассматривается случай избыточного содержания отрицательных ионов в момент образования мицеллы: 1 – кристаллический зародыш (совокупность частиц дисперсной фазы); 2 – ядро; образуется в результате достраивания кристаллического зародыша ионами, содержащимися в избытке в жидкой дисперсионной среде; 3 – гранула; состоит из ядра и адсорбционной части двойного электрического слоя; 4 – мицелла; состоит из гранулы и диффузионной части двойного электрического слоя.
Пример 2. Определение заряда коллоидной частицы. Золь йодида серебра AgI получен при добавлении к 0,02 л 0,001 н. раствора KI 0,028 л 0,0005 н. AgNO3. Определить заряд частиц полученного золя и написать формулу его мицеллы.
Решение. При смешивании растворов AgNO3 и KI протекает реакция
AgNO3 + KI = AgI ¯ + KNO3.
Определяем количество AgNO3 и KI, участвующих в реакции:
AgNO3: 0,005×0,028 = 1,4×10-4 ммоль;
KI: 0,02×0,01 = 2,0×10-4 ммоль.
Расчет показывает, что в растворе избыток KI, следовательно, коллоидные частицы золя йодида серебра будут адсорбировать ионы I- и приобретают отрицательный заряд. Противоионами являются ионы K+. Формула мицеллы золя йодида серебра при условии избытка KI имеет вид

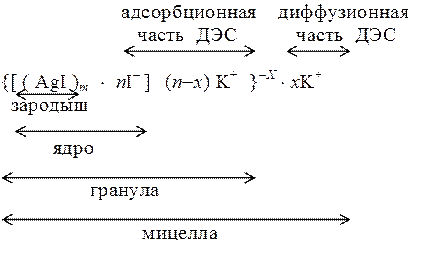
Пример 3. Определение минимального объема электролита, необходимого для получения золя. Какой объем 0,002 н. раствора BaCl2 надо добавить к 0,03 л 0,0006 н. Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария? Написать формулу мицеллы золя BaSO4.
Решение. Образование золя BaSO4 происходит по реакции
3BaCl2 + Al2(SO4)3 = ¯3 BaSO4 + 2AlCl3
Если вещества в реакции участвуют в стехиометрическом соотношении, то для реакции необходимо 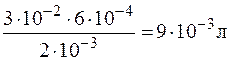 раствора BaCl2.
раствора BaCl2.
Для получения положительных частиц золя BaSO4 раствор должен содержать избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять более 0,009 л 0,002 н. раствора BaCl2. Формула мицеллы золя сульфата бария имеет вид
{(BaSO4)m ×nBa+2×(2n-x)Cl-}+X×x Cl-
В целом коллоидные растворы электронейтральны, а мицеллы представляют собой структурные единицы коллоидных систем. Наличие у коллоидных частиц (гранул) одноименных электрических зарядов приводит к их взаимному отталкиванию. Это обстоятельство препятствует возможному слипанию частиц дисперсной фазы и тем самым сообщает системе коллоидную устойчивость.
Если в системе увеличить количество электролита, то произойдет переход противоионов из диффузионной части ДЭС в адсорбционную. Это повлечет за собой уменьшение заряда гранулы. В результате взаимное отталкивание гранул ослабевает и столкновение коллоидных частиц приведет к их коагуляции и седиментации (рис. 5). Коагулирующее действие оказывают ионы электролита, знак заряда которых противоположен знаку заряда коллоидных частиц. Эти ионы называются ионами-коагулянтами, а электролит, в состав которого они входят – электролитом-коагулянтом.

Рис. 5. Схема взаимодействия двух коллоидных частиц:
А – потенциальная энергия электростатического отталкивания больше потенциальной энергии дисперсионного притяжения между частицами;
Б – потенциальная энергия электростатического отталкивания меньше потенциальной энергии дисперсионного притяжения между частицами
Минимальная эквивалентная (нормальная) концентрация электролита-коагулянта, вызывающая в системе коагуляцию, называетсяпорогом коагуляцииили критической концентрацией Скр, моль/л,
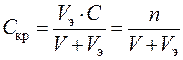 , (12.5)
, (12.5)
где V – объем коллоидной системы, л; Vэ – объем раствора электролита-коагулянта, л; С и n – соответственно эквивалентная концентрация, ммоль/л, и количество эквивалентов, моль, ионов коагулянта в объеме раствора электролита-коагулянта (Vэ).
Согласно правилу Шульце – Гарди порог коагуляции Скр обратно пропорционален шестой степени электрического заряда z ионов-коагулянтов:
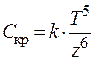 , (12.6)
, (12.6)
где T – температура системы, К; k – коэффициент, который зависит от природы дисперсной системы.
Пример 4. Вычисление порога коагуляции электролита с учетом его концентрации. В каждую из трех колб налито по 0,01 л золя хлорида серебра. Для коагуляции золя в первую колбу добавлено 0,002 л 1 н. NaNO3, во вторую – 0,012 л 0,01 н. Ca(NO3)2, в третью – 0,007 л 0,001 н. Al((NO3)3. Вычислить пороги коагуляции электролитов, определить знак заряда частиц золя.
Решение. Минимальное количество электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, рассчитаем по уравнению (12.5):
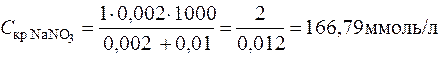 ;
;
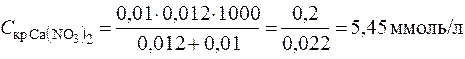 ;
;
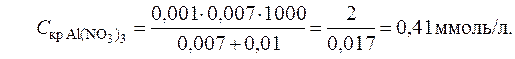
Добавляемые электролиты NaNO3, Ca(NO3)2, Al((NO3)3 содержат однозарядные анионы NO3- и катионы Na+, Ca+2, Al+3 с разной величиной заряда. Порог коагуляции зависит от заряда катиона. Наименьший порог коагуляции у Al((NO3)3. Следовательно, частицы золя хлорида серебра адсорбируют положительные ионы, т. е. заряжены отрицательно.
Пример 5.Вычисление порога коагуляции электролита с учетом заряда иона-коагулянта. Порог коагуляции раствора KNO3 для золя гидроксида алюминия, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитать порог коагуляции K3[Fe(CN)6] для этого золя.
Решение. Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. Коагулирующая способность иона определяется его зарядом. Чем больше заряд иона, тем больше его коагулирующая способность. Так как частицы золя заряжены положительно, то коагулирующими ионами будут в первом случае ионы NO3-; а во втором случае – ионы [Fe(CN)6]-3, отношение порогов коагуляции для используемых электролитов можно определить на основании уравнения (12.6):
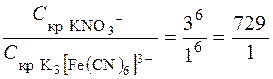 ,
,
следовательно, порог коагуляции K3[Fe(CN)6]