Влияние концентрации субстрата
При недостатке субстрата фермент не можетпроявлять свою активность полностью. Скорость ферментативной реакции возрастает с увеличением концентрации субстрата согласно уравнению Михаэлиса-Ментен. Рост концентрации субстрата в клетке может быть результатом интенсификации его синтеза, увеличения внеклеточных концентраций или действия регулируемых мембранных белков-переносчиков.
Иногда субстрат может выступать в роли аллостерического активатора фермента. В этом случае зависимость скорости ферментативной реакции от концентрации субстрата не подчиняется уравнению Михаэлиса-Ментен, а график этой зависимости представляет S-образную кривую. Примером аллостерической активации субстратом является влияние глюкозы на активность гексокиназы:
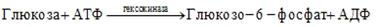
Влияние концентрации кофермента, кофакторов
Скорость ферментативной реакции прямо пропорциональна концентрации фермента. Однако, могут наблюдаться ситуации, когда ферменты не имеют возможности полностью проявлять свою активность. Например, если в организме не хватает витаминов, то не синтезируется достаточное количество коферментов, тогда даже при наличии достаточного количества молекул апофермента будет наблюдаться заниженная ферментативная активность. Такая же ситуация может иметь место при недостаточности ферментов синтеза коферментов из витаминов.
Важно помнить также, что для проявления активности многих ферментов необходимо присутствие ионов соответствующих металлов, которые выступают в роли кофакторов.
Влияние рНВ ряде ситуаций значение рН в клетке изменяется весьма существенно. Например, в мышечных клетках при физической работе происходит расщепление АТФ до АДФ (или АМФ), высвобождается фосфорная кислота и накапливается лактат. В результате накопления лактата рН понижается до 5,0, и в этих условиях фермент креатинкиназа начинает катализировать синтез АТФ, необходимого клетке в этот момент, из креатинфосфата и АДФ:
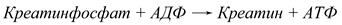
В состоянии покоя рН внутри клеток повышается до 9,0 и реакция протекает в противоположном направлении, приводя к накоплению креатинфосфата.
Изменение концентрации ингибиторов и активаторов
Иногда в клетке резко изменяются концентрации тех или иных метаболитов, которые могут выступать в роли аллостерических эффекторов. В описанном выше примере работающей мышцы в клетке накапливаются молекулы АМФ, способные аллостерически активировать фосфорилазу b, катализирующую распад гликогена. В результате в клетке ускоряются гликогенолиз и другие процессы, приводящие к синтезу новых молекул АТФ, необходимых для работы мышцы.
В качестве активаторов фермента, как было сказано выше, часто выступают молекулы субстрата.
Для многих процессов, включающих последовательные ферментативные реакции, характерным является так называемое ингибированиепо типу обратной связи или ретроингибирование,заключающееся в торможении одного из первых ферментов конечным продуктом цепи превращений. Ретроингибирование позволяет затормозить процесс в самом начале, если синтезируемый продукт имеется в достаточном количестве:
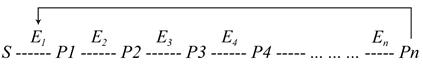
Часто такое ингибирование происходит по аллостерическому механизму. Пример ретроингибирования – синтез гема. Первую, ключевую реакцию синтеза гема катализирует фермент аминолевулинатсинтаза, аллостерическим ингибитором которого является сам гем. Скорость синтеза глобина (белковой части гемоглобина) также зависит от наличия гема: он ускоряет биосинтез белковых цепей, необходимых для проявления его биологической активности.
Изменение четвертичной структуры ферментаДля ряда ферментов, наделенных четвертичной структурой, и мультиферментных комплексов наблюдается зависимость ферментативной активности от числа субъединиц. Например, фермент люцифераза, вызывающий свечение светлячков и перспективный для использования в аналитических целях, практически неактивен в виде мономера, умеренно активен в димерной форме и наиболее активен в тетрамерном состоянии.
Химическая модификация молекул фермента
В клетке наблюдаются многочисленные случаи модификации ферментов с целью регуляции их активности. Приведем два наиболее распространенных примера.
Многие ферменты синтезируются в виде проферментов и, в случае необходимости, быстро активируются протеиназами путем частичного прицельного протеолиза (выщепления небольших пептидов из молекулы фермента) и последующего изменения третичной структуры. Для изменения активности ферментов часто используется ковалентная модификация их молекул путем фосфорилирования – образования сложных эфиров фосфорной кислоты с гидрокси-группами таких аминокислот, как серин, треонин, тирозин.

Необходимо отметить, что некоторые ферменты более активны в фосфорилированной форме (например, фосфорилаза а), а некоторые - в дефосфорилированной (например, гликогенсинтаза). Дефосфорилирование ферментов катализируют ферменты протеинфосфатазы.
Влияние компартментализации на активность ферментов.Появление активаторов, ингибиторов фермента и его субстрата внутри клетки регулируется системами транспорта веществ. Например, скорость проникновения глюкозы в клетки значительно повышается при увеличении в крови концентрации инсулина. В клетке некоторые ферменты находятся в определенных органеллах (компартментах) и пространственно отделены от тех субстратов, на которые они действуют. Например, гидролитические ферменты сосредоточены внутри лизосом, поэтому они не могут подвергать гидролитическому расщеплению цитоплазматические белки. В ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, а в цитоплазме ферменты гликолиза. Такая локализация ферментов способствует упорядоченности обменных процессов.
Некоторые ферменты способны эффективно работать только внутри определенных органелл. Например, если глюкоцереброзидаза не попадает внутрь лизосом, она не осуществляет расщепление обладающих токсическим действием глюкоцереброзидов, в результате чего они накапливаются в тканях и развивается одна из, так называемых, «болезней накопления» - болезнь Гоше.
