Це рівняння має і інші назви: (рівняння стану ідеального газу або Клапейрона-Менделеєва)
Крім параметрів стану в термодинаміці використовують величини, які називають термодинамічними функціями. До термодинамічних функцій відносяться внутрішня енергія (U), теплота (Q), механічна робота (А), ентальпія (Н), ентропія (S) та інші.
Взаємозв’язок термодинамічних характеристик систем розглядаються на основі досліджень законів термодинаміки.
Приклад 2. Сформулюйте перший закон термодинаміки. Обгрунтуйте його суть на прикладах.
Відповідь:
Досвід людства свідчить про те, що не можна побудувати машину, яка працювала б, не витрачаючи енергії. Таку уявну машину, яку марно прагнули винайти, назвали вічним двигуном (perpetuum mobile) першого роду. Це привело до важливого наукового узагальнення, у вигляді першого закону (принципа, начала) термодинаміки, який формулюють по-різному:
- вічний двигун першого роду неможливий;
- теплота, яка поглинається системою, витрачається на збільшення внутрішньої енергії і на механічну роботу, яку виконує система.
Цей закон представляє собою окремий випадок закону збереження енергії. Його використовують до процесів, які супроводжуються перетворенням теплоти під час виконання певної роботи.
Розглянемо два випадки:
Випадок перший.
Уявім циліндр з невагомим поршнем (рис. 9.1). У циліндрі міститься 1 моль газу при визначеному тиску і початковій температурі Т1. Поршень закріплено в положенні а так, що він не переміщується, тобто газ не може виконувати роботу проти зовнішнього тиску.
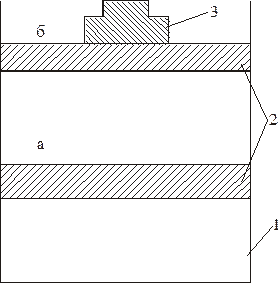
1 – циліндр з газом; 2 – невагомий поршень;
3 – вантаж, що зрівноважує тиск газу Р.
Рисунок 9.1 – Ілюстрація поняття ентальпії
Якщо підвести теплоту Qv (індекс v вказує на незмінний об’єм ), вона витрачається на підвищення температури системи до Т2, тобто на зміну її внутрішньої системи.
У першому стані внутрішня енергія має значення U1, в другому U2. Оскільки немає умов, за яких внутрішня енергія дорівнює нулю, то обчислюють не абсолютні величини, а їх зміну ∆U під час переходу із стану 1 у стан 2. Якщо зміна внутрішньої енергії є результатом підведення теплоти Qv, то це записується рівнянням :
Qv = U2-U1 = ∆U
Зростання запасу внутрішньої енергії можна оцінити за зміною температури системи, коли відомо теплоємність с її складових частин.
Теплоємність системи (речовини) – це відношення, кількості теплоти, яку система вбирає при нагріванні або віддає при охолодженні, до відповідної зміни температури. Теплоємність, віднесена до одиниці маси речовини, називається питомою, до моля – мольною.
Якщо мольна теплоємність визначається при сталому об’ємі вона називається ізохорною і позначається як Сv , якщо при сталому тискові, - ізобарною і позначається Сp .
В цьому випадку записується рівняння:
Qv=Cv(T2-T1)
де Cv - мольна теплоємність газу при сталому об’ємі;
Т1 – початкова температура системи;
Т2 – кінцева температура системи.
Випадок другий
До газу підводиться теплота, і він виконує роботу. Поршень переміщується з положення а в положення б , тоді закон збереження енергії записують так :
Qp = ∆U+A
де Qp – підведена теплота при збереженні сталого тиску в циліндрі;
А – робота, що її виконує поршень. ЇЇ можна обчислити так:
А = Р(V2-V1)
де V1 – початковий об’єм газу;
V2 – кінцевий об’єм газу.
Робота, з якою найчастіше маємо справу в хімії, зв’язана із розширенням системи. Таке розширення відбувається, наприклад, під час реакції взаємодії кальцій карбонату з хлоридною кислотою, в результаті чого виділяється газ карбон (ІV) оксид. (рис. 9.2). В цьому випадку робота (А), яка виконується системою визначається формулою:
А = - Р∆V
де Р – зовнішній тиск,
∆V – зміна об’єму системи.
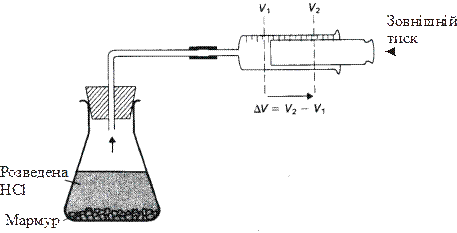
Рисунок 9.2 – Робота, що виконується хімічною системою
Для багатьох хімічних реакцій, які виконуються в лабораторних умовах, зовнішній тиск співпадає із атмосферним тиском. Знак “мінус” у наведеному рівнянні відповідає тому, що робота виконується системою, а значить, система втрачає енергію.
Зміну внутрішньої енергії системи можна визначити як різницю між кількостями підведеної теплоти і виконаної роботи. Потрібно зазначити, що теплота і робота – не види енергії, а дві форми переходу енергії від одної системи до іншої.
Рівняння можна записати так :
Qp = U2 - U1 + P(V2 - V1) = (U2 + PV2) - (U1 + PV1)
Сума (U+PV) є властивістю системи, функцією стану, яку прийнято позначати літерою Н, і називати ентальпією (від грецького слова, що означає нагріваю). Ще цю функцію називають тепловмістом.
Рівняння можна записати так: Qp = H2 - H1 = ∆H
Ентальпію можна розглядати, як енергію системи що розширюється під час нагрівання.
Отже, дослідження першого закону термодинаміки призводить до взаємозв’язку таких властивостей системи (функція стану), як ентальпія і внутрішня енергія.
Приклад 1.
Визначити зміну внутрішньої енергії при випаровуванні 25г води при 200С.
Розв’язання.
1. Припустимо, що водяна пара підлягає законам ідеального газу тоді об’ємом рідини порівняно з об’ємом газу можна знехтувати.
2. Використовуємо довідникові дані: теплота пароутворення води дорівнює 2451.8 Дж/г.
3. За рівнянням V = (mRT)/(PM)
Обчислюємо об’єм водяної пари при 200С і тискові 1 атм:
V=(25·0.082·393)/18=33,375 л
4. Робота розширення газу:
А = PV
A = 33,375 л·атм
1л·атм = 101,25 Дж
Отже,
A = 33,375·101,25 = 3378,58 Дж
5. Кількість теплоти, що вбирає система при випаровуванні 25 г води:
Qp = 2451,72·25 = 61295,6 Дж
6. Зміна внутрішньої енергії при випаровуванні води:
∆U=Qp - A
∆U = 61295.6 · 3378.5 = 57917.02 Дж
Відповідь: зміна внутрішньої енергії ∆U дорівнює
57917.02 Дж або 57,92 кДж
Приклад 3.Які процеси вивчає термохімія ? Обґрунтуйте свої судження на прикладах.
Відповідь:
Термохімія – це використання першого закону термодинаміки в хімічних процесах. Під час розробок нових технологічних процесів та проектування обладнання необхідно знати теплові ефекти хімічних реакцій. Біологи повинні також знати чи достатньо енергії, яка виділяється в результаті реакції, щоб підтримати життєздатність клітини. На ці питання дозволяють відповісти термохімічні розрахунки. Отже, термохімія вивчає теплові ефекти хімічних реакцій, тобто кількість теплоти, яка виділяється або поглинається під час хімічних реакцій.
Перш за все дамо відповідь на питання: чому хімічні реакції супроводжуються певним тепловим ефектом ?
Щоб дати відповідь на це питання, розглянемо приклад взаємодії водню із хлором :
H2 + Cl2 = 2 HCl
Для утворення двох моль хлороводню повинні розірватись хімічні зв’язки в 1 молі водню і 1 молі хлору. Порівняємо енергії хімічних зв’язків
H-H 436кДж/моль
Cl-Cl 242,3кДж/моль
H-Cl 431,4кДж/моль
Отже для розриву в молекулах хімічних зв’язків між воднем та хлором необхідно затратити:
436 + 242,3 = 678,3 кДж
Утворення хімічного зв’язку в 2 молях хлороводню супроводжується виділенням:
431,4 · 2 = 862,8 кДж
Таким чином, сумарна теплота, яка виділяється дорівнює:
862,8 - 678,3 = 184,5 кДж
Отже, теплові ефекти реакції залежать від природи речовин, тобто від їх хімічних зв’язків. Під час хімічних реакцій проходить перетворення внутрішньої енергії системи, яка завжди знаходиться в прихованій формі, в теплову.
Реакції, під час яких внутрішня енергія речовини перетворюється у теплову (тепло виділяється) називається екзотермічними.
Реакції, під час яких теплова енергія перетворюється у внутрішню енергію (тепло поглинається) називається ендотермічними.
Приклад 1.
Проведено розчинення барій хлорату Ba(ClO3)2 у воді з температурою 30оС. Який цей процес : екзотермічний чи ендотермічний ? Який знак має величина ∆Н ? Відповідь обгрунтуйте.
Розв’язання.
1. Пониження температури розчину під час розчинення солі вказує на те, що процес розчинення йде з поглинанням тепла із навколишнього середовища. Значить, цей процес ендотермічний.
2. Щоб температура цієї системи, яка складається із солі і води, залишалася 300С, до системи необхідно підвести тепло. Значить величина ΔН повинна бути позитивною.
Хімічні рівняння, в яких зазначено тепловий ефект реакцій, називаються термохімічними рівняннями.
Наприклад, рівняння екзотермічних реакцій:
CH4(г)+2O2(г) → CO2(г)+2Н2О(г)+891 кДж
Cu(т)+Cl2(г) → CuCl2(т)+223 кДж
Рівняння ендотермічних реакцій :
N2(г)+О2(г) → 2NO(г)-180,5 кДж
CO2(г)+С(г) → 2СО(г)-160 кДж
Теплові ефекти реакцій визначають здебільшого для речовин, що окиснюються під час реакцій, у кількості речовини 1 моль. Тому в термохімічних рівняннях допускаються і дробові коефіцієнти:
H2(г)+0.5O2(г) →H2O(г)+285.8 кДж
O2(г) →2/3O3(г) – 96 кДж
Якщо, в термохімічному рівнянні не використовуються дробові коефіцієнти, то кількість теплоти зазначається з розрахунку кількості моль речовини, що окиснюється. Наприклад:
2C2H2+5O2→4CO2+2H2O+2600 кДж
C2H2+2.5O2→2CO2+H2O+1300 КДж
При розрахунках теплоти утворення та теплоти згорянняречовин використання дробових коефіцієнтів обов’язкове. Наприклад:
Ca(к)+1/2 O2(г) = CaO(к) ∆Н=-635,1 кДж/моль
1/2 N2(г)+1/2 O2(г) = NO(г) ∆Н=90,4 кДж/моль
Теплотою (ентальпіею) утворення називається кількість теплоти, яка виділяється або вбирається під час утворення 1 моль речовини з простих речовин. Кількість теплоти, що виділяється або поглинається при розкладанні 1моль складної речовини називається теплотою розкладання. Наприклад
H2O(р) = H2 (г) + 1/2 O2 (г) ∆Н=285.9 кДж/моль
На практиці іноді визначають теплоти згоряння органічних речовин.Теплотою згоряння називається кількість теплоти, яка виділяється під час згоряння 1 моль речовини.
Кінцевими продуктами їх згоряння найчастіше є вода і карбон (IV) оксид, іноді сульфур (IV) оксид.
Наприклад:
C2H2+2½O2=2СO2+H2O ∆Н=-1301.5 кДж/моль
Теплота згоряння харчових продуктів у живому організмі є джерелом енергії, за рахунок якої здійснюється його життєдіяльність.
Теплотою розчинення – називають кількість теплоти, що виділяється або поглинається при розчиненні одного моля речовини в такому об’ємі розчинника, коли доливання його не спричинює зміни теплового ефекту.
Теплота розчинення залежить від природи розчинника і природи розчиненої речовини. У термохімічному відношенні процес розчинення складний. Деякі стадії цього процесу можуть бути ендотермічними і ∆Н їх додатна (руйнування структури твердих тіл, поширення молекул розчиненої речовини в об’ємі розчинника, дисоціація молекул на йони), а деякі екзотермічні і ∆Н їх від’ємне (хімічна взаємодія розчиненої речовини з розчинником).
В основному тепловий ефект розчинення твердих речовин складається з двох складових частин
∆Нрозч.= ∆Н1 + (-∆Н2)
де ∆Н1 – теплота, що витрачається на руйнування кристалічної решітки;
∆Н2 – теплота гідратації (сольватації), тобто теплота, що виділяється при хімічній взаємодії молекул розчиненої речовини з молекулами розчинника. Приклад:
а) розчинення у воді калій гідроксиду супроводжується виділенням тепла:
KOH(к)+хН2О(р)=KOH ∙ хН2О(р) ∆Нрозч.=-55,3 кДж/моль
б) під час розчинення кухонної солі у воді відбувається охолодження системи:
NaCl(к)+xH2O(р)=NaCl · xH2O(р) ∆Нрозч.=5 кДж/моль
Такі речовини використовують для одержання низьких температур у холодильній промисловості і називають кріогідратними сумішами.
Одиницею вимірювання теплового ефекту реакції є Дж/моль або кДж/моль. Кількість теплоти, що виділяється при хімічних реакціях, прямо пропорційна кількості речовини, що бере участь у хімічній реакції.
В термохімічних рівняннях хімічних реакцій тепловий ефект позначають ∆Н. У відповідності до прийнятої у термодинаміці системи знаків для екзотермічних реакцій ∆Н<0 а для ендотермічних - ∆Н>0.
Кількість теплоти, що виділяється або поглинається під час хімічних реакцій, зв’язана із змінами ентальпії та внутрішньої енергії наступними співвідношеннями:
∆Н= -Qp
∆U= -Qv
де ∆Н – зміна ентальпії; Qp – кількість теплоти, що виділяється чи поглинається при постійному тиску; Qv – кількість теплоти, що виділяється чи поглинається при постійному об’ємі; ∆U – зміна внутрішньої енергії.
Якщо реакція відбувається за стандартних умов (температура 298,15 К або 25 0С, тиск 101325 Па, концентрація усіх речовин у розчині або газі 1моль/літр), то зміну ентальпії позначають символом ∆Н0. Розглянемо термохімічне рівняння реакції водню з киснем
2Н2(г)+О2(г) =2Н2О(г) ∆Н0 = - 483кДж/моль
У дужках вказано агрегатний стан речовини, від якого залежить тепловий ефект реакції. Цей запис означає, що під час взаємодії 2 моль водню з 1 моль кисню утворюється
2 моль пари води і виділяється (за стандартних умов)
483,6 кДж теплоти.
Із збільшенням кількості реагуючих речовин тепловий ефект реакції пропорційно зростає.
Зміна ентальпії прямої і оборотньої реакцій рівна за величиною, але протилежна за знаком.
Приклад 2
Маємо хімічний процес, який описується термохімічним рівнянням
СО2(г) + 2Н2О (г) = СН4(г) +2О 2(г) ∆Н=802 кДж
Потрібно довести, що ∆Н прямої реакції + ∆Н зворотної реакції = 0
Якщо б під час згоряння СН4 виділилось більше теплоти, ніж під час взаємодії СО2 і Н2О, то можна б було одержати необмежені кількості енергії. Спалюючи деяку кількість СН4, достатньо було б лише зберегти ту частину одержаної енергії, яка необхідна для відновлення СН4, а решту використати для одержання корисної роботи. Після відновлення СН4 його можна було б знову спалити і так повторювати процес до нескінченості. Однак це вступає в протиріччя із законом збереження енергії та нашим практичним досвідом.
Зміна ентальпії реакції залежить також від агрегатного стану реагентів і продуктів. Якщо в реакції згоряння метану вода була б рідиною, а не газоподібною, то ∆Н дорівнювало б - 790 кДж замість - 802 кДж. В цьому випадку в навколишнє середовище передається більше теплоти, тому що при конденсації 2 моль газоподібної води в рідкий стан додатково виділяється ще 88 кДж:
2 Н2О(г) → 2 Н2О(р) ∆Н=-88 кДж
Приклад 3.
Під час згоряння магнію масою 6 г у кисні виділилася теплота у кількості 150 кДж. Складіть термодинамічне рівняння реакції.
1. Складаємо рівняння реакції горіння магнію у кисні
2Mg+O2=2MgO
2. Обчислюємо кількість речовини магнію, що згорів
ν(Mg) = 6г/(24г/моль) = 0,25 моль
3. Обчислюємо кількість теплоти, яка б виділилась під час згоряння двох моль магнію
∆Н = (2моль/0,25моль)·(-150 кДж) = – 1200 кДж
4. Записуємо рівняння реакції
2Mg(т) + О2 (г) = 2MgО(т) ∆Н = – 1200кДж
Приклад 4.
Горіння сірки в кисні описується термохімічним рівнянням реакції:
S(т)+О2 (г) ↔ SО2 (г) ∆Н = – 297 кДж
Визначити масу сірки та об’єм кисню за нормальних умов, якщо після їх взаємодії виділилось 891 кДж теплоти.
1. Обчислюємо кількість речовини сірки, поскільки згідно рівняння реакції 297 кДж відповідає 1 моль S та 1 моль О2:
ν(S) = ν(O2) = ((891 кДж·1 моль)/297 кДж) = 3 моль
2. Обчислюємо масу сірки і об’єм кисню:
m(S) = 32 г/моль·3 моль = 96 г
V(O2) = 22.4·3 = 67,2 л
Відповідь:маса сірки – 96 г, об’єм кисню – 67,2 л.
Приклад 4. Сформулюйте другий закон термодинаміки.
Відповідь:
Перший закон термодинаміки виражає незнищенність і еквівалентність різних форм енергії при взаємних переходах, встановлює співвідношення, які зв’язують внутрішню енергію із кількістю теплоти і виконаною роботою, тобто дозволяє скласти енергетичний баланс процесу.
Однак, перший закон не розглядає питання, які зв’язані із можливістю проходження і напрямком процесу. У навколишньому світі різні фізичні і хімічні процеси відбуваються у певному напрямі. Наприклад, теплота переходить від більш нагрітого тіла до менш нагрітого, газ поширюється у область низького тиску. Всі ці процеси відбуваються самовільно (або спонтанно), без затрат енергії ззовні, і тільки в певному напрямку. Зворотні процеси самовільно не відбуваються (газ не стискається сам по собі, теплота не може перейти від холодного тіла до більш нагрітого і т.д.). Щоб спонтанний процес відбувався оборотньо потрібна енергія ззовні . Наприклад, щоб підняти воду, яка падає з висоти і обертає турбіну, на попередній рівень, потрібно затратити енергію.
