Классификация пестицидов по степени опасности, предложенная ВОЗ
| Класс опасности | DL50 для крыс, мг/кг | |||
| При попадании ч/з рот | При попадании ч/з кожу | |||
| тв. вещества | жидкости | тв. вещества | жидкости | |
| I а | 5 или менее | 20 или менее | 10 или менее | 40 или менее |
| II б | 5 - 50 | 20 – 200 | 10 - 100 | 40 – 400 |
| II | 50 - 500 | 200- 2000 | 100 - 1000 | 400 – 4000 |
| III | более 500 | более 2000 | более 1000 | более 4000 |
Критерии токсичности используются для гигиенической классификации пестицидов и по другим признакам.
По степени кожно-резорбтивной токсичности и величине кожно-орального коэффициента, определяемого по величине отношения DL50 при накожном нанесении к величине DL50 при введении внутрь, все пестициды подразделяют на 3 группы:
- резковыраженная (DL50 < 50 мг/кг, кожно-оральный коэффициент
меньше 3).
- выраженная (DL50 от 50 до 2000 мг/кг, кожно-оральный коэффициент от 3
до 10).
- слабовыраженная (DL50 > 2000 мг/кг, кожно-оральный коэффициент > 10).
Лекция 4.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ
ТОКСИКОМЕТРИИ
План лекции
1. Методы определения параметров токсикометрии при различных путях поступления яда в организм.
2. Два способа ингаляционного воздействия ядов на животных:
- статический способ
- динамический метод.
3. Кумуляция вредных веществ. Коэффициент кумуляции. Привыкание (толерантность) к ядам.
В зависимости от цели токсикометрические исследования проводятся по-разному. Но для решения задач гигиенической регламентации методические приемы, условия проведения и оценка результатов унифицированы.
Исследование токсичности веществ начинается с изучения смертельных эффектов в острых опытах. Проникновение веществ в организм осуществляется при вдыхании, введении в желудок, нанесении на кожные покровы и слизистые оболочки.
Каждый путь поступления соединений в организм требует определенных условий.
При оценке степени токсичности при энтеральном пути поступления наиболее часто вещество вводится непосредственно в желудок с помощью металлических или пластмассовых зондов. Введение соединений проводится через 3 часа после кормления, вводимый объем не должен превышать для мышей – 1 мл, для крыс – 5 мл.
Кормление животных осуществляется через 3 часа после введения вещества. Изучаемое соединение вводится в чистом виде. Если это невозможно, то используют растворители. Обычно такие вещества вводят в водных растворах, плохо растворимые соединения – в растительном масле или в виде суспензии в 1-2-процентном растворе крахмала. Следует помнить, что острая токсичность может существенно меняться в зависимости от используемого растворителя. Поэтому используемый растворитель обязательно вводится контрольной группе животных. Поступление вредных химических веществ через дыхательные пути в производственных условиях играет ведущую роль в возникновении профессиональных заболеваний (отравлений). В лабораторных условиях используются два способа ингаляционного воздействия на лабораторных животных химическими веществами:
1. Статистический способ используется для ориентированных оценок степени токсичности летучих веществ при создании постоянной концентрации в замкнутом пространстве (специальных камерах и эксикаторах).
2. Динамический способ позволяет обеспечивать непрерывную подачу вещества в камеру, что создает условия для поддержания концентрации соединения в относительно постоянном уровне и обеспечивает необходимый воздухообмен.
Наряду с определением параметров токсикометрии смертельного уровня большое прикладное значение имеют параметры острой токсичности, как пороги вредного воздействия при неоднократном поступлении по интегральным (неспецифическим) и специфическим показателям (Limfc int и Limfc sp).
Определение порога острого действия при однократном воздействии по применению интегральных показателей проводится с использованием не менее 3-х концентраций.
Оценка функционального состояния экспериментальных животных проводится через 4 часа после затравки, а затем на 2-й, 4-й и 8-й дни опыта. При этом учитываются максимальные отклонения величины исследуемого показателя. Определение порога вредного действия по большинству специфических показателей регламентируется методическими показаниями, утвержденными Минздравом России.
Исследование местного раздражающего действия при аппликации на кожу проводится на двух видах экспериментальных животных.
Количество животных – не менее 10 особей в группе. Участок аппликации составляет для кроликов 7х9 см, для морских свинок 5х5 см. За два дня до эксперимента тщательно выстригают участки шерсти по обе стороны от позвоночника. На время эксперимента животных фиксируют. Время экспозиции – 4 часа. Исследуемое вещество наносится из расчета 20 мг/см2. Оставшееся после окончания эксперимента вещество удаляется теплой водой с мылом. Реакцию кожи регистрируют через 1 и 15 часов после однократной аппликации. Степень выраженности раздражающего действия вещества на кожные покровы определяют по классификации (11 классов): 0 – отсутствие действия; 10 – растворы вещества вызывают некроз.
Исследование местного действия вещества на слизистую оболочку глаза проводится при закапывании в конъюнктивный мешок одной капли соединения. В дальнейшем в течение двух часов наблюдают за прозрачностью роговицы и слизистой оболочки. Развитие помутнения роговицы, острое воспаление слизистой оболочки с последующим рубцеванием век свидетельствует о наличии у вещества резко выраженного раздражающего эффекта.
Для переноса результатов экспериментальных токсических опытов с животных на человека существуют правило экстраполяции: если смертельная доза для четырех типов животных (мыши, крысы, морские свинки, кролики) различаются незначительно (менее чем в три раза), то существует высокая вероятность (свыше 70 %), что для человека они будут такими же.
Существуют следующие коэффициенты пересчета:
с крысы – 5,9;
с морской свинки – 4,7;
с кролика – 3,2;
с мыши – 11,8.
В настоящее время в токсикологии принято несколько методов оценки кумуляции. С помощью метода, предложенного Каганом, животным ежедневно вводят вещество в долях от установленной DL50 (1/5, 1/10, 1/20). Данный метод позволяет прогнозировать опасность развития хронического отравления. Опыт по развернутой схеме продолжается четыре месяца.
Лекция 5
САНИТАРНО-ГИГИЕНИЧЕСКОЕ НОРМИРОВАНИЕ
ВРЕДНЫХ ВЕЩЕСТВ В БИОСРЕДАХ И ОБЪЕКТАХ
ПРОИЗВОДСТВЕННОЙ СРЕДЫ
План лекции
1. Что понимают под «Санитарно-гигиеническим нормированием» вредных веществ?
2. Основные показатели санитарной оценки вредных веществ в различных средах:
- в воздухе рабочей зоны и населенных мест: ПДКр.з., ПДКм.р., ПДКс.с.
- лимитирующий показатель вредности (ЛПВ) для водоемов;
- предельно-допустимая концентрация вредных веществ в почве.
Санитарно-гигиеническое нормирование – это деятельность по установлению нормативов предельно допустимых воздействий человека на природу. Под воздействием понимается антропогенная деятельность, связанная с экономическими, культурными и другими интересами человека и вносящая изменения в природную среду.
Предельно допустимый уровень (ПДУ) – это уровень физического воздействия (шум, тепловое, световое, радиоактивное и т.д. излучение), которое при ежедневном воздействии в течение длительного времени на организм не вызывает патологических изменений или заболеваний, а также не нарушает нормальной деятельности человека.
Предельная допустимая концентрация (ПДК) – это максимальная концентрация вещества, которая, воздействуя на человека, не вызывает у него и его потомства биологических изменений, даже скрытых и временно компенсированных, в т.ч. изменений реактивности, адаптационно-компенсаторных возможностей, иммунологических реакций, нарушений физиологических циклов, а также других нарушений.
ПДК и ПДУ устанавливают для производств и окружающей среды. При их принятии руководствуются следующими принципами:
– приоритет медицинских и биологических показаний к установлению санитарных регламентов перед прочими подходами;
– пороговость действия неблагоприятных факторов (в том числе химических соединений с мутагенным или канцерогенным эффектом действия ионизирующего излучения);
– опережение разработки и внедрение профилактических мероприятий по сравнению с появлением опасного и вредного фактора.
Для ограничения воздействия вредных веществ применяют гигиеническое нормирование их содержания в различных средах. При установленном ПДК в воздухе рабочей зоны или в воздушном бассейне населенных пунктов ориентируются на токсикологический показатель или рефлекторную реакцию организма.
В связи с тем, что требование полного отсутствия промышленных ядов в зоне дыхания работающих часто невыполнимо, особую значимость приобретает гигиеническая регламентация содержания вредных веществ в воздухе рабочей зоны. Такая регламентация осуществляется в три этапа:
1. обоснование ориентировочно безопасного уровня воздействия (ОБУВ);
2. обоснование ПДК;
3. корректировка ПДК с учетом условий труда работающих и состояния их здоровья.
ОБУВ устанавливается временно – на период, предшествующий проектированию производства. Значение ОБУВ определяется путем расчета по физическим или химическим свойствам или путем гентерполяций и экстраполяции в гомологических рядах соединений, либо по показателям острой токсичности. ОБУВ должны пересматриваться через два года после их утверждения. ОБУВ не устанавливаются:
- для веществ, опасных в плане развития отдаленных и необратимых эффектов;
- для веществ, подлежащих широкому внедрению в практику.
Для санитарной оценки воздушной среды используются следующие показатели: ПДКр.з. – ПДК вредного вещества в воздухе рабочей зоны, мг/м3. Эта концентрация не должна вызывать у работающих при ежедневном вдыхании в пределах 8 часов в течение всего рабочего стажа заболеваний или отклонений в состоянии здоровья. Рабочей зоной считается пространство высотой до 2 м над уровнем пола или площадки, на которой находятся места постоянного или временного пребывания рабочих.
До недавнего времени ПДК химических веществ оценивали как максимально разовые. Превышение их даже в течение короткого времени запрещалось. В последнее время для веществ, обладающих кумулятивными свойствами, введена вторая величина – среднесменная концентрация. Это средняя концентрация, полученная путем непрерывного или прерывного отбора проб воздуха при суммарном времени не менее 75 % продолжительности рабочей смены.
Содержание вредных веществ в атмосферном воздухе населенных пунктов также регламентируется ПДК, при этом нормируется среднесуточная и максимально разовая величина. ПДК вредных веществ в воздухе населенных мест – это максимальные концентрации, отнесенные к определенному периоду осреднения (30 мин, 24 часа, 1 месяц, 1 год) и не оказывающие ни регламентированной вероятности их проявления, ни прямого, ни косвенно вредного воздействия на организм человека, включая отдаленные последствия для настоящего и последующего поколений, не снижающие работоспособность человека и не ухудшающие его самочувствия.
Для атмосферного воздуха ПДК ниже, чем для рабочей зоны.
Максимальная (разовая) концентрация ПДКМР – наиболее высокая из числа 30-минутных концентраций, зарегистрированных в данной точке за определенный период времени.
Среднесуточная концентрация ПДКСС – средняя из числа концентраций, выявленных в течение суток или отбираемых непрерывно в течение 24 ч.
Нормирование качества воды рек, озер и водохранилищ проводят в соответствии с «Санитарными правилами и нормами охраны поверхностных вод от загрязнений». При этом рассматриваются водоемы двух категорий: первая – хозяйственно-питьевого и культурно-бытового назначения, вторая – рыбно-хозяйственного назначения.
Лимитирующий признак вредности (ЛПВ) – признак вредного действия веществ, который характеризуется наименьшей пороговой концентрацией.
ЛПВ для водоемов хозяйственно-питьевого и культурно-бытового назначения используют трех видов: санитарно-токсикологический, общесанитарный и органолептический; для водоемов рыбохозяйственного назначения – еще два вида ЛПВ: токсикологический и рыбохозяйственный.
Санитарное состояние водоема отвечает требованиям норм при выполнении следующего соотношения:
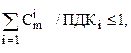
где Сim – концентрация вещества первого ЛПВ в расчетном створе водоема.
Нормирование химического загрязнения почв осуществляется по предельно-допустимым концентрациям (ПДКn).
ПДКn – концентрация вещества (мг/кг) в пахотном слое почвы, которая не должна оказывать прямого или косвенного отрицательного влияния на соприкасающиеся с почвой среду и здоровье человека, а также на самоочищающую способность почвы.
По своей величине ПДКП значительно отличается от принятых допустимых концентраций для воды и воздуха.
Различают четыре разновидности ПДКП в зависимости от пути миграции веществ в сопредельные среды: ТВ – транслокационный показатель, характеризующий переход химического вещества из почвы через корневую систему в зеленую массу и плоды растений; МА – миграционный воздушный показатель, характеризующий переход химического вещества в атмосферу; МВ – миграционный водный показатель, характеризующий переход химического вещества из почвы в подземные грунтовые воды и водные источники; С – общесанитарный показатель, характеризующий влияние химического вещества на самоочищающую способность почвы и микробиоценоз.
В случае применения новых химических соединений, для которых отсутствуют ПДКП, рассчитывают временные допустимые концентрации:
ВДКП = 1,23 + 0,48 lg ПДКПр.
ПДКПр – ПДК для продуктов питания (овощных и плодовых культур), мг/кг.
Лекция 6.
СПЕЦИФИКА, ПРИЧИНЫ И МЕХАНИЗМ ТОКСИЧЕСКОГО ДЕЙСТВИЯ
План лекции
1. Понятие «химическая травма» организма.
2. Основные периоды отравления: период резорбции и период элиминации.
3. Теория рецепторов токсичности.
Взаимодействие между токсичными веществами и живыми организмами имеет два аспекта:
- действие токсичных веществ на организм – токсикодинамическая фаза;
- ответная реакция организма на токсичные вещества (это происходит во времени с разной скоростью) – токсикокинетическая фаза.
Понятие «химическая травма»
Острые отравления целесообразно рассматривать как химическую травму, развивающуюся вследствие введения в организм токсической дозы чужеродного химического вещества. Последствия, связанные со специфическим воздействием на организм токсического вещества, относятся к токсикогенному эффекту химической травмы. Он носит характер патогенной реакции и наиболее ярко проявляется в ранней стадии острых отравлений – токсикогенной, когда токсический агент находится в организме в дозе, способной оказывать специфическое действие. Одновременно могут включаться патологические процессы, лишенные «химической» специфичности.
Таким образом, общий токсический эффект является результатом специфического токсического действия и неспецифических реакций организма.
В токсикогенной фазе отравления выделяют два основных периода: период резорбции, продолжающийся до момента достижения максимальной концентрации токсичного вещества в крови, и период элиминации, от окончания момента резорбции до полного очищения крови от яда.
С точки зрения токсикодинамики специфическая симптоматика отравлений, отражающих «избирательную токсичность» ядов, наиболее ярко проявляется в токсикогенной фазе, особенно в период резорбции. Для последнего характерно формирование тяжело протекающих патологических синдромов острых отравлений, таких как экзотоксический шок, токсическая кома, асфиксия и др. В соматогенной фазе обычно развиваются патологические синдромы, лишенные выраженной токсической специфичности. Они трактуются как осложнения острых отравлений – это пневмония, острая почечная недостаточность, сепсис и др. Фазы и периоды отравлений представлены на схеме 2.
Фазы и периоды отравлений
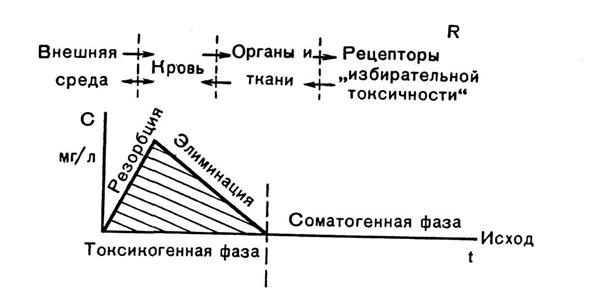
Схема 2. Основные факторы, определяющие развитие острого отравления.
R – пространственный, С – концентрационный, t – временной.
Теория рецепторов токсичности
Представление о рецепторе как месте конкретного приложения и реализации токсичного действия яда до настоящего времени остается недостаточно ясным, несмотря на то, что эта идея была выдвинута Дж. Ленгли более ста двадцати лет назад.
Рецепторы (от лат. «rezeptiо» – принимать) – это органы или устройства, принимающие из внешней или внутренней среды организма и передающие их в центральную нервную систему. В токсикологическом понимании термин «рецептор» был предложен в начале 20-го века немецким ученым Эрлихом. Это получило научное обоснование после количественных исследований А. Кларка (1937 г.), показавшего, что между чужеродными веществами и их рецепторами возникает связь, по-видимому, аналогичная взаимодействию субстрата со специфическим ферментом.
Ферменты.Помимо тканевых белков в организме есть особые, специфические белки, называемые ферментами. Такие белки являются биологическими катализаторами, способными в очень высокой степени направлять, ускорять или замедлять химические процессы в организме и тем самым оказывать решающее влияние на жизненные процессы.
Ни один процесс в организме не обходится без ферментов. Они
расщепляют сложные вещества пищевых продуктов на более простые и
синтезируют из простых веществ необходимые для организма сложные
соединения; участвуют в химических превращениях, обеспечивающих
организм энергией; регулируют деятельность нервной системы и многое,
многое другое. В живом организме имеется свыше тысячи различных
ферментов.
Характерной особенностью ферментов является специфичность их действия; каждому типу химических превращений соответствует свой наиболее активный вид фермента. Некоторые ферменты имеют широкий диапазон действия, область действия других ограничена активным участием в каком-нибудь одном превращении. Например, очень важную роль в деятельности нервной системы играет особое вещество – ацетилхолин. Оказалось, что это вещество образуется только при помощи фермента холинацетилазы, а разрушение ацетилхолина происходит при обязательном участии фермента холинэстеразы.
Несмотря на столь важное значение ферментов для деятельности организма, количественное содержание каждого из них чрезвычайно мало по сравнению с количеством белков, входящих в состав тканей. Естественно, что только благодаря очень высокой производительности этих небольших количеств ферментов обеспечивается нормальное существование живых организмов. Фермент пепсин, к примеру, за 1,5-2 ч. в мягких условиях организма расщепляет яичный белок, чего нельзя достигнуть без фермента за такой короткий срок даже при помощи самых активных химических реагентов; известно также, что одна молекула холинэстеразы за 1 сек. расщепляет примерно 10000 молекул ацетилхолина.
В живом организме деятельность всех ферментов строго согласована и координирована, тем самым обеспечивается существование белковых тел и непрерывный обмен с окружающей средой; нарушение нормальной деятельности ферментов приводит к заболеванию или гибели организма.
В состав любого фермента входит белок, обычно связанный с разнообразными соединениями небелкового характера – коферментами, которые придают всему ферменту высокую каталитическую и специфическую активность. В качестве коферментов могут быть некоторые биологически активные вещества (витамины, гормоны и др.), а также соединения различных металлов.
Каждый фермент имеет определенный объем и определенную поверхность, образованную полипептидными цепями белка. Рельеф поверхности фермента может иметь самые причудливые очертания, определяемые первичной, вторичной и третичной структурами белка, а также функциональными группами аминокислот. В химическом отношении эта поверхность неоднородна и на ней обычно имеется только небольшой участок, так называемый активный центр, ответственный за деятельность фермента. Все химические превращения в организме протекают на поверхности фермента, причем решающее значение имеет активный центр.
Очевидно, что специфическое действие фермента, выступающего при этом в качестве реагента, только на вполне определенные вещества (субстраты) и на вполне определенный тип химических превращений связано с более или менее полным соответствием структуры активного центра фермента со структурой субстрата. Чем больше соответствуют эти структуры друг другу, тем ближе подходит субстрат к ферменту; при полном соответствии структур субстрат входит в фермент, как ключ в замок. При этом происходит активация субстрата, вследствие чего он легко подвергается химическим превращениям, быстро освобождая поверхность фермента.
На приведенном ниже рисунке изображена схема действия фермента
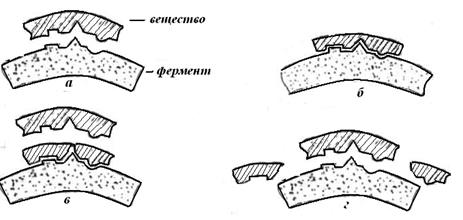
Рис.1. Схема взаимодействия фермента с веществом:
а - вещество и фермент удалены друг от друга; б - вещество подошло к ферменту; в - расщепление вещества на ферменте; г - остатки вещества при соответствии его структуры структуре субстрата.
Из этого рисунка можно уяснить и один из возможных вариантов нарушения деятельности ферментов. Например, какой-то другой субстрат, с другими свойствами, но обладающий сходной структурой, может присоединиться к ферменту таким образом, что частично или полностью закроет его активный центр и тем самым нарушит или совсем прекратит деятельность фермента (см. рисунок ниже). При этом "ложный" субстрат не подвергается никаким химическим превращениям и в то же время препятствует взаимодействию фермента с его естественным субстратом.
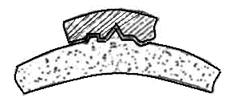
Рис. Блокировка фермента токсичным веществом
Вещество закрыло активную часть фермента, расщепление вещества не происходит.
Вещества, нарушающие нормальную деятельность ферментов, т.е. обладающие антиферментной активностью, называются ингибиторами.
Помимо такого, можно сказать, геометрического подобия структур фермента и субстрата существенное значение имеет и химическое строение активного центра. Высокая реакционная способность активного центра фермента, очевидно, связана с наличием в его структуре тех или иных функциональных группировок, принадлежащих аминокислотам полипептидной цепи, т.е. группировкам ОН, SН, NH2 ,СООН и т.д. При этом решающее значение имеет активация этих группировок, обусловленная влиянием соседних атомных групп и строением всего фермента в целом.
Как видно из приведенных примеров, большинство реакционноспособных группировок, входящих в активные центры ферментов, являются нуклеофильными. Поэтому такие группировки, а, следовательно, и ферменты в целом наиболее легко будут вступать в реакции нуклеофильного замещения и присоединения с веществами, химическая активность которых обусловлена наличием электрофильного центра, т.е. будут вступать во взаимодействие с электрофильными реагентами.
В соответствии с этим, антиферментной активностью могут обладать галоидированные соединения, производные кислот, соединения, имеющие в своем составе атомы с незаполненной электронной оболочкой, а также полярные молекулы, имеющие атомы с сильно пониженной электронной плотностью. При этом могут протекать процессы алкилирования, ацилирования и комплексообразования. В результате произойдет более или менее сильное нарушение структуры фермента и соответственно этому нарушение его функций, вплоть до полного их прекращения.
Поскольку нарушение функций ферментов приводит к нарушению деятельности организма, то вполне оправданным кажется представление о том, что токсическое действие отравляющих веществ связано с их определенно выраженным антиферментным действием.
Характер и степень токсического действия отравляющих веществ зависят в основном как от той роли, которую играют в организме поражаемые системы, так и от их способности легко и быстро реагировать с отравляющими веществами, образуя устойчивые соединения. Кроме того, важное значение имеют такие факторы, как восстановление активности ингибированного фермента (реактивация фермента) и скорость образования свежего фермента взамен потерявшего активность.
В процессе жизнедеятельности организма происходит непрерывное обновление белковых систем, в том числе и ферментов: разрушение старых, потерявших свою активность белков и образование взамен их новых, работоспособных белков той же структуры и того же назначения. В одних случаях эти процессы происходят медленно и не очень заметно, например отмирание старого рогового слоя кожи и образование нового, в других случаях быстро. Так, гемоглобин, содержащий в своей молекуле 300 аминокислот, образуется всего за 1,5 мин., а в каждую секунду разрушается и заново образуется 3 млн. эритроцитов (форменный элемент крови). Во всех этих и им подобных процессах ткани, клетки и образующийся белок ничем не отличаются от им подобных, как существовавших до них, так и существующих одновременно с ними.
Это постоянство строения и функций всех белковых систем обеспечивается аппаратом наследственности, управляющим процессами воспроизводства белков, клеток, тканей и всего организма в целом. Согласно современным представлениям ответственной за воспроизводство является клетка ткани.
Сама клетка является сложным образованием, состоящим из оболочки, плазмы и ядра с его оболочкой. В плазме клетки находятся субмикроскопические включения – рибосомы, митохондрии, лизосомы, так называемые органоиды.
Очень важную роль в созидательной деятельности клетки играют входящие в ее состав нуклеиновые кислоты (высокомолекулярные соединения небелкового характера), которые впервые были выделены из ядер клеток ("нуклеос" по-латыни – ядро, отсюда и название), хотя впоследствии они были найдены и в других частях клетки. Например, в настоящее время точно установлено, что синтез белка осуществляется в мельчайших образованиях или органоидах клетки при помощи различных нуклеиновых кислот и специфических ферментов.
При воспроизводстве белков, клеток, тканей и даже организма в целом возможны всякого рода нарушения работы аппарата наследственности, которые могут привести к тяжелым и даже гибельным для организма последствиям. Эти нарушения могут происходить под влиянием различных факторов, в том числе и под воздействием отравляющих веществ, которые могут либо умертвить клетку, либо затормозить некоторые ее функции, либо извратить созидательную деятельность клетки по синтезу белка, воздействуя на ее нуклеиновые кислоты. Во всех этих случаях отравляющие вещества являются клеточными ядами.
В связи с этим можно указать, что некоторые химические соединения изменяют состав нуклеиновых кислот, в результате чего нарушаются процессы воспроизводства и появляются мутации, в подавляющем числе случаев вредные для организма, нарушающие его нормальное функционирование. Степень нарушения функций или поражения организма зависит как от количества и роли претерпевших мутации белков систем, так и от скорости их образования.
Химические вещества, вызывающие мутации, называются мутагенными веществами, или хемомутантами. Естественно, что такие вещества являются в той или иной степени токсичными соединениями. В свою очередь многие отравляющие вещества – иприт, зарин и им подобные – также обладают мутагенным действием.
Обмен веществ.Хорошо известно, что многие заболевания связаны с нарушением обмена веществ.
Все вещества, принимающие участие в обмене, как поступающие в организм, так и образующиеся в нем, называются метаболитами, а сам обмен веществ иногда называют метаболизмом. Например, глюкоза после поступления в организм претерпевает целый ряд превращений с образованием уксусной, щавелевой, лимонной и других кислот (все они являются в этом случае метаболитами с вполне определенной ролью в процессе усвоения глюкозы).
Антиметаболитом называют всякое, обычно сходное с метаболитом соединение, которое включается вместо метаболита в обмен веществ и либо извращает этот обмен, либо прекращает его.
Принцип подмены метаболитов антиметаболитами широко используется в медицинской практике для борьбы с болезнетворными микробами. В частности, парааминобензойная кислота необходима для роста бактерий, а амид сульфаниловой кислоты (белый стрептоцид) и другие сульфамидные препараты являются ее антиметаболитами. Микроорганизмы поглощают вместо парааминобензойной кислоты сульфамидный препарат, который для них не является ростовым веществом, в результате чего рост и размножение бактерий прекращаются.
Среди отравляющих веществ известны также соединения, поражающее действие которых основано на подмене метаболитов. Например, фторуксусная кислота, которая включается вместо уксусной кислоты в цикл карбоновых кислот углеводного обмена (цикл Кребса); в результате этого в дальнейшем вместо лимонной кислоты (нормального продукта углеводного обмена) происходит образование ее антиметаболита – фторлимонной кислоты, на которой и обрывается весь цикл углеводного обмена.
На основании изложенного материала можно сделать вывод, что причины и механизмы токсического действия отравляющих веществ могут быть чрезвычайно разнообразны. В одних случаях токсические свойства обусловлены антиферментным действием отравляющих веществ, в других они связаны с мутагенной активностью, в третьих отравляющие вещества являются антиметаболитами. С другой стороны, физиологическая активность даже какого-либо одного отравляющего вещества может быть обусловлена одновременным действием рассмотренных ранее различных механизмов токсичности.
Кроме ферментов, рецепторами первичного действия ядов являются аминокислоты, нуклеиновые кислоты, пуриновые и пиримидиновые нуклеотиды, витамины. Рецепторами часто бывают наиболее реакционноспособные функциональные группы органических соединений, такие как сульфгидрильные, гидроксильные, карбоксильные, амин- и фосфорсодержащие, которые играют жизненно важную роль в метаболизме клетки. Наконец, в роли рецепторов токсичности выступают различные медиаторы и гормоны.
Такимобразом, логичным является предположение известного токсиколога Э.Альберта, что любое химическое вещество, для того, чтобы производить биологическое действие, должно обладать, по крайней мере, двумя независимыми признаками:
1) сродством к рецепторам;
2) собственной физико-химической активностью.
Под сродством подразумевается степень связи вещества с рецептором, которая измеряется величиной, обратной скорости диссоциации комплекса «вещество + рецептор».
Как в свете этих данных выглядит характеристика токсичности? Наиболее элементарное представление о ней дает простая оккупационная теория Кларка, выдвинутая им для объяснения действия лекарств: токсическое действие вещества пропорционально площади рецепторов, занятой молекулами этого вещества. Максимальное токсическое действие вещества проявляется тогда, когда минимальное количество его молекул способно связывать и выводить из строя наиболее жизненно важные клетки – мишени.Дело не столько в количестве пораженных ядом рецепторов, сколько в их значимости для жизнедеятельности организма. Немаловажным является скорость образования комплексов ядов с рецепторами, их устойчивость и способность к обратной диссоциации, что нередко играет более важную роль, чем степень насыщения рецепторов ядов. Таким образом, современная теория рецепторов токсичности рассматривает комплекс «яд + рецептор» с точки зрения их взаимодействия. Считают, что ковалентные связи ядов с рецепторами прочны и труднообратимы. К счастью, количество токсичных веществ, способных образовывать ковалентные связи невелико. К ним относятся, например, препараты мышьяка, ртути и сурьмы. Большинство же известных в настоящее время токсичных веществ и лекарственных средств взаимодействует с рецептором за счет более лабильных, легко разрушающихся связей – ионных, водородных, ван-дер-ваальсовых, что дает возможность их успешного удаления из организма.
Плодотворной оказалась идея Эрлиха о существовании высокой специфичности первичной реакции взаимодействия яда и клетки, когда яд вмешивается в процессы обмена веществ благодаря своему структурному сходству с тем или иным метаболитом, медиатором, гормоном и т.д. Именно в этих случаях можно говорить о взаимодействии между ядом и рецептором как об отношении, напоминающем «ключ к замку» по Эрлиху. Эта идея послужила толчком к развитию химиотерапии, основанной на подборе лекарств по их избирательной точности для определенных структур организма, отличающихся специфическими, цитологическими и биохимическими признаками.
Однако в токсическом действии многих веществ отсутствует строгая избирательность. Их вмешательство в жизненные процессы основано не на специфических химических воздействиях с определенными клеточными рецепторами, а на взаимодействии со всей клеткой в целом. Этот принцип, вероятно, лежит в основе наркотического действия разнообразных органических и неорганических веществ, общим свойством которых является то, что они являются неэлектролитами. Для обозначения всех эффектов, которые прямо определяются физико-химическими свойствами вещества, предложен термин «неэлектролитное действие» (наркотическое, раздражающее, прижигающее, гемолитическое и др.). Такое действие иногда называют «физической» токсичностью.
Токсичное действие большинства веществ включает как неспецифические «физические», так и специфические «химические» компоненты и развивается по смешанному варианту.
Эти выводы весьма условны, т.к. они базируются на самых общих представлениях о механизме действия отравляющих веществ. Могут быть и другие механизмы токсичности, сведения о которых могут быть получены после тщательного изучения биохимии и физиологии живого организма.
Лекция 7
ТОКСИКОКИНЕТИКА
План лекции
1. Свойства биологических мембран.
2. Пути проникновения вредных веществ в организме:
- ингаляционный;
- перкутантный;
- пероральный;
- инъекционный.
Токсикокинетика отвечает на вопрос: какова кинетика токсичного вещества в организме, т.е. рассматриваются пути поступления вредных веществ в организм, их транспорт и распределение, биотрансформация и выделение. Эти процессы протекают во времени с разной скоростью.
Свойства биологических мембран
Поступление чужеродных веществ в организм, их распределение между органами и тканями, биотрансформация (метаболизм) и выделение предполагают их проникновение (транспорт) через ряд биологических мембран.
Мембранные системы организма имеют одинаковое строение, но отличаются по функциональным свойствам. Они представляют подвижные структуры, образованные белково-фосфолипидными комплексами и обладающие ограниченной проницаемостью для различных соединений. В настоящее время за основу принимается гипотеза трехслойной мембраны.
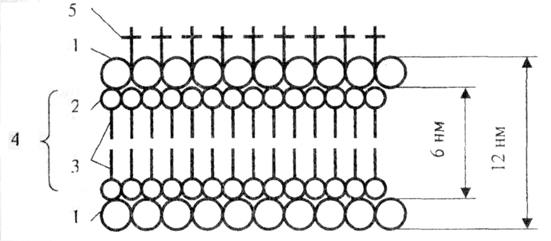
рис. Схема молекулярного строения биологической мембраны: 1 – молекулы белка; 2 – гидрофильная часть молекулы; 3 – углеродные цепи; 4 – двойной слой фосфолипидных молекул; 5 – олигосахариды.
Два белковых слоя, один из которых обращен в сторону цитоплазмы, а другой - наружу, заключают слой двойного липида. Снаружи липидных слоев с плавающими на них белками находится «карбогидратная шуба», состоящая из разных олигосахаридов, полимеров, включающих десятки типов моносахаридов, в том числе глюкозу. Одна из предполагаемых функций этой «шубы» заключается в том, что она способна отличать клетки собственного организма от других. Двойной липидный слой составляет структурный каркас мембраны. Молекулы фосфолипида ориентированы таким образом, что их гидрофильные группы направлены в стороны белка, а гидрофобные поверхности соприкасаются. Толщина каждого слоя 2-4 нм. Предполагают, что в клеточных мембранах существуют ультрамикроскопические поры, образованные гидрофильным веществом, причем мембраны и поры имеют определенные электрические заряды. На мембране и внутри ее могут располагаться системы ферментов, состоящих из белковых молекул.
Белки, связанные только с поверхностью мембраны, называют «внешними».
Белки, которые проникают внутрь, называют «внутренними».Мембрана – нестатичная структура. Соотношение липидов и белков в ней легко изменяется в соответствии с функциональными потребностями.
Изучение функции клеточных и внутриклеточных мембран позволило выделить специальную группу веществ, оказывающих специфическое мембранотоксическое действие, так называемые мембранотоксины.К их числу относят экзогенные и эндогенные вещества, обладающие фосфолипазной активностью, в результате которой происходит дезорганизация и разрушение основной жидкокристаллической структуры мембран с последующей гибелью клеток. Однако обнаружены и некоторые соединения, способствующие стабилизации мембран (холестерин, кортизон, аминозин, салицилаты).
Повреждение мембранных структур клеток является одной из основных причин нарушения их жизнедеятельности. Существует несколько механизмов повреждения мембран. Наиболее существенны четыре:
• ионами кальция;
• перекисным окислением, активируемым ионами Fe2+;
• ультрафиолетовым излучением и кислородом;
• механическим повреждением и разрушающим действием антител.
При острых отравлениях наиболее распространенной причиной повреждения является перекисное окисление липидов в мембранах митохондрий, в результате чего происходит увеличение проницаемости мембран для ионов, в первую очередь Н+ (или ОН-), затем К+, Na+, Ca2+. Следствием этого могут быть осмотические эффекты и разрывы мембран с выходом ферментов. Дальнейшее окисление мембран идет к полному их разрушению и гибели клеток.
Повреждение мембран при гипоксии, сопровождающее многие заболевания химической этиологии, связано с недостатком энергии, выделяющейся при метаболизме АТФ.
Таким образом, повреждение мембранных структур происходит по универсальным механизмам, которые приводят к изменению их проницаемости для ионов, что в свою очередь обусловлено изменением поверхностного заряда на мембране и изменением степени гидрофобности липидной фазы мембран. Оба этих фактора действуют одновременно, хотя их относительный вклад в итоговое изменение проницаемости в разных случаях различен. Эти же факторы определяют в конечном счете неспецифическое действие на проницаемость мембран различных соединений, например таких, как стероиды, белки и многие другие природные соединения. Процесс прохождения веществ через мембраны достаточно сложен, так как приходится учитывать не только функциональные особенности самих мембран, но и определенную роль протоплазмы и клеточных белков.
Мембрана – не просто пассивный барьер. Некоторые вещества проходят непосредственно через мембрану либо путем растворения в ней, либо путем химического взаимодействия с ее веществом.
Однако частично обмен осуществляется через поры. Они не обязательно являются каналами с фиксированным положением. Живая мембрана реагирует на изменяющиеся условия, открывая или закрывая определенные поры, что позволяет пропускать молекулы массой от 100 до 60 000.
Пути проникновения вредных веществ в организм человека
Токсические вещества, находящиеся в окружающей среде, могут проникать в организм человека несколькими путями:
· ингаляционным(через дыхательные пути);
· пероральным (через желудочно-кишечный тракт);
· перкутантным(через неповрежденную кожу).
· инъекционным.
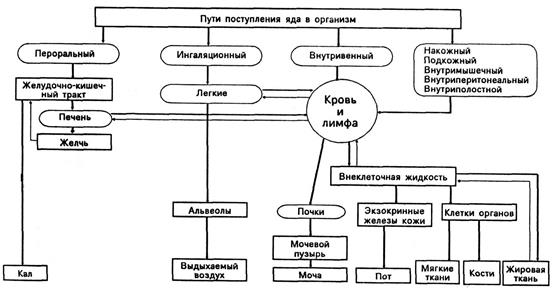
Схема 3. Пути проникновения и выведения ядов в организм человека
Абсорбция через дыхательные пути
Абсорбция через дыхательные пути – основной путь поступления вредных веществ в организм человека на производстве. Ингаляционные отравления характеризуются наиболее быстрым поступлением яда в кровь.
Дыхательные пути являются идеальной системой для газообмена с поверхностью до 100 м2 при глубоком дыхании и сетью капилляров длиной около 2000 км. Их можно разделить на две части:
- верхние дыхательные пути: носоглотка и трахеобронхиальное дерево;
- нижняя часть, состоящая из бронхиол, ведущих в воздушные мешки (альвеолы), собранные в дольки.
Поведение газов и паров внутри дыхательных путей зависит от их растворимости и химической активности. Водорастворимые газы легко растворяются в воде, содержащейся в слизистой верхних дыхательных путей. Менее растворимые газы и пары достигают альвеол, в которых они абсорбируются и могут реагировать с эпителием, вызывая местные повреждения.
Жирорастворимые газы и пары диффундируют через неповрежденные альвеолярно-капиллярные мембраны. Скорость абсорбции зависит от их растворимости в крови, вентиляции, кровотока и интенсивности обмена веществ. Газообразные вещества, имеющие высокую растворимость, легко выделяются из легких с выдыхаемым воздухом.
Удержание частичек в дыхательных путях зависит от физических и химических свойств частичек, их размера и формы, а также от анатомических и патологических характеристик. Растворимые частички в дыхательных путях растворяются в зоне осаждения. Нерастворимые могут осаждаться тремя способами в зависимости от зоны осаждения:
- с помощью мукоцилиарного покрова как в верхних дыхательных путях, так и в нижней части дыхательных путей;
- в результате фагоцитоза (процесса захватывания бактерий особенными клетками – фагоцитами. Поглощенная частица переваривается или растворяется);
- путем прохождения непосредственно через альвеолярный эпителий.
Можно установить вполне определенную закономерность сорбции ядов через легкие для двух больших групп химических веществ.
Первая группа: нереагирующиепары и газы – в организме они не изменяются или их превращение происходит медленнее, чем накопление в крови. К ним относятся пары всех углеводородов ароматического и жирного ряда и их производных.
Вторая группа:реагирующиепары и газы – быстро растворяются в жидкости организма, легко вступают в химические реакции или претерпевают другие изменения, к ним относятся аммиак, сернистый газ, оксиды азота.
Нереагирующиепары и газы поступают в кровь на основе закона диффузии, т. е. вследствие разницы парциального давления газов и паров в альвеолярном воздухе и крови.
Вначале насыщение крови газами или парами вследствие большой разницы парциального давления происходит быстро, потом замедляется и, наконец, когда парциальное давление газов или паров в альвеолярном воздухе и крови уравняется, насыщение крови газами или парами прекращается.
Практический вывод:если при постоянной концентрации паров или газов в воздухе в течение очень короткого времени не наступило острое отравление, в дальнейшем оно не наступит.
Поглощение в желудочно-кишечном тракте (ЖКТ)
Поступление токсических веществ в ЖКТ происходит вместе с пищей и питьем в результате случайного попадания ядов в рот, а также путем заглатывания вдыхаемых нерастворимых частичек.
В быту пероральный путь поступления вредных веществ является основным, в производственных условиях он наблюдается сравнительно редко.
Классическим примером такого пути может служить поступление свинца. Это – мягкий металл, он легко стирается, загрязняет руки, не отмывается водой и при еде и курении может попасть в полость рта. Таким же путем могут попасть в организм кристаллические нитропроизводные бензола и его гомологов.
В ЖКТ условия всасывания ядов затруднены. Это объясняется тем, что ЖКТ имеет относительно небольшую поверхность, кроме того, при этом проявляется избирательный характер всасывания – легко всасываются вещества, хорошо растворимые в липидах. Кислая среда желудочного сока может изменить химические вещества в неблагоприятную для организма сторону. Так, соединения свинца, плохо растворимые в воде, хорошо растворяются в желудочном соке и поэтому легко всасываются.
На протяжении желудочно-кишечного тракта значительные градиенты рН определяют различную скорость всасывания токсичных веществ. Кислотность желудочного сока близка к единице, вследствие чего все кислоты легко всасываются путем пассивной диффузии. Напротив, основания поступают из крови в желудок и отсюда в виде ионизированной формы движутся далее в кишечник.
В основном всасывание ядовитых веществ происходит в тонком кишечнике, секрет которого имеет рН 7,5-8,0. В кишечнике липидорастворимые вещества хорошо всасываются путем диффузии, а всасывание электролитов связано со степенью их ионизации. Трудно всасываются прочные комплексы токсичных веществ с белками.
На абсорбцию в ЖКТ оказывает влияние множество факторов:
- физико-химические свойства веществ, в особенности их растворимость и диссоциация;
- количество пищи в ЖКТ и перистальтика пищеварительного тракта;
- время нахождения пищи в разных отделах ЖКТ;
- свойства эпителия, его поверхность, рН, интенсивность кровообращения;
- гидротропизм, т. е. способность некоторых соединений преобразовывать нерастворимые соединения в более растворимые;
- присутствие других веществ, которые при реакции могут иметь синергетический или антагонистический эффект.
Большинство токсичных веществ, абсорбированных в ЖКТ, попадает в капилляры, затем в воротковую вену и по ней в печень. Здесь они изменяются в ходе обмена веществ и в большинстве случаев обезвреживаются. Кроме того, многочисленные токсические вещества, имеющиеся в крови после всасывания из ЖКТ, могут выделяться с желчью в кишечник.
Абсорбция через кожу
Кожа вместе со слизистой оболочкой естественных отверстий организма покрывает поверхность тела. Она представляет собой преграду для физических, химических и биологических агентов, сохраняет целостность организма и гомеостаз, выполняет другие физиологические функции.
Кожа состоит из трех слоев: эпидермиса, собственно кожи (дермы) и подкожной ткани (гиподермиса).
С точки зрения токсикологии наибольшее значение имеет эпидермис. Он состоит из многих слоев клеток. Под самым верхним слоем расположена липидная мембрана («барьерная»). Однако эта мембрана – несплошная: волосяные мешочки и протоки потовых желез проходят через нее и достигают дермы.
Существуют три пути проникновения токсичных веществ через кожу:
- через эпидермис;
- волосяные фолликулы;
- выводные протоки потовых желез.
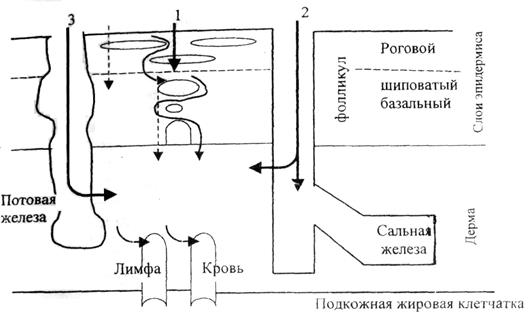
рис.3. Схема поступления ядовитых веществ через кожу
Количество ядовитых веществ, которые могут проникнуть через кожу, находится в прямой зависимости от их растворимости в воде и липидах, величины поверхности соприкосновения с кожей и скорости протока в ней. Вещества с малым коэффициентом распределения неспособны вызвать отравления через кожу, так как быстро удаляются из организма через легкие.
Большое значение для поступления ядов через кожу имеет консистенция и летучесть вещества. Жидкие органические летучие вещества быстро испаряются с поверхности кожи и в организм не попадают. Летучие яды, входящие в состав мазей, паст, клеев, могут вызвать отравления через кожу.
Твердые и кристаллические органические вещества всасываются через кожу медленно и могут вызвать отравление. Наибольшую опасность представляют мало летучие вещества маслянистой консистенции (анилин, нитробензол). Они хорошо проникают через кожу и длительно задерживаются в ней.
Следует учитывать, что соли многих металлов, соединяясь с жирными кислотами и кожным салом, могут превращаться в жирорастворимые соединения и проникать через барьерный слой эпидермиса (особенно ртуть и таллий).
Механические повреждения кожи, термические и химические ожоги способствуют проникновению токсических веществ в организм.
Лекция 8
ТРАНСПОРТ И РАСПРЕДЕЛЕНИЕ ЯДОВИТЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
План лекции
1. Главные средства транспортировки ядовитых веществ в организме.
2. Основные секторы распределения чужеродных веществ в организме.
3. Факторы, определяющие распределение ядов.
4. Примеры кумуляции вредных веществ в организме.
После поглощения любым путем вещества попадают в кровь, лимфу или какую-нибудь другую жидкость организма. Однако для большинства веществ наиболее важным средством транспортировки после всасывания является кровь. В крови вещества находятся либо в свободном состоянии, либо связаны каким -либо компонентом крови. Различные токсичные вещества и их метаболиты транспортируются кровью в разных формах. Вещества могут быть связаны с эритроцитами или с компонентами плазмы. Выраженное сродство к эритроцитам имеют немногие вещества. Оксид углерода связывается с гемом, а мышьяк – с глобином гемоглобина. Свинец на 96 % переносится эритроцитами. Ртуть, содержащаяся в органических соединениях, и цезий также связываются с эритроцитами, а неорганическая ртуть – с альбумином плазмы крови. Белки плазмы могут переносить вещества, растворимые в липидах. Органические кислоты образуют комплексы с различными веществами. К последним относятся щелочноземельные элементы, редкоземельные и некоторые тяжелые металлы, находящиеся в плазме в виде катионов. Обычно комплексы с органическими кислотами способны диффундировать и легко удаляются из тканей и органов.
Удаление токсичного вещества из крови зависит от его свойства связываться с компонентами крови. В некоторых случаях компоненты эритроцитов или плазмы могут удерживать яды продолжительное время. Таким образом, белки крови, способные связываться с токсичным веществом, помимо транспортной функции выполняют роль своеобразного защитного барьера.
Транспорт токсиканта через мембрану, не требующей затрат энергии и возможной в обоих направлений, как в клетку, так и из нее, называется простой диффузией. Транспорт токсиканта, проходящий против градиентаконцентрации (из области с меньшей концентраций в область с большей концентрации) называется активным транспортом.
Пинацитоз – это дополнительные транспортные процессы, предполагающие участие клеточной мембраны.
Распределение и кумуляция токсичных веществ в организме
Следующим этапом всасывания токсического вещества в кровь является его распределение в организме. Одним из основных показателей является объем распределения, т.е. характеристика пространства, в котором распределяется данное токсическое вещество. Существует три главных сектора распределения чужеродных веществ:
- внеклеточная жидкость (объем ее составляет примерно 14 л для человека массой 70 кг);
- внутриклеточная жидкость (объем примерно 28 л);
- жировая ткань (объем ее варьируется).
Накопление ксенобиотиков в отдельных частях организма называется депонированием.
Факторы, определяющие распределение ядов.
Распределение токсичных веществ зависит от трех основных факторов: пространственного, временного и концентрационного.
Пространственный фактор определяет пути наружного поступления и распространение яда. Это распространение во многом связано с кровоснабжением органов и тканей. Наибольшее количество яда в единицу времени обычно поступает в легкие, почки, печень, головной мозг.
Под временным фактором подразумевается скорость поступления яда в организм и скорость выведения из организма, т.е. этот фактор отражает связь между временем действия яда и его токсического эффекта.
Концентрационный фактор – это концентрация яда в биологических средах, в частности в крови. Он считается основным в клинической токсикологии. Определение этого фактора позволяет различить токсикогенную и соматогенную фазу отравления и определить эффективность дезинтоксикационной терапии.
Объем растворения зависит от трех основных физико-химических свойств данного вещества: водорастворимости, жирорастворимости и способности к диссоциации. Водорастворимые соединения способны распространяться во всем водном секторе организма, жирорастворимые вещества депонируются преимущественно в липидах.
