Коллоидные системы в аналитической химии
Коллоидными называют растворы, частицы которых имеют усредненный диаметр 10-7 – 10-9 м (100 – 1 нм).
Частицы больше, чем молекулы приблизительно в 10 раз, но не превышающие 1000 раз. Такие растворы очень устойчивы, могут существовать годами. Частицы, тяжелее молекул более, чем в 1000 раз, седиментируют, т.е. оседают под действием силы тяжести. Коллоидные частицы, как правило, не видны в обычный оптический микроскоп в силу своей малости. Но их можно рассмотреть в ультрамикроскоп. Они способны проходить через фильтры.
Отличие ультрамикроскопа от обычного оптического
Разрешающая способность микроскопа, т.е. наименьшее расстояние, при котором две точки еще можно видеть отдельно друг от друга составляет ~l/2 (0,4-0,7 мкм в видимой части спектра). Т.о. в наилучший микроскоп видны частицы размером ³0,2 мкм. Т.о. кол частицы лежат за пределами видимости в обычном микроскопе.
При ультрамикроскопии на кол систему сбоку направляют сильный луч света и с помощью обычного микроскопа наблюдают рассеянный частицами свет. В обычном микроскопе наблюдение ведется в проходящем свете, частицы при этом кажутся темными, т.к. поглощают свет, а само поле – светлым. При наблюдении в ультрамикроскоп, наоборот поле зрения темное, т.к. лучи от источника света не попадают в глаз наблюдателя, а кол частицы воспринимаются как светящиеся точки из-за рассеяния света.
При ультрамикроскопии необходимо соблюдать условия:
1.Чтобы частицы визуально не сливались друг с другом, расстояние между ними должно быть больше, разрешающей способности микроскопа. Т.о. раствор должен быть разбавлен.
2. Если частицы очень малы, их не видно из-за незначительной интенсивности рассеянного ими света. Если они велики, дифракционные кольца вокруг них будут мешать наблюдению.
3.Коэффициент преломления частиц должен сильно отличаться от коэффициента преломления среды, иначе частицы будут мало заметными.
С помощью ульрамикроскопа можно косвенным способом определить размеры частиц, зная массовую концентрацию. В выделенном микрообъеме многократно подсчитывают число частиц и находят частичную концентрацию n=n/V; c=nrpr34/3.
Если частицы несферической формы, то они мерцают, т.к. при броуновском движении поворачиваются к световому лучу различными плоскостями и посылают в глаз наблюдателя различное количество рассеянного света. Т.о. можно получить представление о форме частиц.
Еслисмешать разбавленные растворы
AgNO3 +NaCl ® AgCl + NaNO3
Если вещества взяты в эквивалентном соотношении, тогда осадок образуется, если одно из веществ в избытке, то осадка может не быть, а возникает коллоидный раствор.
Образуется кристаллик AgCl, который адсорбирует из раствора ионы, способные достраивать кристаллическую решетку по правилу Липатова (Пескова-Фаянса)
[mAgCl] в избытке AgNO3 адсорбирует nAg+ образуя [mAgCl]∙ nAg+ ;
[mAgCl] в избытке NaCl адсорбирует nСl-, образуя [mAgCl]∙ nCl-
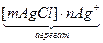 ; nAg+ - потенциалопределяющие ионы. Они определяют заряд и потенциал частицы. Агрегат сильно заряжен и около него скапливаются ионы, способные нейтрализовать заряд агрегата.
; nAg+ - потенциалопределяющие ионы. Они определяют заряд и потенциал частицы. Агрегат сильно заряжен и около него скапливаются ионы, способные нейтрализовать заряд агрегата.
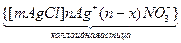 Заряд коллоидной частицы всегда совпадает по знаку с зарядом потенциалопределяющих ионов
Заряд коллоидной частицы всегда совпадает по знаку с зарядом потенциалопределяющих ионов
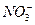 в данном случае противоионы.
в данном случае противоионы.
Образование в виде коллоидной частицы является достаточно стабильным, самостоятельно существует в растворе и движется к противоположно заряженному электроду, как единое целое. Коллоидные частицы во много раз крупнее отдельных ионов или молекул. Около коллоидной частицы ориентируются в диффузном слое слабо связанные с ней дополнительные противоионы, которые нейтрализуют ее заряд до нуля.
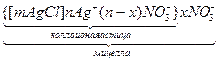
В растворе присутствуют мицеллы. Размеры и форма мицелл могут отличаться, поэтому говорят, что мицеллы представляют собой в различной степени агрегированные агрегаты. Общим для них остается отсутствие заряда и качественно одинаковый характер структуры.
Если при протекании базовой реакции в растворе в избытке NaCl, тогда структура коллоидной частицы меняется, знак заряда обращается, т.е. становится отрицательным, ядро мицеллы [mAgCl] остается тем же самым.
[mAgCl] в избытке NaCl адсорбирует nСl-, образуя [mAgCl]∙ nCl-
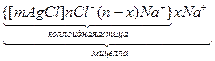
Аналогичная картина возникает в подкисленном растворе, содержащем силикат-ионы
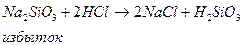 Подкисление слабое, немедленно возникает коллоидный раствор
Подкисление слабое, немедленно возникает коллоидный раствор
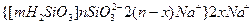
При наличии избытка одного из реагирующих веществ, то, как правило. Образуются коллоидные растворы.
Часто при снижении заряда коллоидных частиц до определенного минимума, даже не до нуля, их взаимное отталкивание как одноименнозаряженных частиц становится настолько слабым, что они не могут преодолеть Ван-дер-Ваальсово притяжение. При этом разрушается коллоидный раствор и образуется осадок (коагуляция), т.е. происходит слипание коллоидных частиц.
Таким образом, концентрирование системы при введении дополнительных противоионов, особенно многозарядных ионов одного знака с противоионами вызывает снижение заряда коллоидных частиц и коагуляцию.
Расстояние, с которого начинается коагуляция, определяется величиной одноименного зарядка коллоидных частиц (электролитная коагуляция).
Возможен и обратный процесс – разрушение осадка и переход твердой фазы в раствор в виде коллоидных частиц. Для этого нужно повысить плотность заряда на частицах за счет введения определенного вещества (пептизатора). Пептизатор вытесняет противоионы и повышает одноименный заряд этих частиц. Происходит пептизация – перевод осадка в коллоидное состояние.
Хроматография.
Хроматография.
Это метод, позволяющий определить качественный и количественный состав раствора или газовой фазы, определяет концентрацию исследуемых частиц в системе в целом.
Метод основан на избирательной адсорбции компонентов систем. Метод впервые предложил русский ученый Цвет.
Метод основан на избирательном поглощении (адсорбции) отдельных компонентов анализируемой смеси различными адсорбентами. Адсорбентами называют твердые тела, на поверхности которых происходит поглощение адсорбируемого вещества.
Хроматография бывает разных видов.
Адсорбционная.
Раствор смеси веществ пропускают через стеклянную трубку (адсорбционную колонку), заполненную адсорбентом.
Вследствие различной адсорбируемости и скорости передвижения веществ, в анализируемой смеси, компоненты удерживаются на различной высоте столба адсорбента в виде отдельных зон (слоев). Вещества, обладающие большей способностью адсорбироваться, поглощаются в верхней части адсорбционной колонки, хуже адсорбируемые — располагаются ниже. Вещества, не способные адсорбироваться данным адсорбентом, проходят через колонку, не задерживаясь, и собираются в фильтрате.
По мере прохождения через слой адсорбента новых порций раствора хорошо адсорбируемые вещества продолжают удерживаться в верхней части колонки, а вещества, адсорбируемые слабее, вытесняются с поверхности адсорбента в нижние слои. В результате на столбике адсорбента получается несколько зон. Если адсорбент бесцветен, а адсорбируемые вещества окрашены, то на столбе адсорбента появляются цветные зоны, образующие хроматограмму.
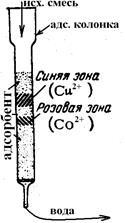
Cu(NO3)2 – голубой, Cо(NO3)2 –розовый.
Например, нужно отделить ионы Co от ионов Cu или от воды. При пропускании I порции водного раствора солей Co и Cu через слой адсорбента (силикагель). DНадс(Cu)> Надс(Cо), Þ ионы меди более прочно адсорбиорваться на адсорбционных центрах адсорбента. Поэтому сначала адсорбируются Cu2+, появится синяя полоса, а ниже - розовая полоса (Cо2+). При введении 2 порции раствора ионы Cu2+ будут вытеснять Cо2+. Синяя полоса расширится, розовая – опустится вниз, на ней адсорбируются старые и новые ионы Cо2+. При дальнейшем введении раствора ширина полос будет расширяться, ионы Cо2+ будут перемещаться все ниже. На выходе же будет чистая вода. Будем вводить раствор, пока все адсорбционные центры не будут заняты ионами Cu2+ или Cо2+. При дальнейшем введении Cu2+ будут вытеснять Cо2+, которые будут с водой выходить из колонки (проскок по кобальту). И настанет момент, когда все адсорбционные центры займут Cu2+, т.е. адсорбцинонная емкость колонки будет исчерпана, она перестанет работать. Для ее восстановления нужно либо промыть большим количеством водяного пара, либо заменить адсорбент.
Применяют адсорбционную хроматографию для разделения неэлектролитов, паров и газов.
