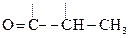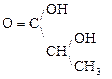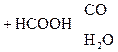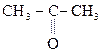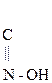Гидрокси-, или оксикислоты
Модуль II
Тема занятия №1 “ Биологически активные гидрокси- и оксокислоты ”
Цель занятия:изучение электронного, пространственного строения и химических свойств биологически важных гидрокси- и оксокислот.
Студент должен знать:
- особенности свойств оксо - , гидрокси - и фенолокислот.
Студент должен уметь:
- объяснить химическое поведение гидроксикислот в организме;
- объяснять кето-енольную таутомерию, роль этого фактора в биохимии организма.
Гидрокси-, или оксикислоты
Это соединения, содержащие одну или несколько групп –ОН и –СООН.
В общем виде их формулу можно представить 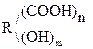 . В простейшем случае n = m = 1. Количество гр. –СООН определяет основность, а гр. –ОН – атомность.
. В простейшем случае n = m = 1. Количество гр. –СООН определяет основность, а гр. –ОН – атомность.
Номенклатура
|
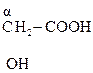
|
|
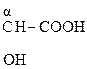
НООС– 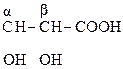
|
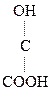 СН2 –СООН
СН2 –СООН | |
Изомерия
Молекулы с тремя атомами углерода проявляют изомерию положения гр. –ОН, а с четырьмя – изомерию положения и углерод – углеродной цепи. Например,
СН3–СН2– 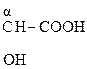 , СН3–
, СН3– 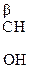 –СН2 –СООН,
–СН2 –СООН, 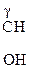 –СН2–СН2–СООН,
–СН2–СН2–СООН,
a-оксимасляная к-та b-оксимасляная к-та g-оксимасляная к-та
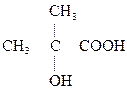 a-оксиизомасляная к-та
a-оксиизомасляная к-та
В молочной к-те появляется ассиметрический (хиральный) атом С, а следовательно, имеются оптические изомеры. Оптическая изомерия свойственна для многих оксикислот.
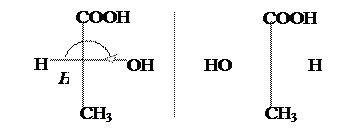 |
D-(–) – Молочная к-та L-(+) – Молочная к-та
Винная к-та имеет два ассиметрических атома С. Однако всего изомеров только три, а не четыре (2n), и оптически активных лишь два, т.к. два одинаковых заместителя (гр. –ОН) создают в молекуле плоскость симметрии.
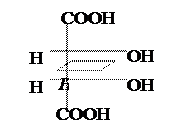 | 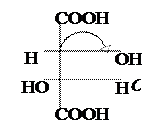 | 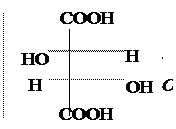 |
Мезовинная к-та D-(+) – Винная к-та L-(–) – Винная к-та
Знак вращения плоскости поляризации света нельзя связывать с отнесением соединений к D – и L – рядам. Знак «+» и «–» определяют прибором - поляриметром. Для соединений с двумя ассиметрическими атомами С определение принадлежности к D – и L – ряду затруднено. По договоренности определяют D – и L – ряды по близлежащему заместителю от старшей функциональной группы, а в углеводах – по положению заместителя у дальнего от старшей функциональной группы атома С.
Химические св-ва
Наличие в молекуле двух функциональных групп приводит к тому, что эти соединения проявляют характерные р-ции как для к-т, так и для спиртов.
За счет взаимного влияния двух групп происходит усиление реакционной способности каждой из них. Кроме того для них возможны специфические р-ции с участием обеих групп.
R – 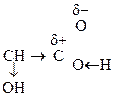 – I, – М
– I, – М
–I –I, +М
I. Р-ции по гр. –СООН
Оксик-ты диссоциируют, образуют соли, сложные эфиры, амиды, ангидриды, галогенангидриды.
1) СН3– 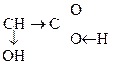 Û СН3–
Û СН3– 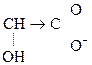 + Н+.
+ Н+.
Молочная к-та Лактат-анион
Окси-ты являются более сильными к-тами, чем соответствующие им карбоновые к-ты, что находит объяснение в ЭА характере групп – ОН и – СООН. Например, a-оксиуксусная к-та в 5 раз сильнее уксусной к-ты.
Соли образуются легко с различными веществами Ме, МеО, МеОН, МеСО3, где Ме – активный металл.
2) СН3– 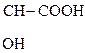 + NaOH ® СН3–
+ NaOH ® СН3– 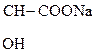 +Н2О.
+Н2О.
Молочная к-та Лактат натрия
Двухосновные к-ты образуют средние и кислые соли. Кислые соли, как правило, мало растворимы в воде, средние – хорошо растворимы. Это используют для обнаружения ионов К+ в фармации и в аналитической химии:
НООС -  -
- 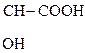 + КОН
+ КОН  КООС -
КООС - 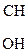 -
- 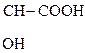 ¯
¯
Винная к-та Гидротартрат калия
Смешанная К–Na соль винной к-ты наз-ся сегнетовой солью.
Номенклатура солей
Молочной к-ты – лактаты, яблочной – малаты,
Винной – тартраты, лимонной – цитраты.
3) СН3– 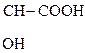 + 2РС15
+ 2РС15  СН3–
СН3– 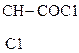 + 2РОС13 + 2НС1
+ 2РОС13 + 2НС1
Молочная к-та
II. Р-ции по гр. –ОН
Это р-ции образования алкоголятов, простых и сложных эфиров, галогенопроизводных [НС1 (газ), РС15, SOC12], р-ции окисления.
1) СН3– 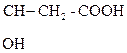 + О
+ О 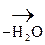 СН3–
СН3– 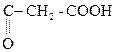 .
.
b-гидроксимасляная к-та Ацетоуксусная к-та (АУК)
Ацетон, ацетоуксусная к-та и g-гидроксимасляная к-та составляют группу «ацетоновых тел», образующихся в большом количестве в организме при сахарном диабете.
НООС– 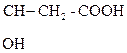 + О
+ О 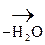 НООС –
НООС – 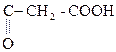
Яблочная к-та Щавелевоуксусная к-та (ЩУК)
АУК и ЩУК являются естественными продуктами обмена веществ. В организме образуются при участии кофермента НАД+. Окисление происходит очень легко.
2) Образование сложного эфира при действии хлоргидрида к-ты:
СН3– 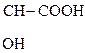 + С1 –
+ С1 – 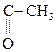
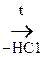 СН3
СН3 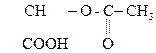
3) При действии Na и РС15 р-ция пойдет по двум группам.
4) Винная к-та и ее производные дают качественную р-цию на диольный драгмент – характерное ярко-синее окрашивание – с р-ром Сu(ОН)2 в щелочной среде.
|
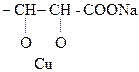
Образовавшееся комплексное соединение под названием реактива Фелинга используется для обнаружения алифатических альдегидов.
III. Специфические р-ции
Они представляют наибольший интерес, т.к. обусловлены взаимным влиянием гетерофункциональных групп.
1) Р-ции дегидратации a-, b-, g-оксикислот
Вследствии наличия групп, способных взаимодействовать друг с другом, молекулы гетерофункциональных соединений способны вступать в р-ции внутри- и межмолекулярного взаимодействия с образованием циклических и нециклических соединений.
а) Две молекулы a-оксик-ты при нагревании выделяют две молекулы воды и образуются ЛАКТИДЫ:
|
|
|
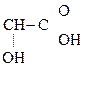
 СН3–
СН3– 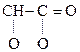
|
Молочная к-та
б) b-оксик-та, в молекуле которой фрагмент – СН2 – находится между двумя ЭА группами, увеличивающих подвижность атомов Н, подвергается дегидратации с образованием непредельной к-ты:
|
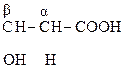
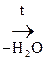 СН3 – СН = СН – СООН
СН3 – СН = СН – СООН b-оксимасляная к-та
Яблочная к-та ведет себя как b-к-та и при дегидратации превращается в фумаровую:
НООС– 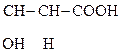
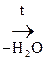
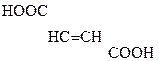
Яблочная к-та Фумаровая к-та
в) g-, d- и т.д. оксик-ты, в которых две функциональные группы находятся рядом идет внутримолекулярная этерификация с образованием ЛАКТОНА:
|
|
|
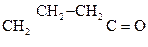
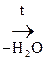
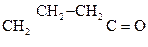
g-Масляная к-та g-Бутиролактон
Лактиды и лактоны являются циклическими сложными эфирами и легко гидролизуются в присутствии щелочей с образованием солей:
|
|
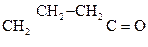 + NaОН ®
+ NaОН ® 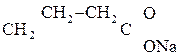
g-Бутиролактон 4-Гидроксибутаноат натрия
2) Наличие двух ЭА групп у одного атома С приводит a-оксик-ты к декарбоксилированию:
СН3 – СНОН – СООН 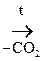 СН3 – СН2ОН
СН3 – СН2ОН
Молочная к-та Этанол
В организме эта р-ция протекает под действием фермента.
В присутствии сильных минеральных к-т углеродный скелет a-оксик-т расщепляется по связи С–1 – С–2 с образованием карбоксильного соединения (альдегида или кетона) и муравьиной к-ты:
R 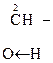
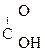
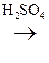 R -
R - 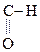 + H -
+ H - 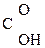
a-Оксик-та Альдегид Муравьиная к-та
Особый интерес представляет поведение лимонной к-ты при нагревании в присутствии минеральных к-т. Как a-оксик-та она отщепляет НСООН, СО2, образуя в итоге ацетон:
|
|

|
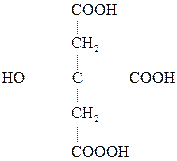
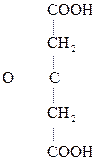
Лимонная к-та Ацетондикарбоновая Ацетон
к-та
Как b-оксик-та она дегидратируется, образуя цис- аконитовую к-ту, участвующую в обмене веществ:
НООС–СН2 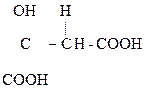
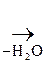 НООС–СН2
НООС–СН2 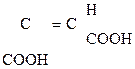
Аконитовая к-та
При этих процессах выделяется энергия. Процесс последовательных превращений лимонной и других к-т в организме наз-ся циклом Кребса.
Отдельные представители
|
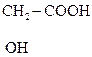
|
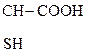
|
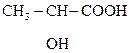
Все три формы встречаются в природе. Рацемическая оптически неактивная молочная к-та (кристаллы) образуется из углеводов в результате молочнокислого брожения под действием бактерий. Получить безводную молочную к-ту очень трудно, т.к. обезвоживание ее р-ров сопровождается образованием лактида. Она образуется при скисании молока, квашении капусты, в различных соленьях, выполняя при этом роль консерванта, т.к. способна препятствовать развитию гнилостных бактерий.
Левовращающая D–молочная к-та образуется также в результате молочнокислого брожения, но под действием других бактерий нежели рацелическая молочная к-та. Правовращающая L–молочная к-та образуется в живых организмах в результате расщепления углеводов. Особенно много ее накапливается в мышцах при больших физических нагрузках.
Соли и эфиры молочной к-ты наз-ся ЛАКТАТАМИ.
В медицине используется как прижигающее (80%-ный р-р) при выведении мозолей, бородавок, пигментных пятен.
Лактат железа (II) (СН3СНОНСОО)2Fе × 3Н2О хорошо всасывается в кишечнике и хорошо переносится больными при анемии.
Лактат кальция применяют внутрь в тех же случаях, что хлорид и глюканат кальция.
НОСН2– СН2– СН2СООН g-Гидроксимасляная к-та (ГОМК) в свободном виде неустойчива, легко отщепляет воду с образованием лактона. В виде натриевой соли используется в медицине как неингаляционное наркозное средство.
НООССН(ОН)СН2СООН яблочная к-та содержит один ассиметрический атом С, поэтому возможно существование ее в виде пары энантиомеров. В природе встречается L-(–)-яблочная к-та (кристаллы), она содержится в ягодах и фруктах. L–яблочная к-та – один из продуктов распада углеводов в живых организмах.
НООССН(ОН)СН(ОН)СООН винная к-та содержит два центра хиральности и теоретически должна существовать в виде четырех стереоизомеров. Однако две формы этой к-ты соответствуют одному соединению (имеется плоскость симметрии) – оптически неактивной мезовинной к-те. Мезовинная к-та по отношению к двум другим формам D– и L–винной к-ты является диастереомером. Таким образом, 2,3-дигидроксибутандионовая к-та (a,a¢-дигидроксиянтарная к-та) существует в виде трех стереоизомеров. Кроме того известен рацемат – смесь равных количеств D– и L–винной к-т, называемая виноградной к-той. Большие заслуги в изучении стереохимии винных к-т принадлежат французскому естествоиспытателю Л. Пастеру (1822–1895).
В природе встречается только D-(+)-винная к-та, содержащаяся во многих растениях, особенно много ее в винограде, который служит сырьем для ее получения. Выделяется в виде малорастворимой кислой калиевой соли («винный камень») в процессе винного брожения виноградного сока. Соли и сложные эфиры винной к-ты наз-ся тартратами.
Винная к-та в смеси с содой NaНСО3 под названием «шипучие порошки» применяются как слабительное средство.
НООССН2С(ОН)(СООН)СН2СООН лимонная к-та (2-гидроксипропан-1,2,3-трикарбоновая к-та) – бесцветное кристалическое вещество, хорошо растворимое в воде. Содержится в различных растениях. Впервые была выделена известным химиком К. Шееле (1742–1786) из лимонного сока, где ее содержание достигает 10%. В промышленности получают путем лиминнокислого брожения отходов сахарного производства.
Соли и сложные эфиры лимонной к-ты наз-ся цитратами. Цитрат натрия применяется для консервирования донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает ионы кальция в нерастворимый цитрат. Цитрат железа (II) – при анемии.
Фенолокислоты
Из ароматических гидроксик-т наибольшее значение имеют фенолок-ты, у которых гидроксильные группы непосредственно связаны с бензольным кольцом (фенольные гидроксильные группы).
Изомерия фенолок-т обусловлена взаимным расположением –ОН и –СООН групп.
В названиях фенолок-т по МН за родоначальную структуру принята бензойная к-та; наличие –ОН группы отражается префиксом гидрокси- (окси-). Для многих фенолок-т употребляются тривиальные названия – салициловая, галловая и др.
Фенолок-ты чаще всего получают прямым карбоксилированием фенолов, т.е. непосредственным введением –СООН группы. Например, при взаимодействии сухого феноксида натрия с СО2, который при обработке минеральной к-той првращается в салициловую к-ту:
Р-ция протекает по механизму SЕ. Поскольку СО2 является слабым электрофилом, непосредственно в р-цию с фенолом он не ступает. Для активации бензольного кольца фенол превращают в феноксид натрия. Отрицательно заряженный атом кислорода феноксид-иона проявляет значительно более сильные электронодонорные св-ва, чем неионизированная –ОН группа. Поэтому в феноксид-ионе бензольное кольцо обладает большой активностью в р-циях SЕ.
Химические св-ва
Фенолокислоты являются сильными к-тами. Сила к-ты возрастает при образовании внутримолекулярной Н–связи:
Проявляют св-ва и фенолов и к-т. Салициловая к-той обладает более кислотными св-вами, чем ее мета- и пара-изомеры.
I. Р-ции по –СООН гр.
Они проходят с образованием солей, сложных эфиров, ангидридов, хлорангидридов, амидов.
Метилсалицилат представляет собой бесцветную вязкую нерастворимую в воде жидкость с приятным запахом, используется в медицине в качестве противоревматического средства. Другие производные салициловой к-ты – фенилсалицилат (салол), ацетилсалициловая к-та (аспирин), салицилат натрия и др. – также широко используются в качестве противовоспалительных средств и анальгетиков.
Салол применяется как дезинфицирующее средство при кишечных заболеваниях. Однако в кислой среде желудка он не гидролизуется, а распадается только в кишечнике, поэтому используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые не стабильны в кислой среде желудка.
II. Р-ции по –ОН гр.
Они проходят с образованием фенолятов (с Ме или МеОН), сложных и простых эфиров.
Салициловая к-та вытесняет слабые к-ты, например, угольную из их солей.
Ацетилсалициловая к-та как сложный эфир способна гидролизоваться в кислой и щелочной средах.
Поэтому следует учитывать условия хранения, которые должны исключать ее контакт с влагой.
| |
При взаимодействии салициловой к-ты с FеС13 образуется фиолетовая окраска, тогда как ацетилсалициловая к-та, у которой нет свободной –ОН группы, такую р-цию не дает. Это различие используется при определении доброкачественности аспирина.
|
Дубильные вещ-ва, содержащиеся в значительных количествах в растениях, включают в свой состав остатки галловой (3, 4, 5-тригидроксибензойной) к-ты. Галловая к-та также легко декарбоксилируется с образованием трехатомного фенола пирогаллола.
| |
III. Р-ции по бензольному кольцу
Фенолокислоты вступают в р-ции SЕ по бензольному кольцу.
При бромировании, нитрировании, сульфировании салициловой к-ты заместители поступают в орто- и пара- положения по отношению к –ОН группе и в мета- положение по отношению –СООН гр., т.о. действие двух функциональных групп согласованное.
Оксокислоты
Это карбоновые к-ты, содержащие карбонильную группу. Различают кето- и альдегидок-ты.
Номенклатура
Тривиальная, рациональная, международная:
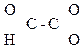 СН3–
СН3– 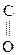 –СООН СН3–
–СООН СН3– 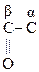 Н2–СООН
Н2–СООН
Глиоксалевая Пировиноградная Ацетоуксусная к-та (АУК),
к-та к-та (ПВК), b-кетомасляная к-та,
a-кетопропионовая, 3-оксобутановая к-та
2-оксопропановая
к-та
Изомерия кеток-т – это изомерия цепи и положения гр. 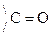 .
.
Оксок-ты могут быть одно-, двух- и многоосновные.
НООС–(СН2)2–  –СООН, НООС–СН2–
–СООН, НООС–СН2–  –СООН
–СООН
a-Кетоглутаровая к-та Щавелевоуксусная к-та (ЩУК),
2-кетоянтарная к-та
Все указанные к-ты являются естественными продуктами обмена веществ.
Оксок-ты, имея в молекуле гр. –СООН и 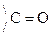 , обладают св-вами, характерными для к-т, альдегидов и кетонов.
, обладают св-вами, характерными для к-т, альдегидов и кетонов.
Р-ции по гр. –СООН – смотрите р-ции в разделе оксик-т; оксок-ты диссоциируют, образуют соли, сложные эфиры, ангидриды, хлорангидриды, амиды.
По карбонильной гр. идут р-ции АN, при этом образуются оксимы, гидразоны, оксинитрилы и т.д., т.е. проходят р-ции с Н2, РС15, NH2OH, NH2– NH2, NH2–NH–С6Н5, НСN, НОR, р-ции окисления.
|
|
|
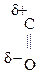 –СООН
–СООН 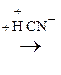
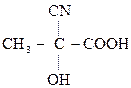 ,
,
|
|
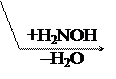
В этом случае р-ции протекают легче, чем для обычных кетонов.
2-оксо-ты окисляются даже такими слабыми окислителями как Сu(ОН)2, при этом образуются две к-ты как и для типичных кетонов:
Н2О + СО2
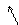
|
|
 –СООН + О + НОН ® СН3СООН + НО–СООН
–СООН + О + НОН ® СН3СООН + НО–СООН Пировиноградная к-та
Это результат увеличения d+ заряда атома С гр. 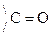 и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
|
 –СООН ® СН3–
–СООН ® СН3– 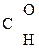 + СО2
+ СО2 Ацетоуксусная к-та легко декарбоксилируется как и все b-кеток-ты даже при слабом нагревании:
СН3–  –СН2–СООН
–СН2–СООН 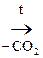 СН3–
СН3–  –СН3
–СН3
АУК Ацетон
В свою очередь 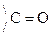 группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
Для оксок-т характерно существование двух изомерных форм: кетонной и енольной, легко переходящих друг в друга и находящихся в динамическом равновесии. Напомним, что явление существования вещ-ва в виде нескольких изомерных формах, легко переходящих друг в друга и находящихся в подвижном равновесии, наз-ся таутомерией. В зависимости от возникающих групп таутомерия наз-ся по-разному: кето-енольная, лактим-лактаимная, прототропная. Для кеток-т характерна кето-енольная таутомерия:
|
|
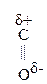
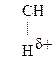 –
– 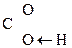 Û R–
Û R– 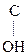 =CH–
=CH– 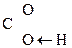 .
. Кето-енольная таутомерия встречается и в обычных альдегидах и кетонах, однако енола содержится в таких системах очень мало (~ 2,5 ×10-5%), т.е. равновесие практически сдвинуто в сторону кетонной формы:
СН3–  –СН3 СН3–
–СН3 СН3– 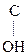 =CH2
=CH2
Ацетон
Введение ЭА заместителя у енолизированного атома С, например гр. –СООН, смещает равновесие в сторону енола:
|
|
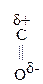 –
– 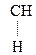 –
– 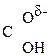 Û СН3–
Û СН3– 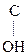 =CH–СООН
=CH–СООН Енольная форма стабилизируется, если двойная С=С связь сопряжена со второй p-системой или гр. –ОН участвует в образовании внутримолекулярной Н-связи. Так, этиловый эфир ацетоуксусной к-ты существует уже на 7,5% в енольной форме, т.к. стабилизирован Н-связью:
СН3– 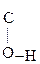 СН–
СН–  –ОС2Н5 Û СН3–
–ОС2Н5 Û СН3–  –CH2–
–CH2– 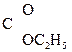 .
.
Смещение равновесия зависит от природы растворителя, температуры (с ее увеличением уменьшается содержание енольной формы) и др. факторов.
Доказательством наличия енольной формы являются р-ции: с Вr2 (водой) – на двойную связь (обесцвечивание), с FeC13 р-ция на –ОН гр. (фиолетовое окрашивание); наличие 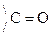 гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
Многие р-ции в живых организмах проходят через енольную форму. Так, фосфорный эфир пировиноградной к-ты является важным фосфолирующим и ацилирующим агентом обмена вещ-в:
CH2= 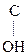 –
– 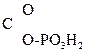 .
.
Вопросы для самоконтроля:
1. Что такое оксикислоты?
2. Химические свойства оксикислот.
3. Оптическая изомерия оксикислот.
4. Что такое оксокислоты?
5. Химические свойства оксокислот.
6. Кето – енольная таутомерия оксокислот.
7. Что такое фенолокислоты?
8. Химические свойства фенолокислот.
Упражнения
1. Напишите проекционные формулы Фишера стереоизомеров 2,3-диоксибутановой кислоты. Сделайте отнесение к D- и L- ряду.
Укажите энантиомеры, диастереомеры и рацематы.
2. Напишите проекционные формулы Фишера стереоизомеров 2,3-диоксибутандиовой кислоты. Сделайте отнесение к D- и L- ряду.
Укажите энантиомеры, диастереомеры и рацемат.
3. Напишите реакции молочной кислоты (2-гидроксипропановой кислоты) с: 1) H2, 2) HCl, 3) PCl5, 4) CH3OH, 5) NH3. Назовите продукты реакции.
4. Напишите реакцию окисления молочной кислоты (2-гидроксипропановой кислоты). Назовите продукт реакции.
5. Напишите специфические реакции, характерные для α-, β-, γ- оксикислот.
6. Напишите реакции пировиноградной кислоты (2-оксопропановой кислоты) с: 1) H2, 2) HCN, 3) PCl5, 4) NaOH, 5) NH2-NH2. Назовите продукты реакции.
7. Напишите реакции окисления и декарбоксилирования пировиноградной кислоты (2-оксопропановой кислоты).
8. Изобразите два изомера 3-оксобутановой кислоты, используя кето – енольную таутомерию. Напишите качественные реакции этих изомеров с бромной водой и гидразином.
9. Напишите схему разложения лимонной кислоты.
10. Изобразите и назовите изомеры оксибензойной кислоты.
11. Напишите реакции салициловой кислоты с: 1)Na , 2) NaOH, 3) PCl5, 4) CH3OH, 5) NH3, 6) Br2, 7) FeCl3. Назовите продукты реакции.
12. Напишите реакции ацилирования и декарбоксилирования салициловой кислоты. Назовите продукты реакции.
Лабораторная работа
«Свойства оксикислот»
Опыт 1