Тестовые задания для промежуточной аттестации
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ имени И.М.СЕЧЕНОВА
Фармацевтический факультет
КАФЕДРА АНАЛИТИЧЕСКОЙ, ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ ФФ
СПЕЦИАЛЬНОСТЬ – 060301 ФАРМАЦИЯ СПО
КУРС - I I
Дисциплина: АНАЛИТИЧЕСКАЯ ХИМИЯ
Авторы:Удянская И.Л.., Краснюк И.И.(мл.)
ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ
Тема 1: «Гетерогенные равновесия в системе осадок - насыщенный раствор малорастворимого электролита и их роль в аналитической химии»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
Подберите формулу, связывающую растворимость иодида висмута с его произведением растворимости: 1) 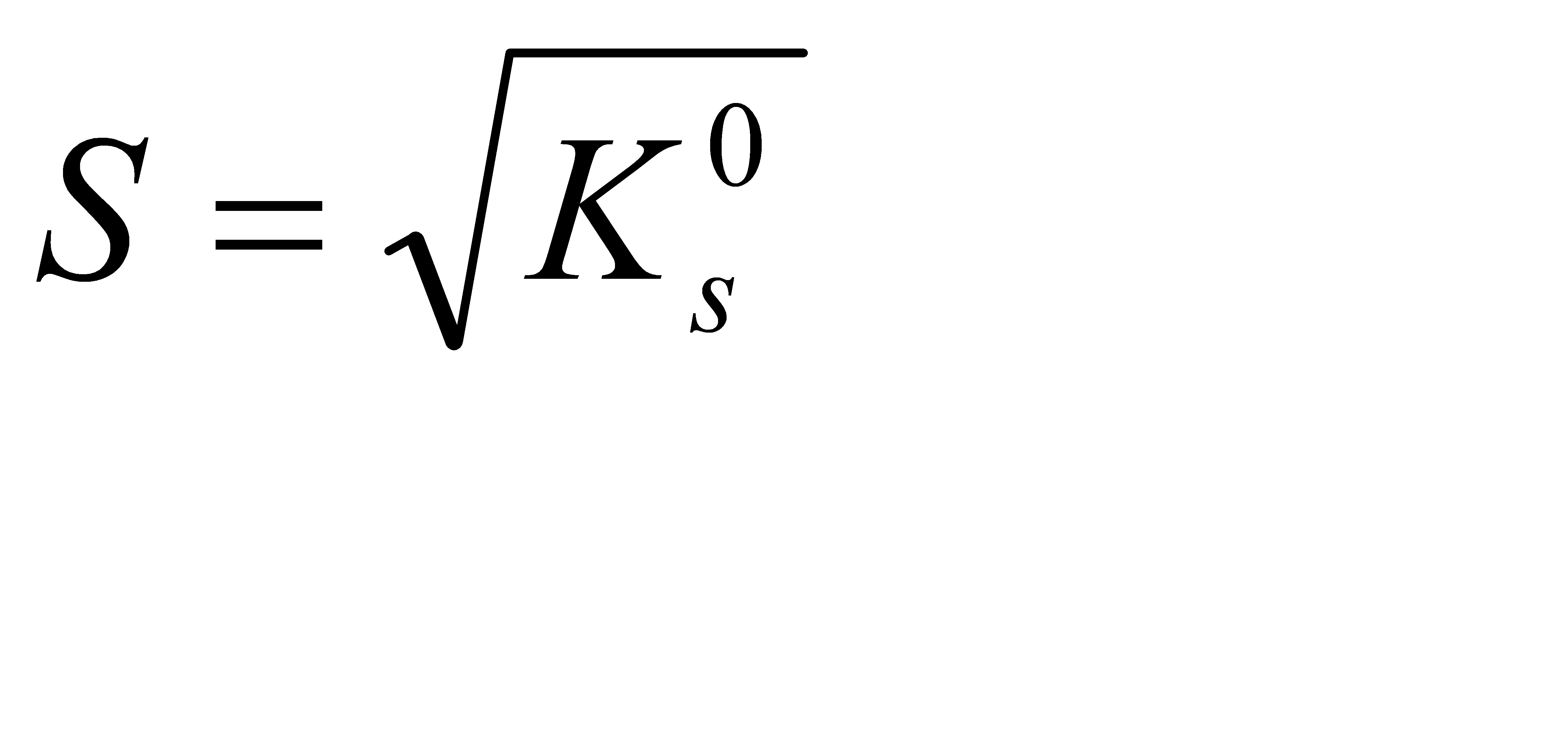 2) 2) 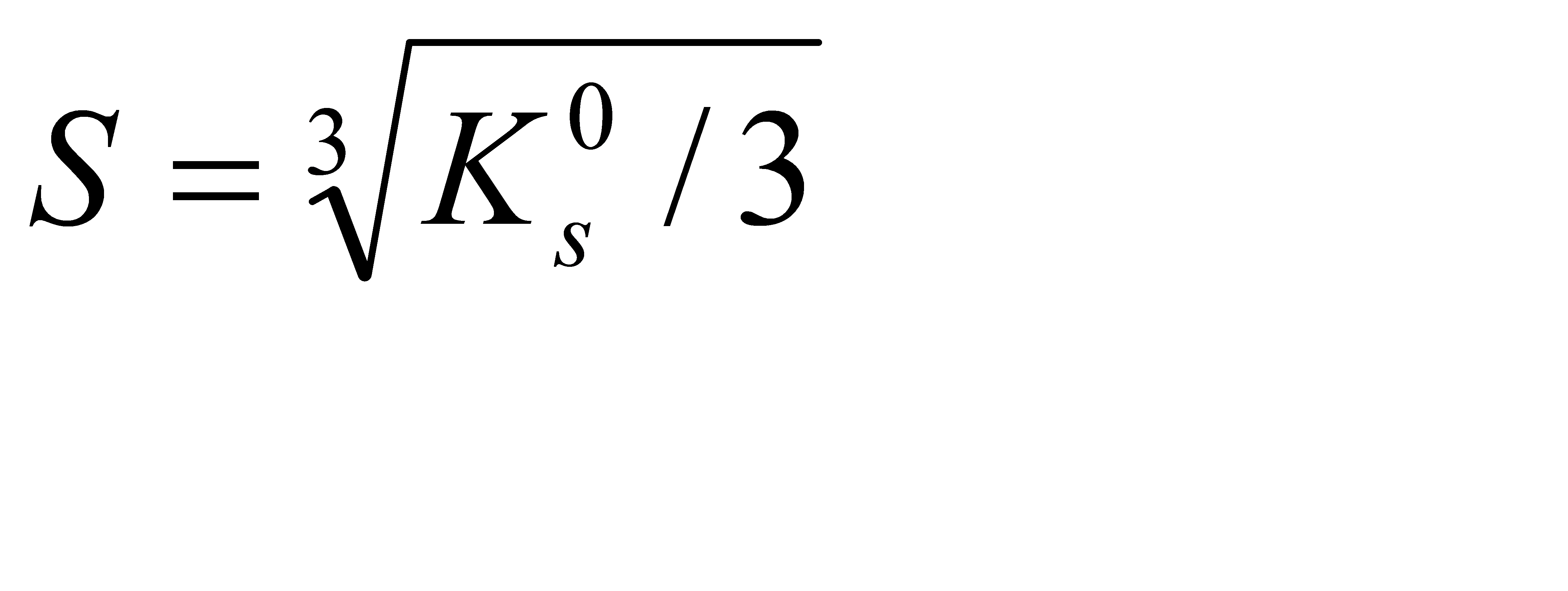 3) 3)  4) 4) 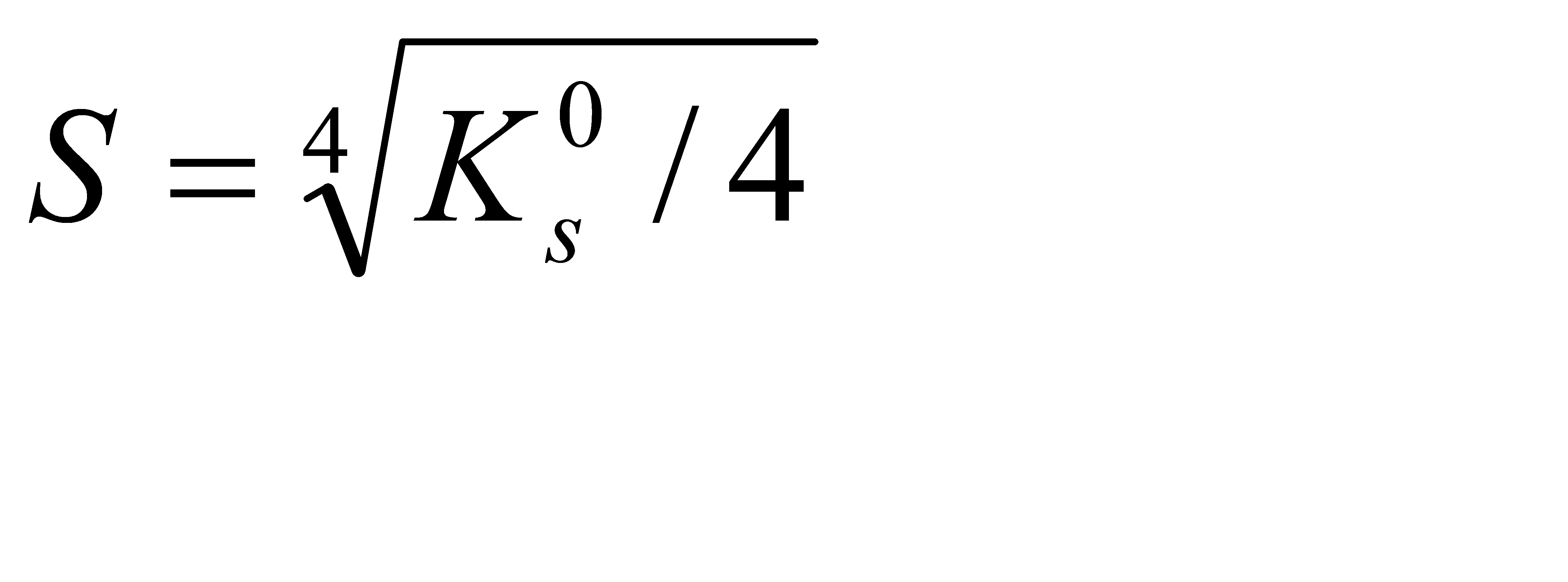 5) 5) 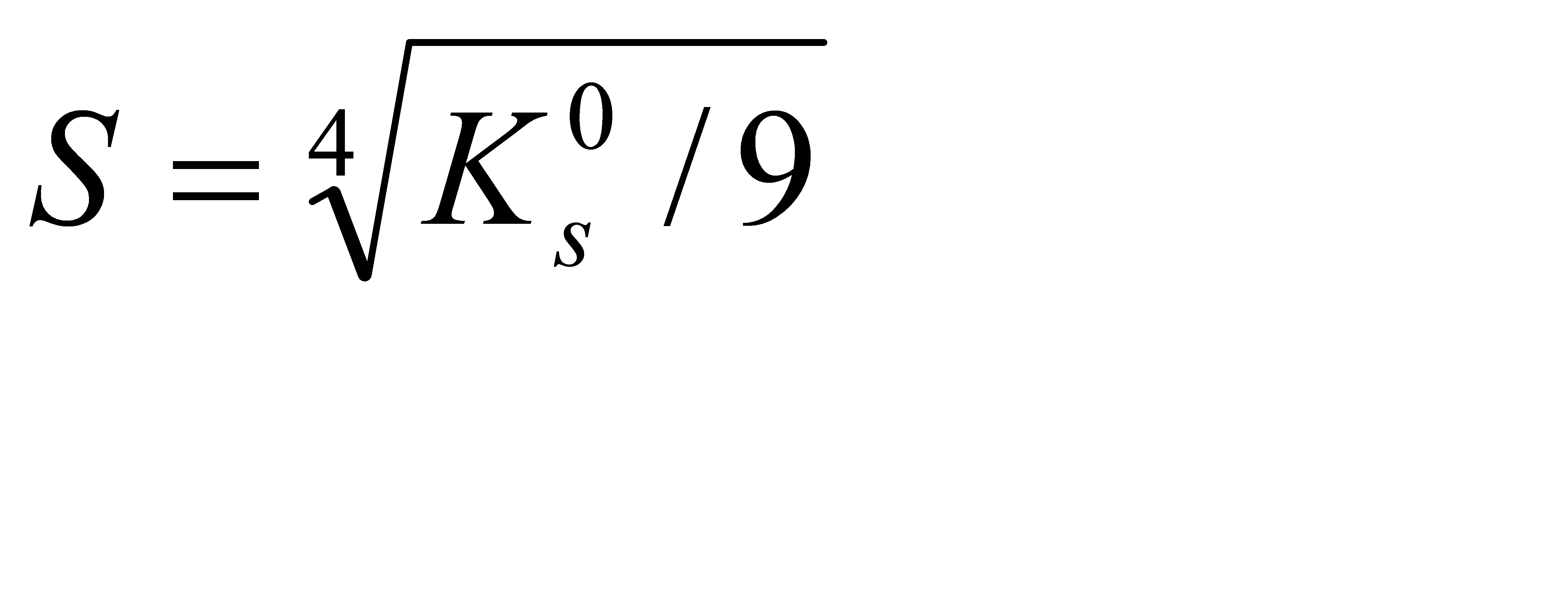 | |||
Подберите формулу, связывающую растворимость фосфата свинца с его произведением растворимости: 1) 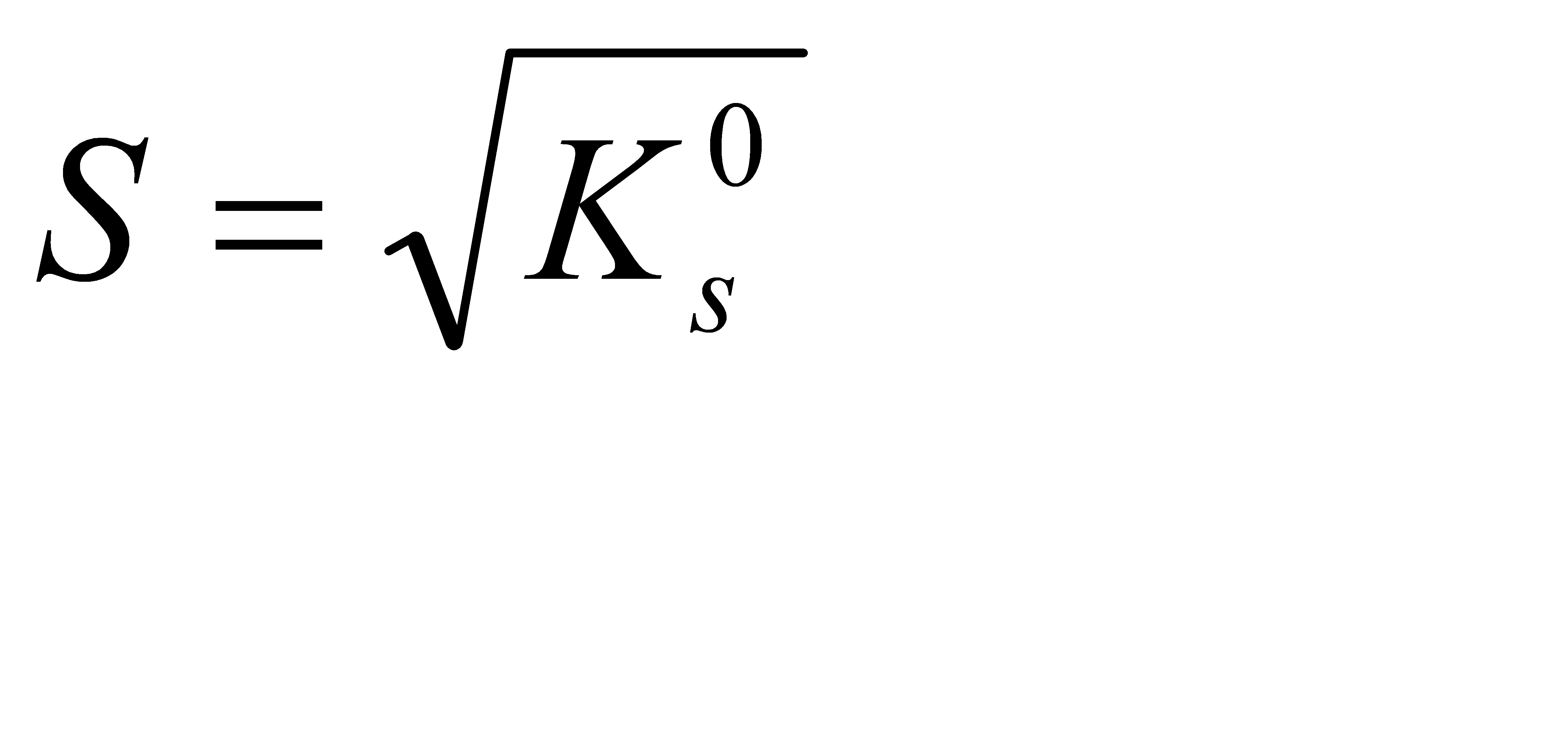 2) 2)  3) 3) 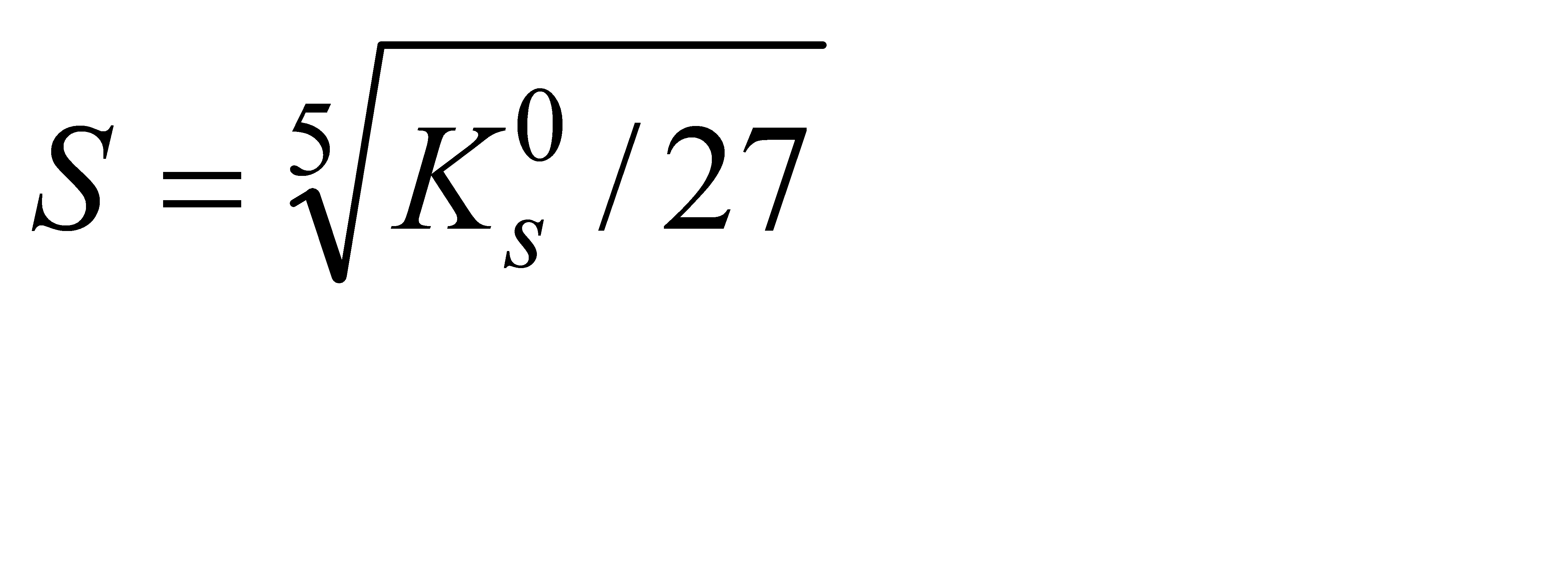 4) 4) 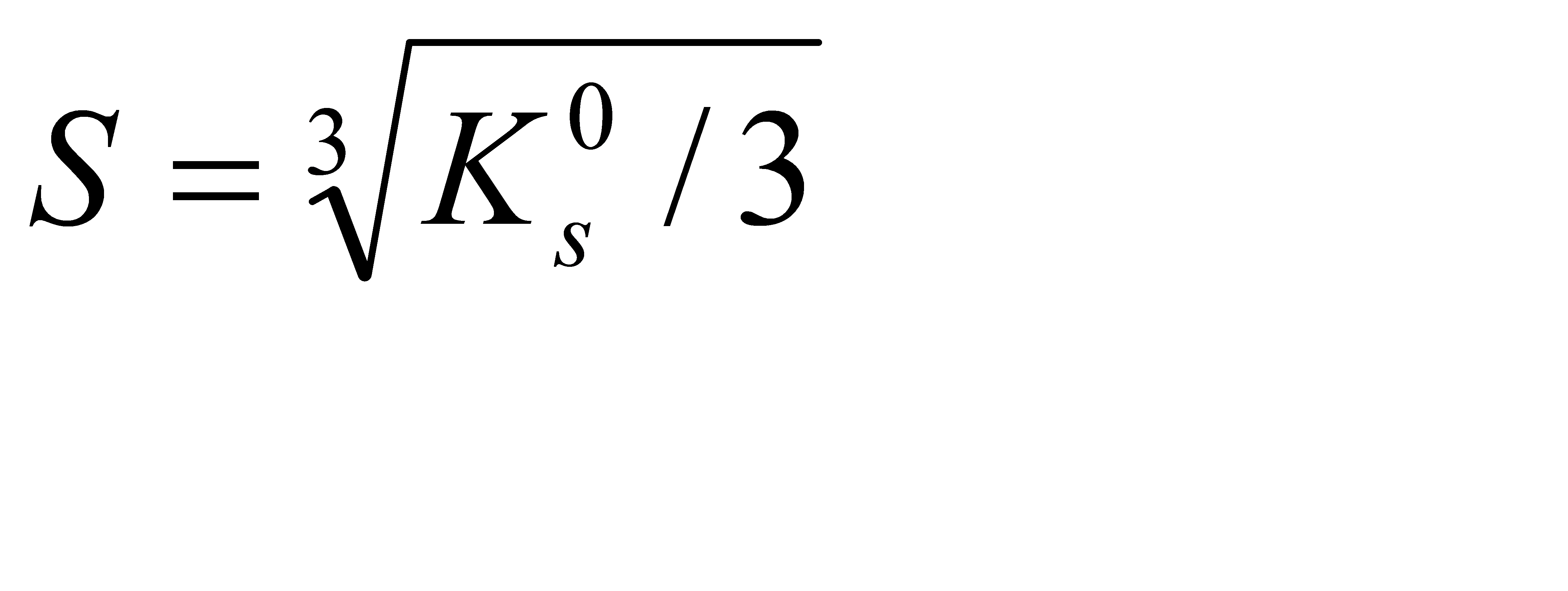 5) 5) 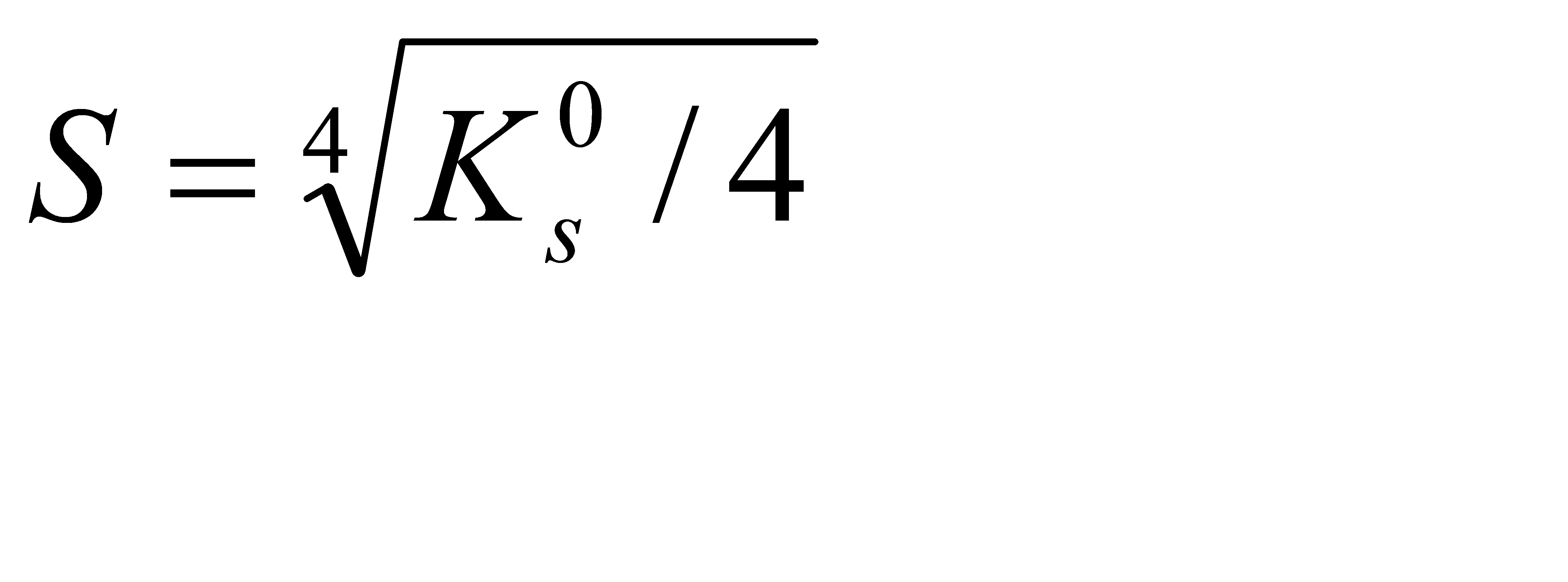 | |||
Подберите формулу, связывающую растворимость хлорида серебра с его произведением растворимости: 1) 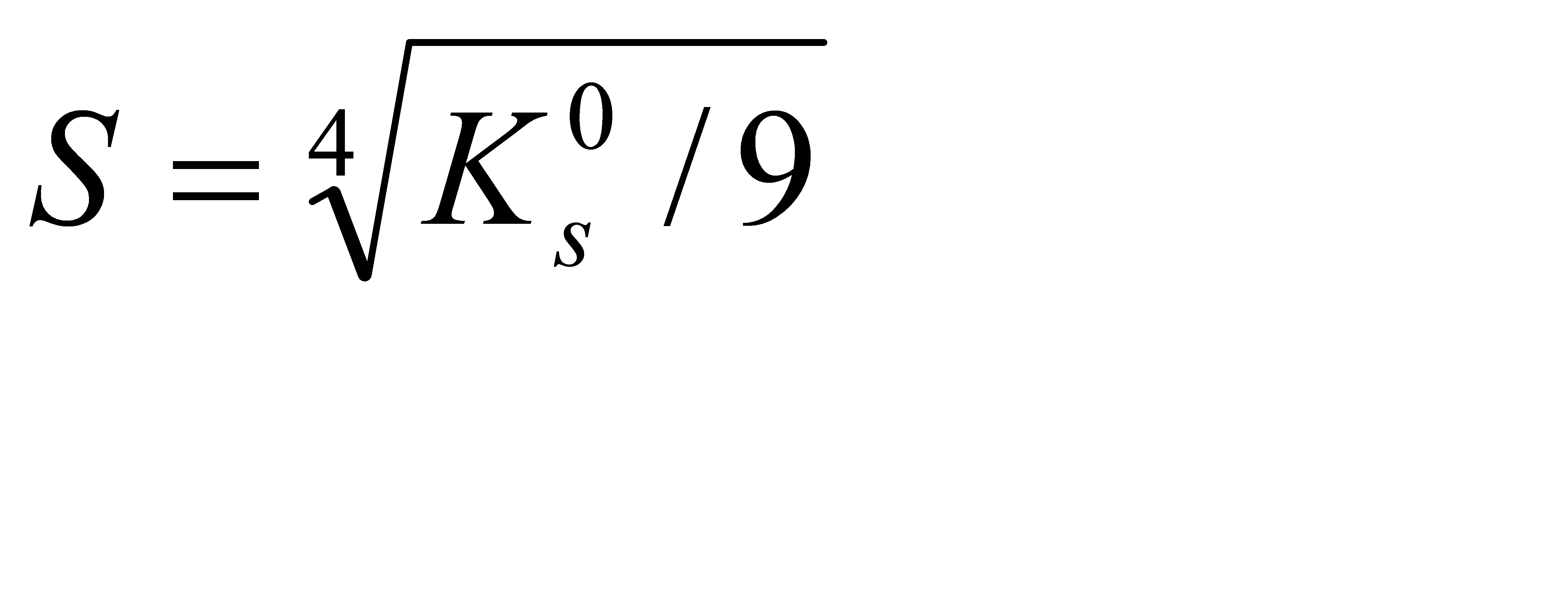 2) 2) 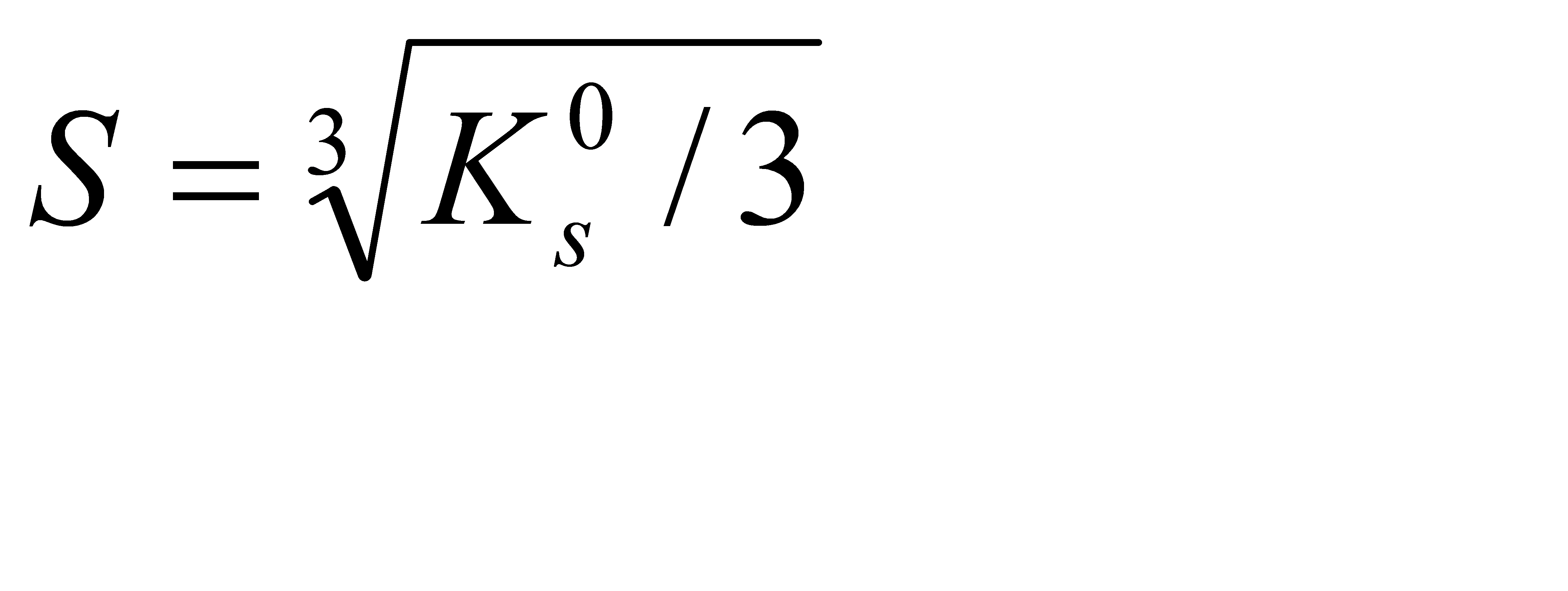 3) 3) 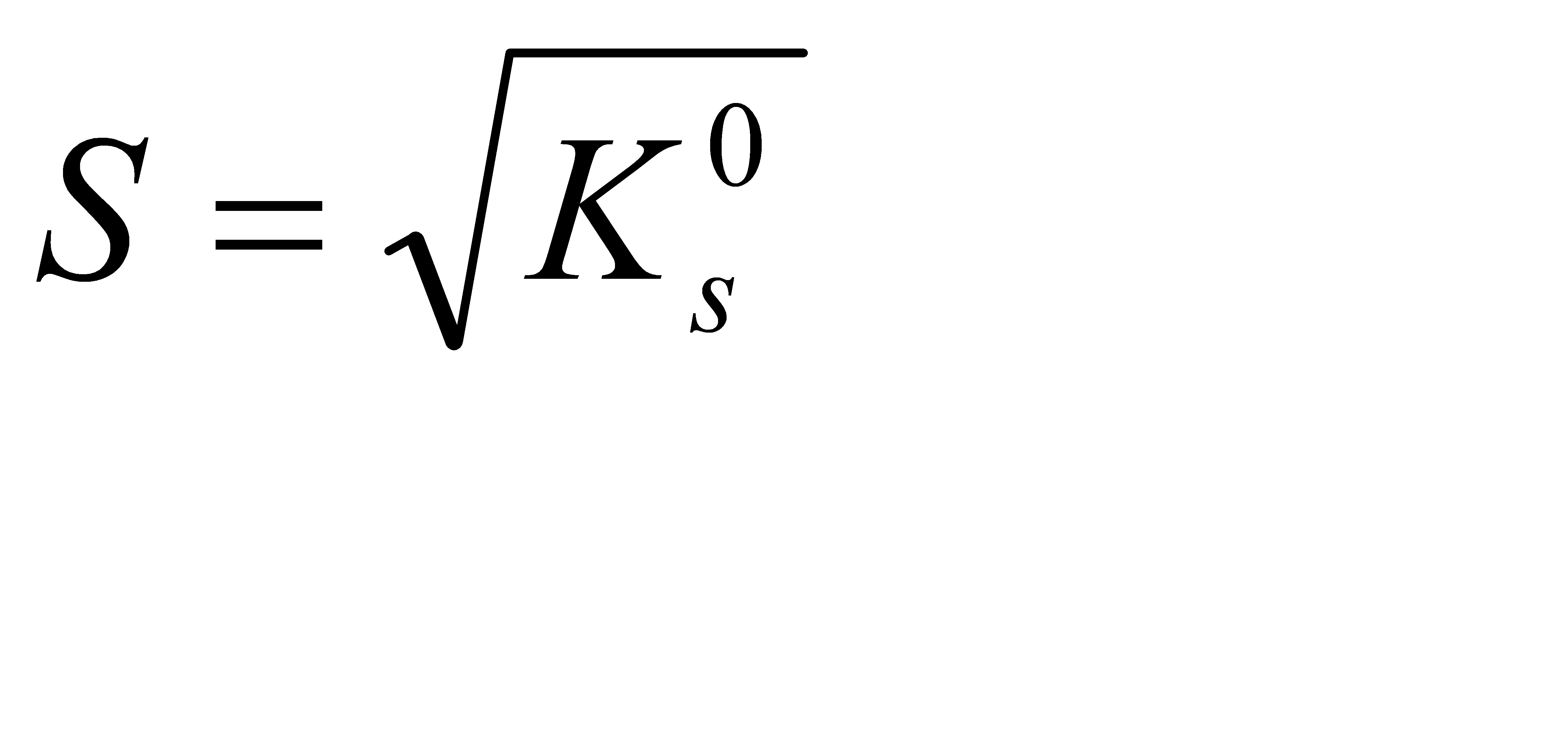 4) 4) 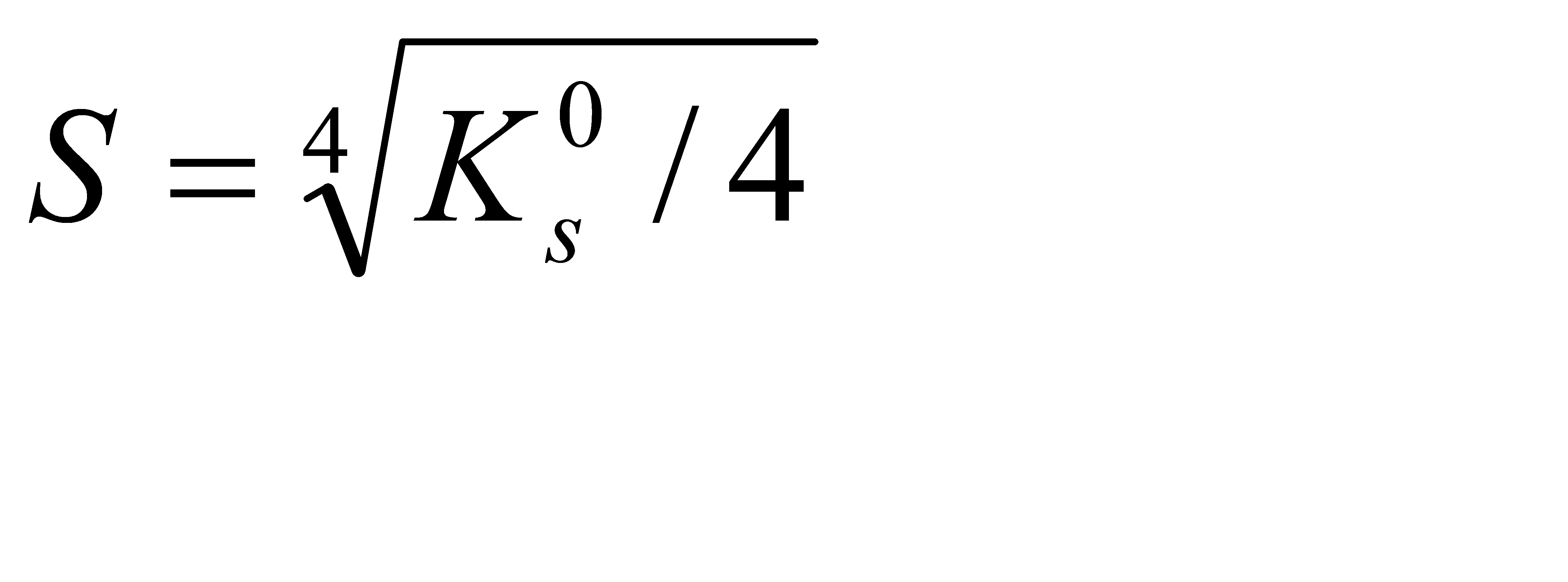 5) 5)  | |||
Подберите формулу, связывающую растворимость магния гидроксида с его произведением растворимости: 1) 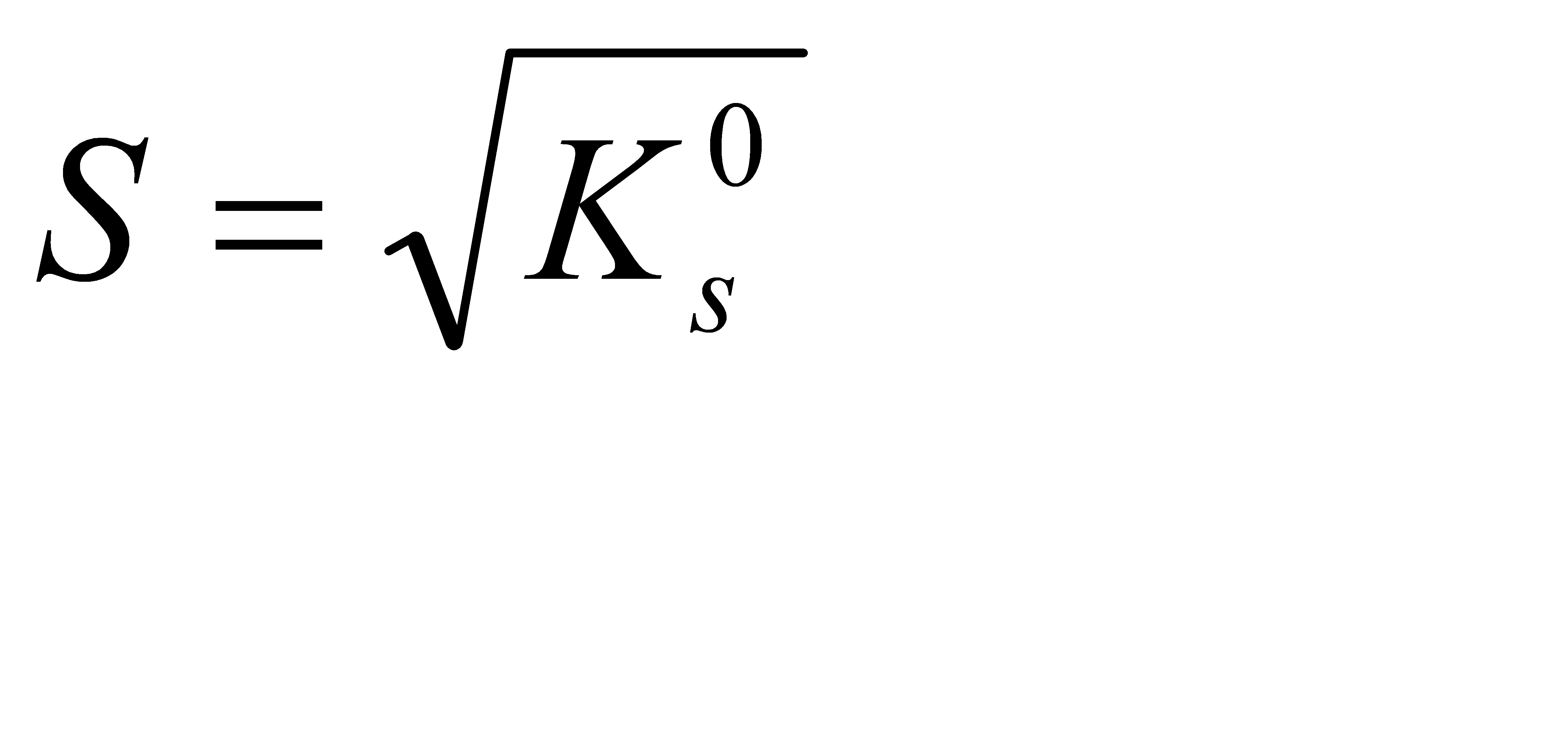 2) 2) 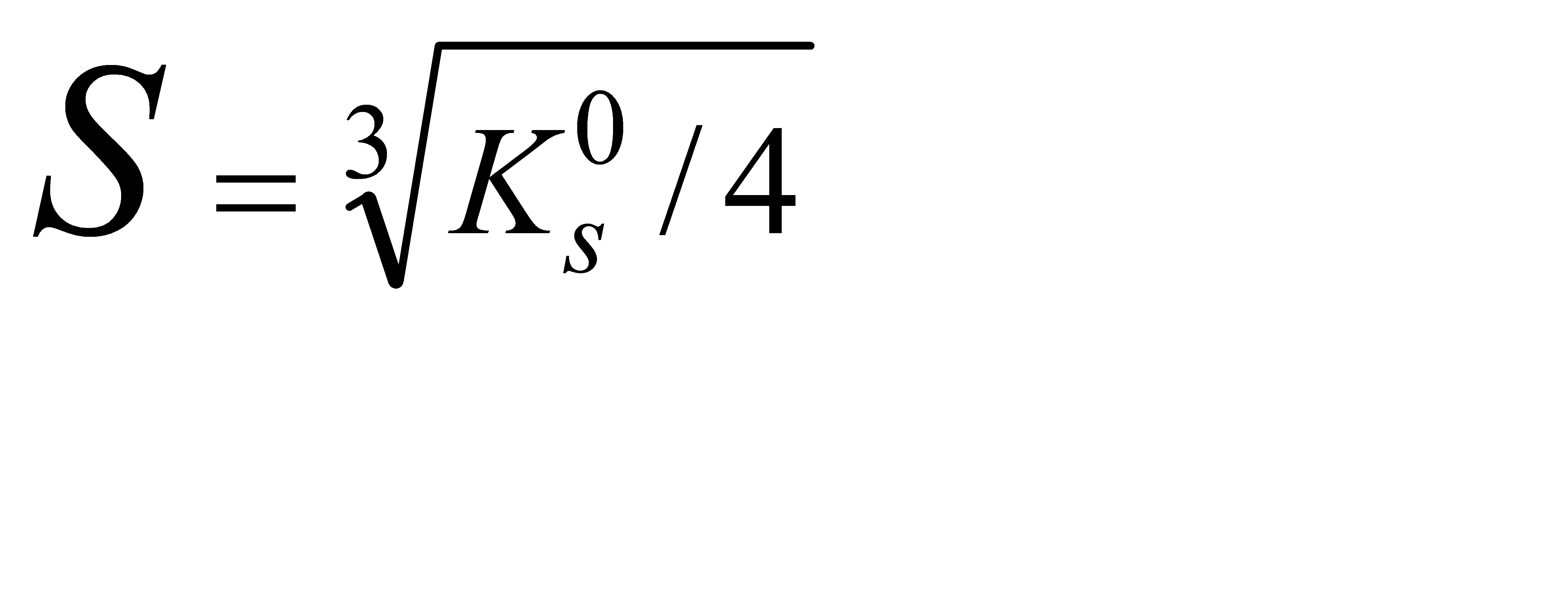 3) 3) 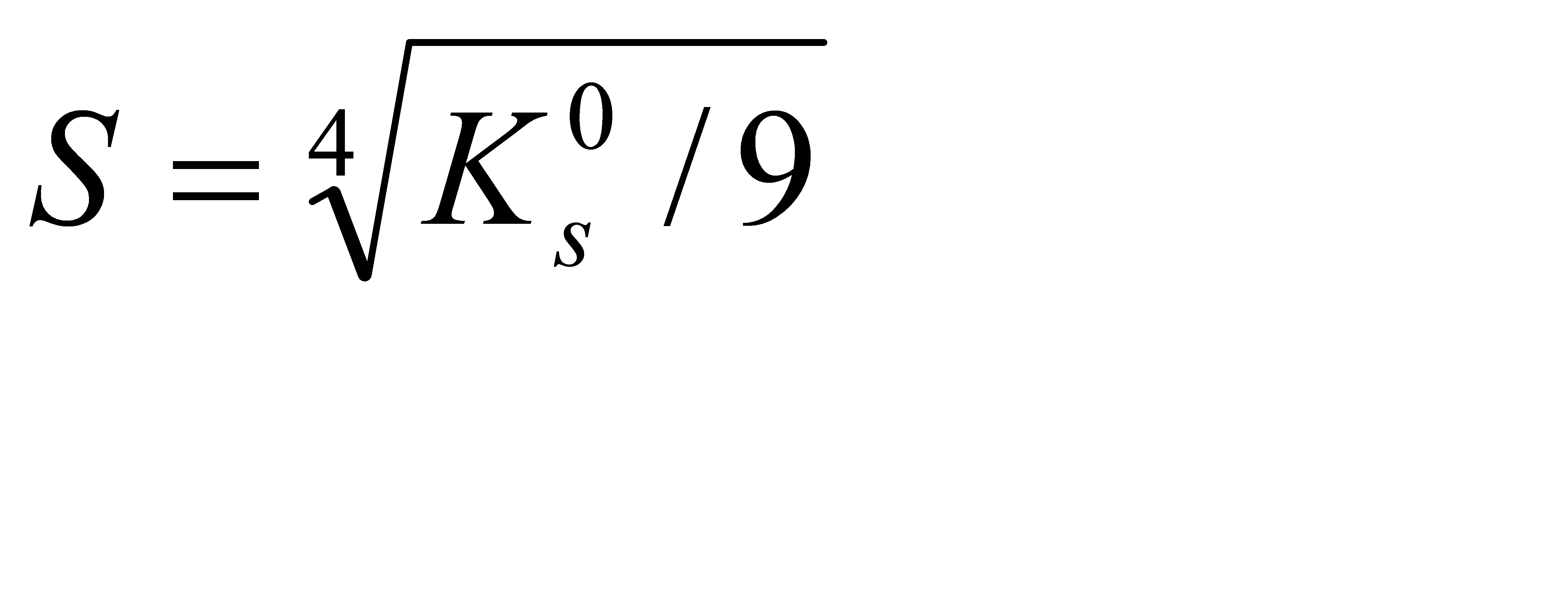 4) 4) 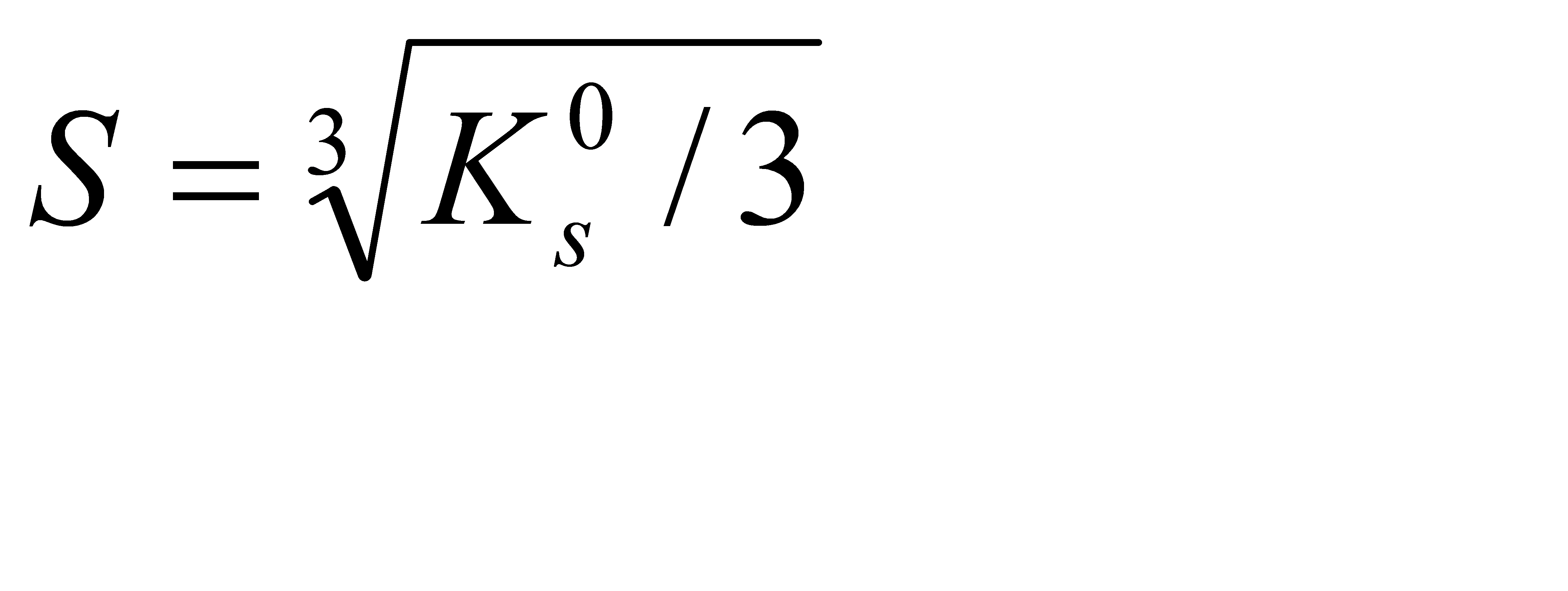 5) 5)  | |||
Подберите формулу, связывающую растворимость бария фосфата с его произведением растворимости: 1) 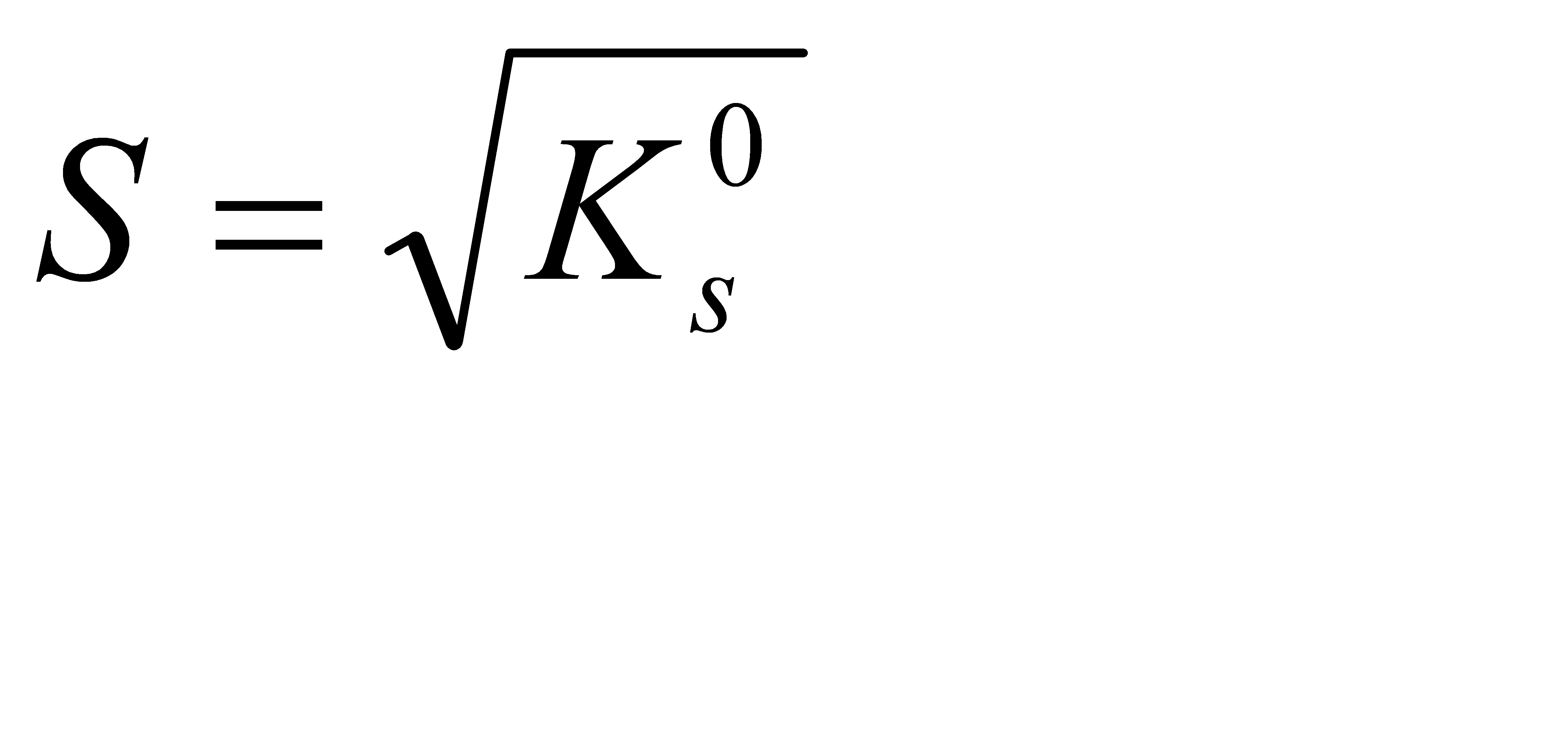 2) 2) 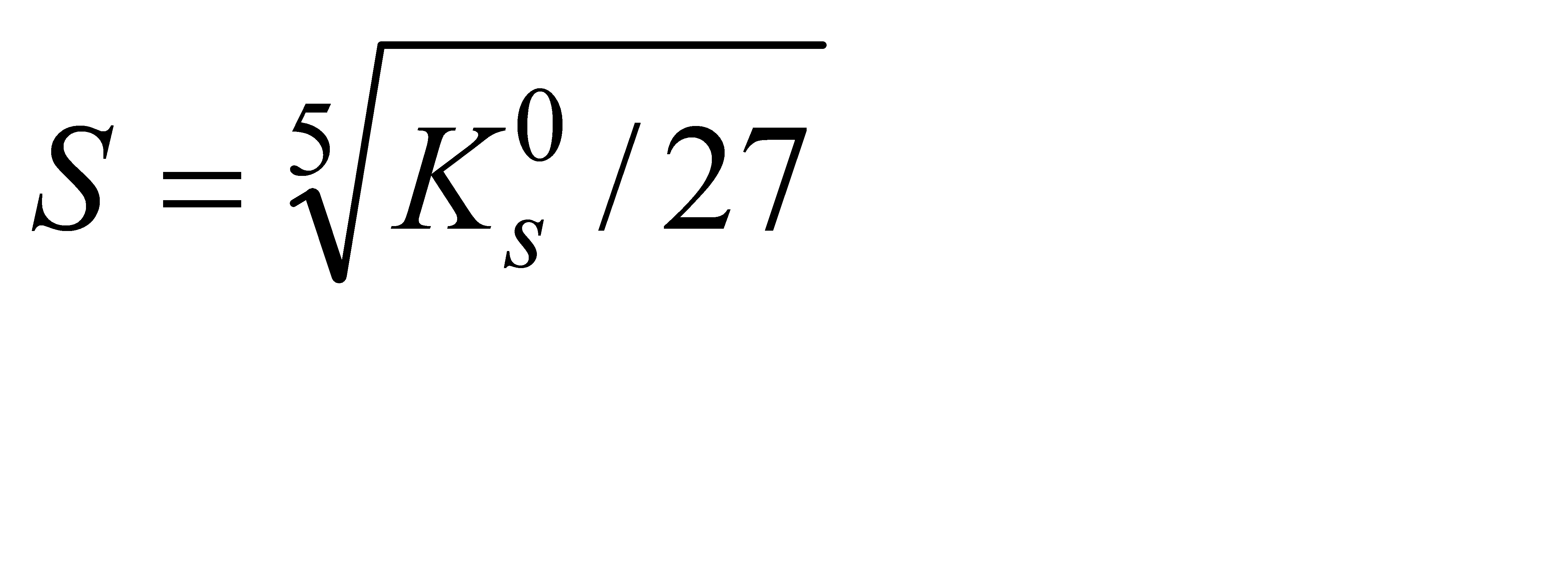 3) 3)  4) 4) 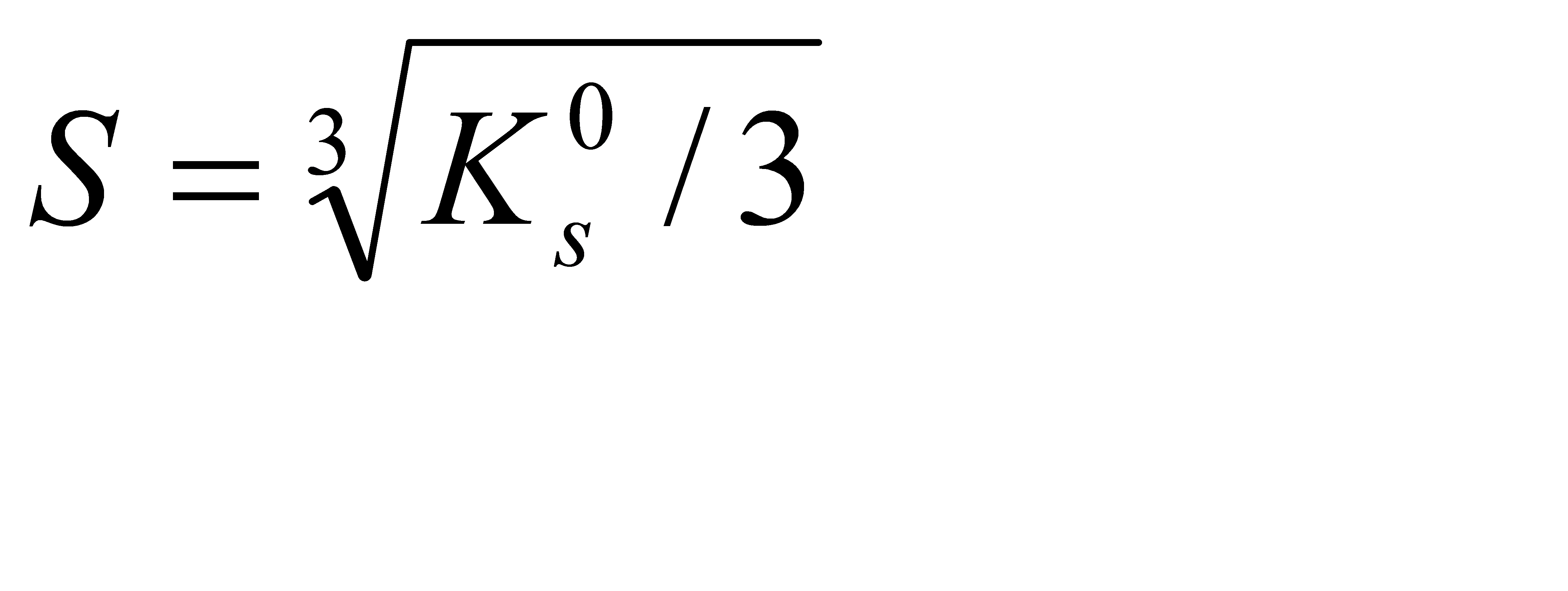 5) 5) 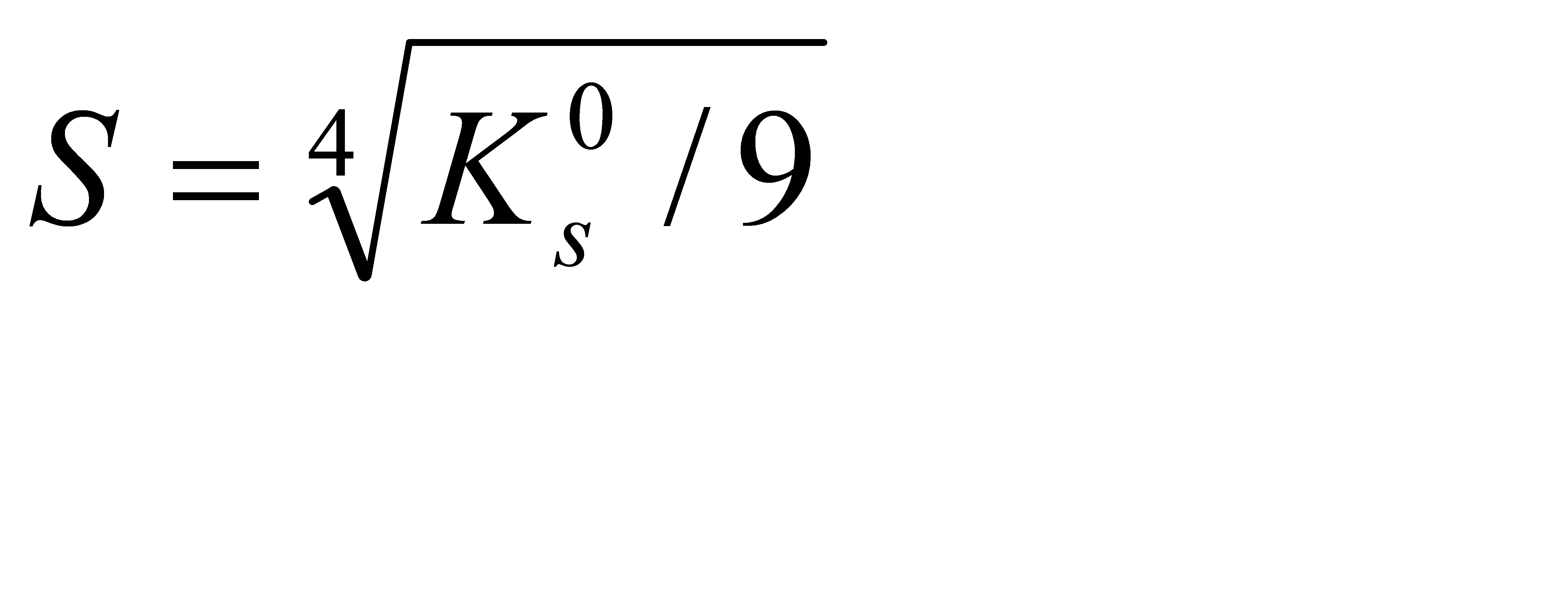 | |||
Подберите формулу, связывающую растворимость серебра хромата с его произведением растворимости: 1) 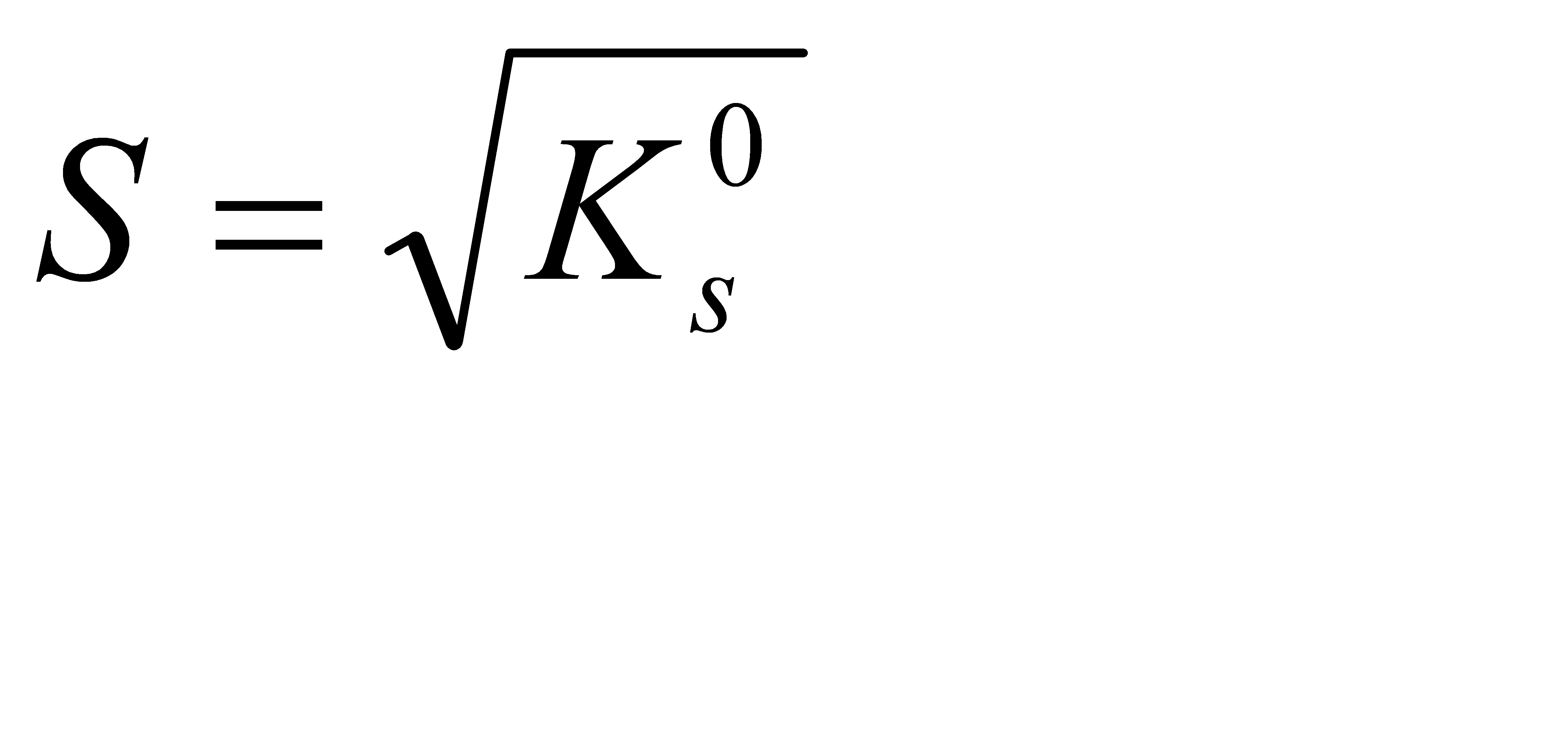 2) 2)  3) 3)  4) 4) 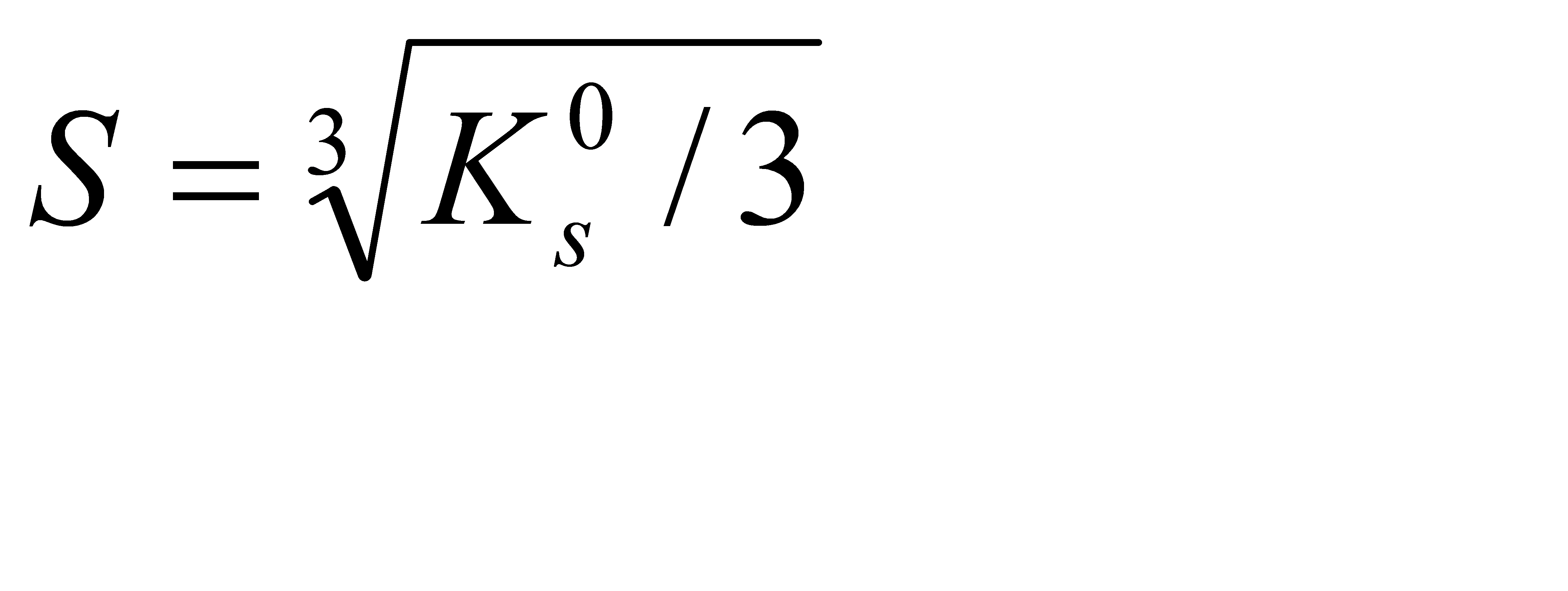 5) 5) 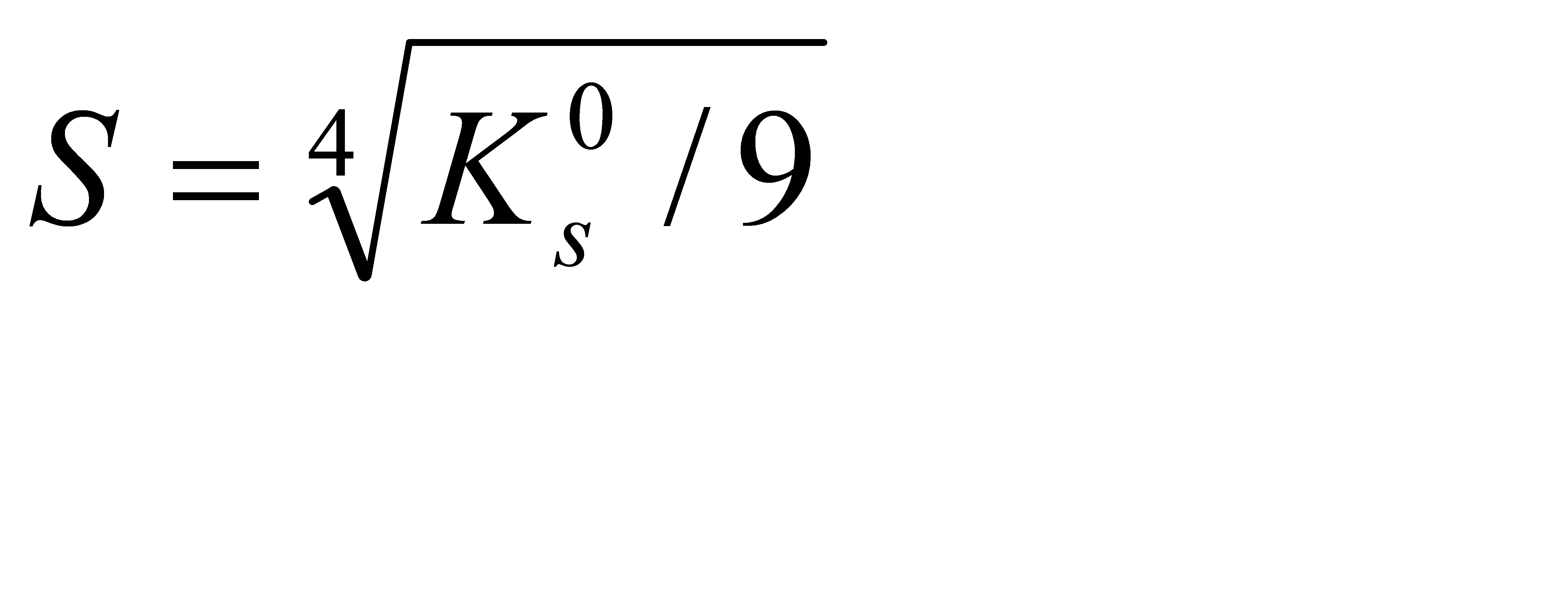 | |||
Подберите формулу, связывающую растворимость фосфата кальция с его произведением растворимости: 1) 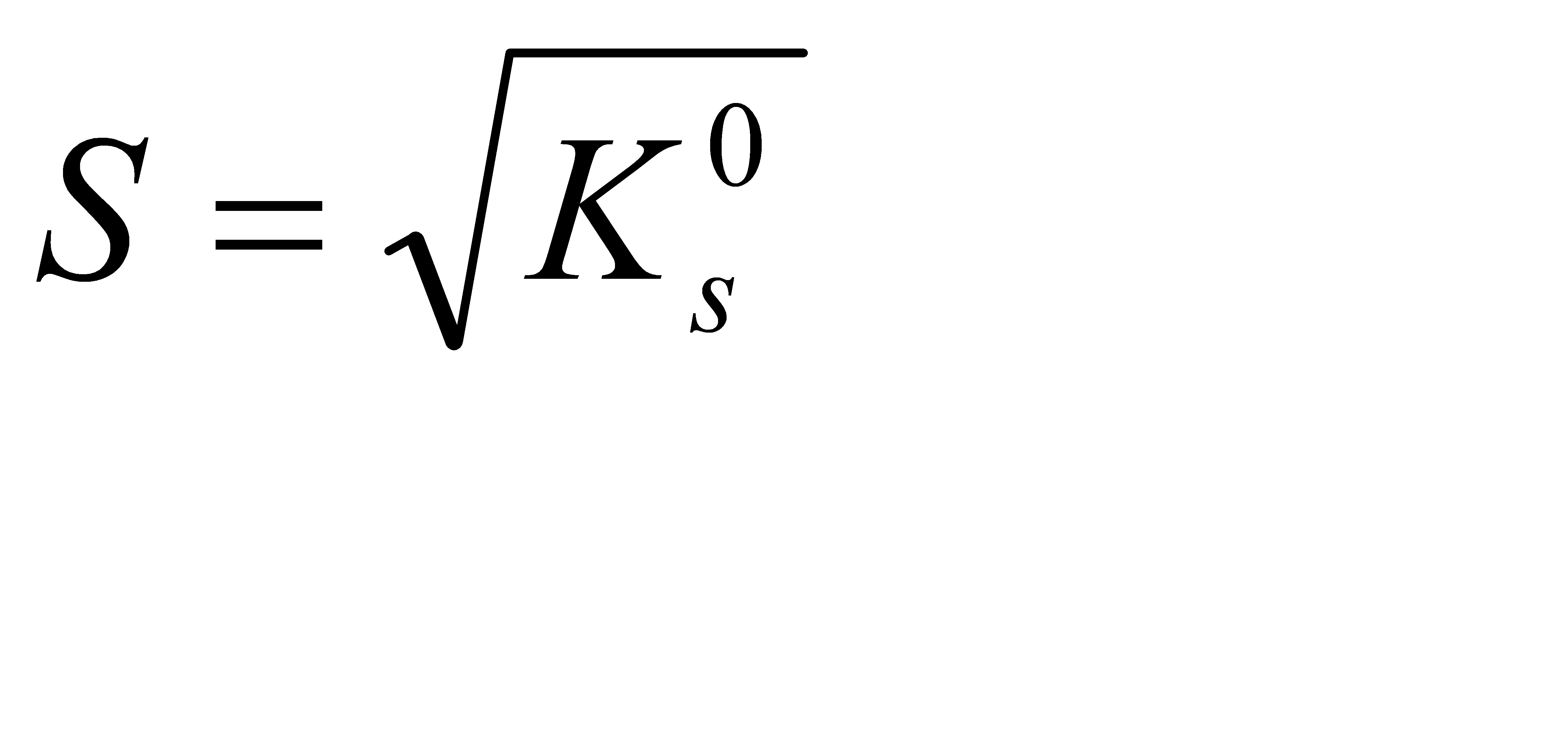 2) 2)  3) 3) 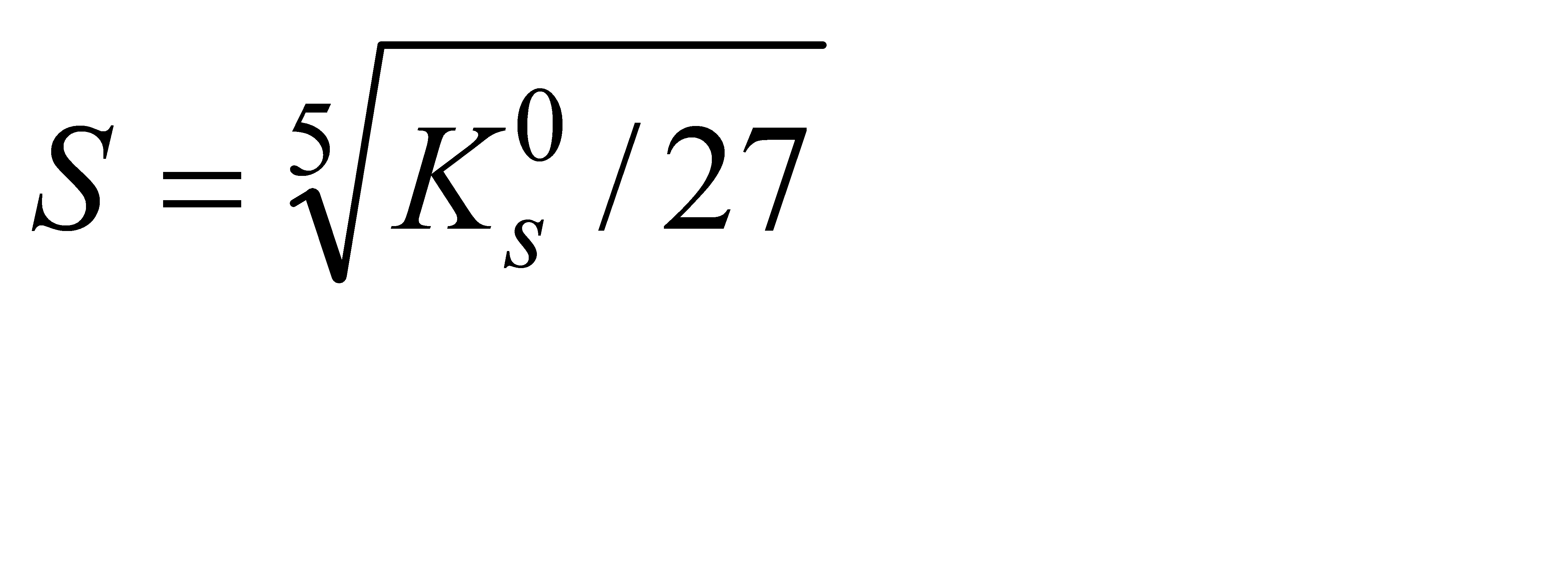 4) 4) 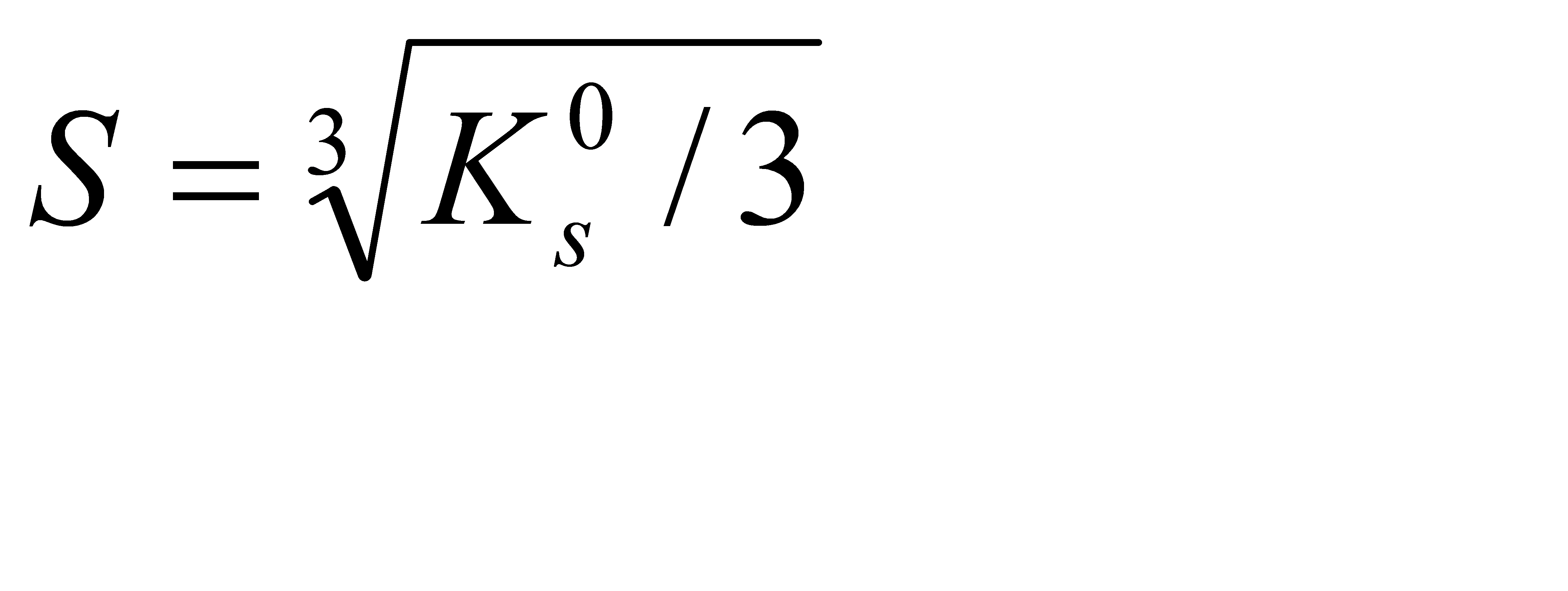 5) 5) 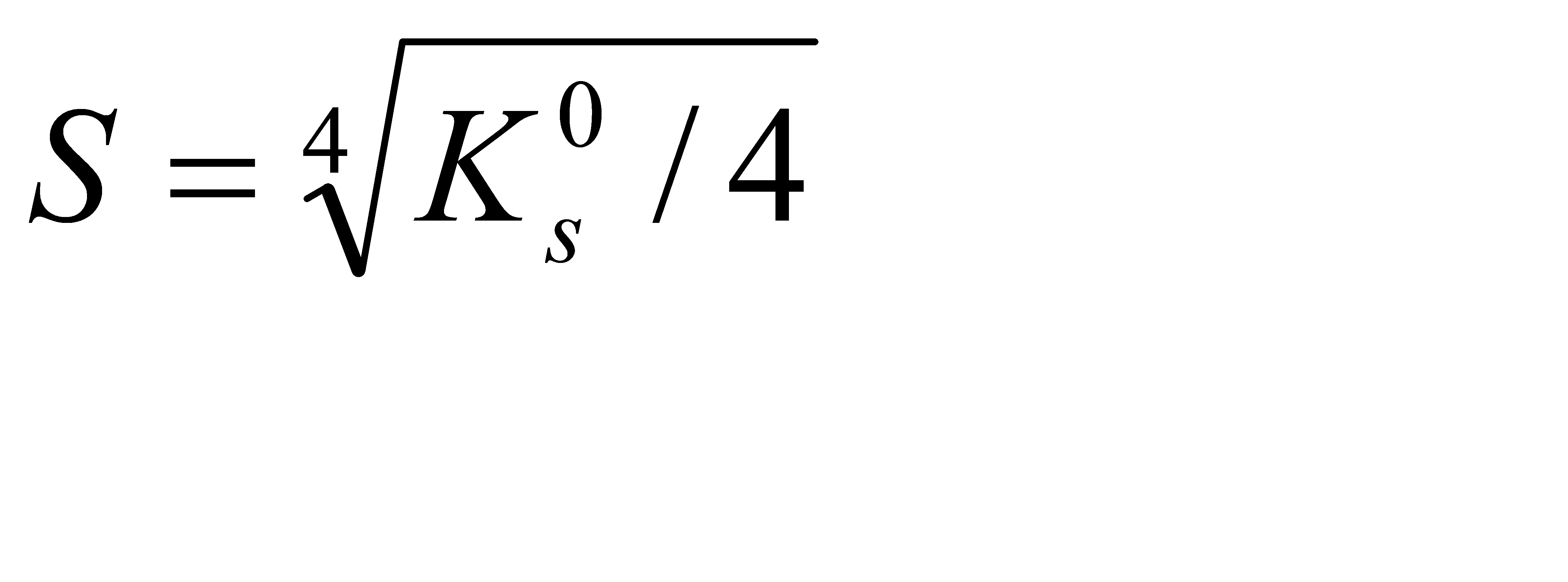 | |||
Подберите формулу, связывающую растворимость фосфата лития с его произведением растворимости: 1) 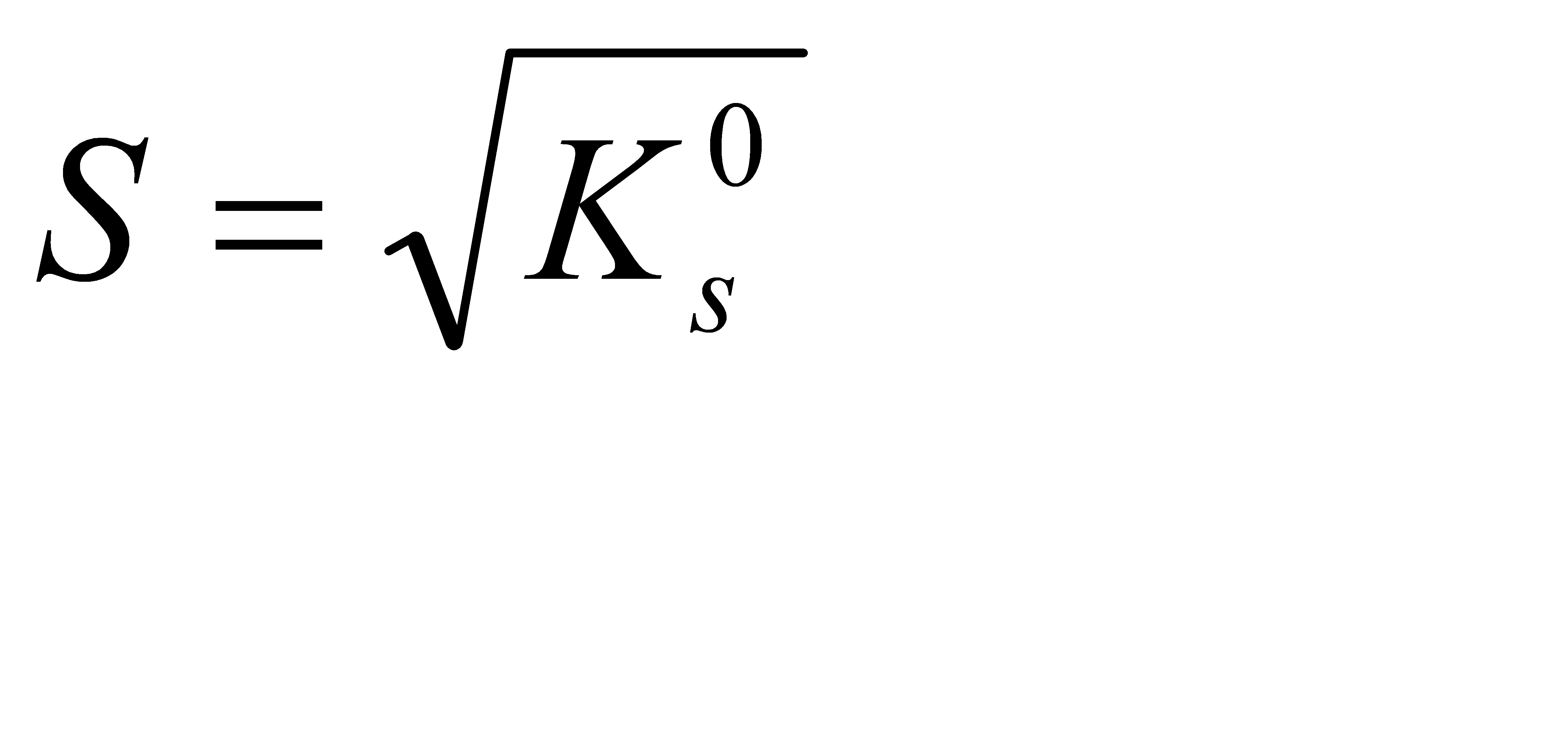 2) 2)  3) 3)  4) 4) 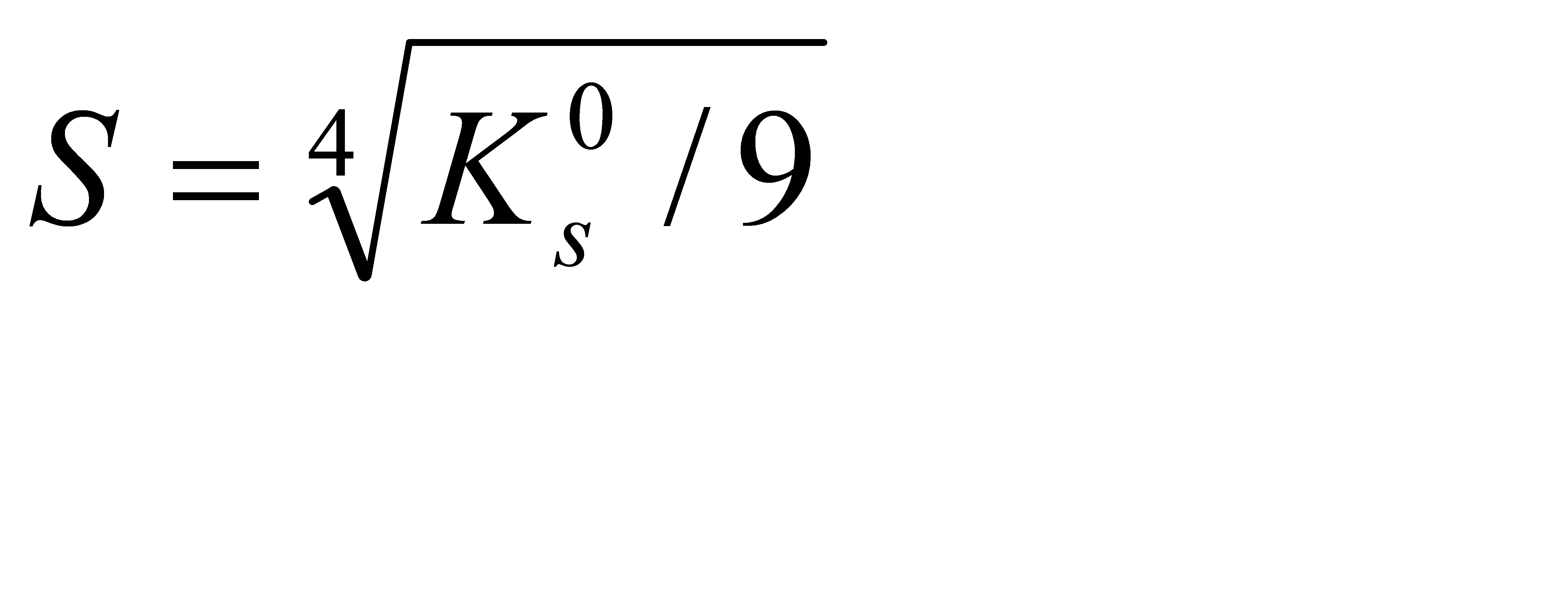 5) 5) 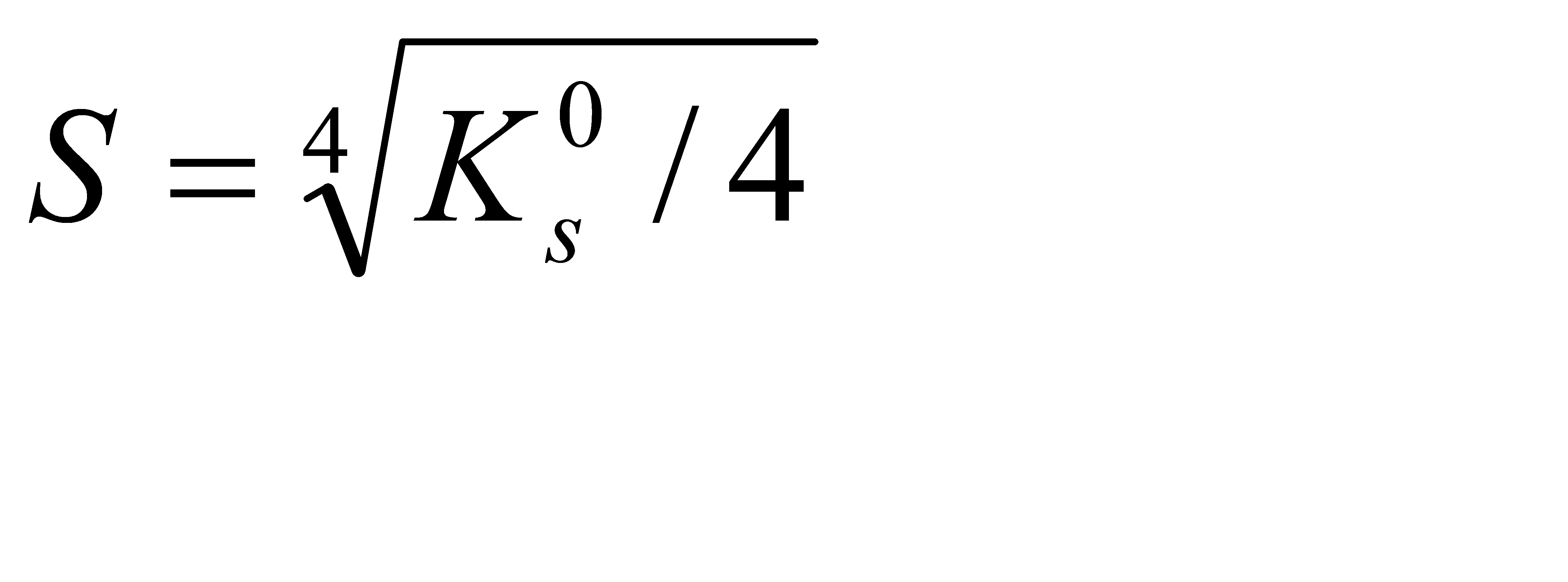 | |||
Подберите формулу, связывающую растворимость алюминия гидроксида с его произведением растворимости: 1) 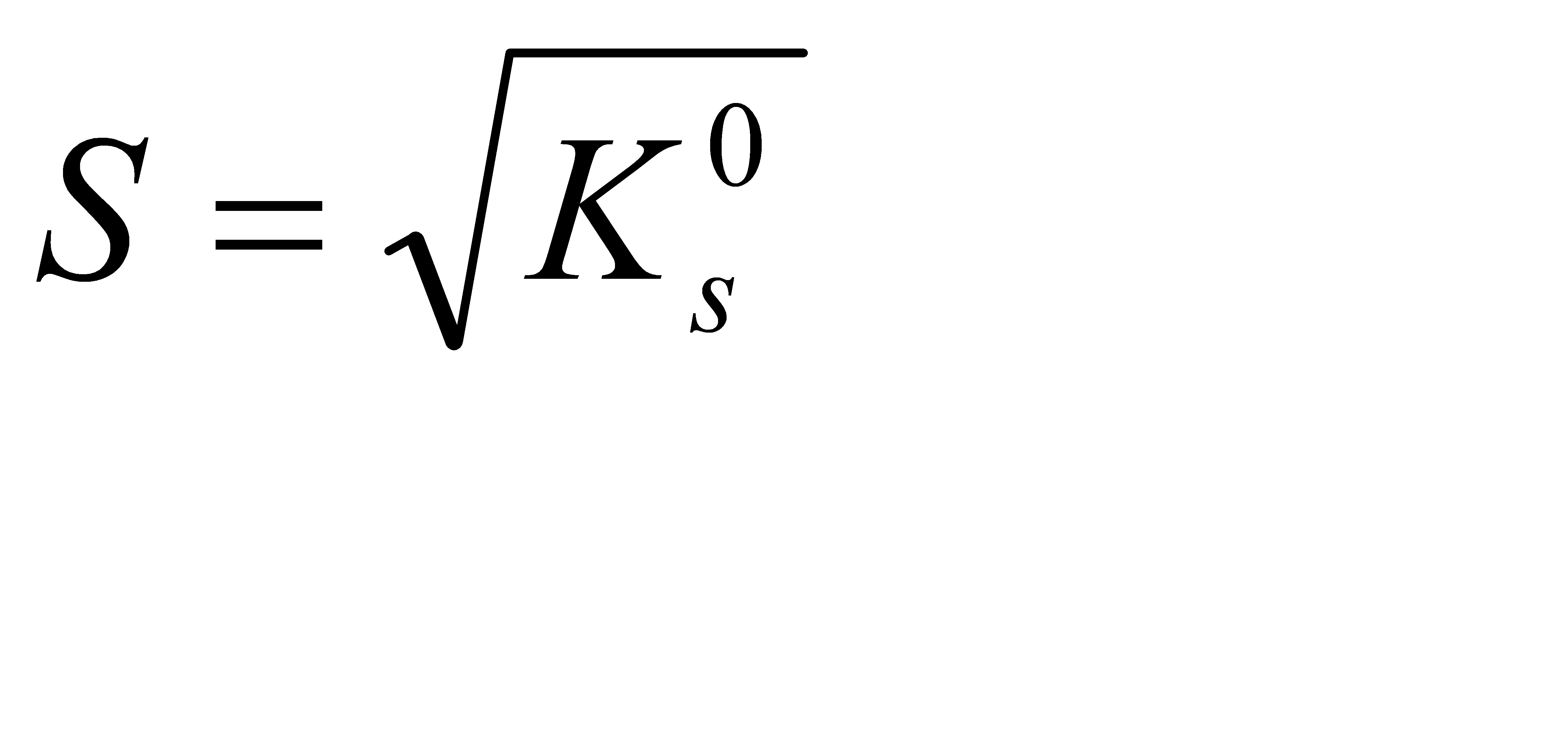 2) 2) 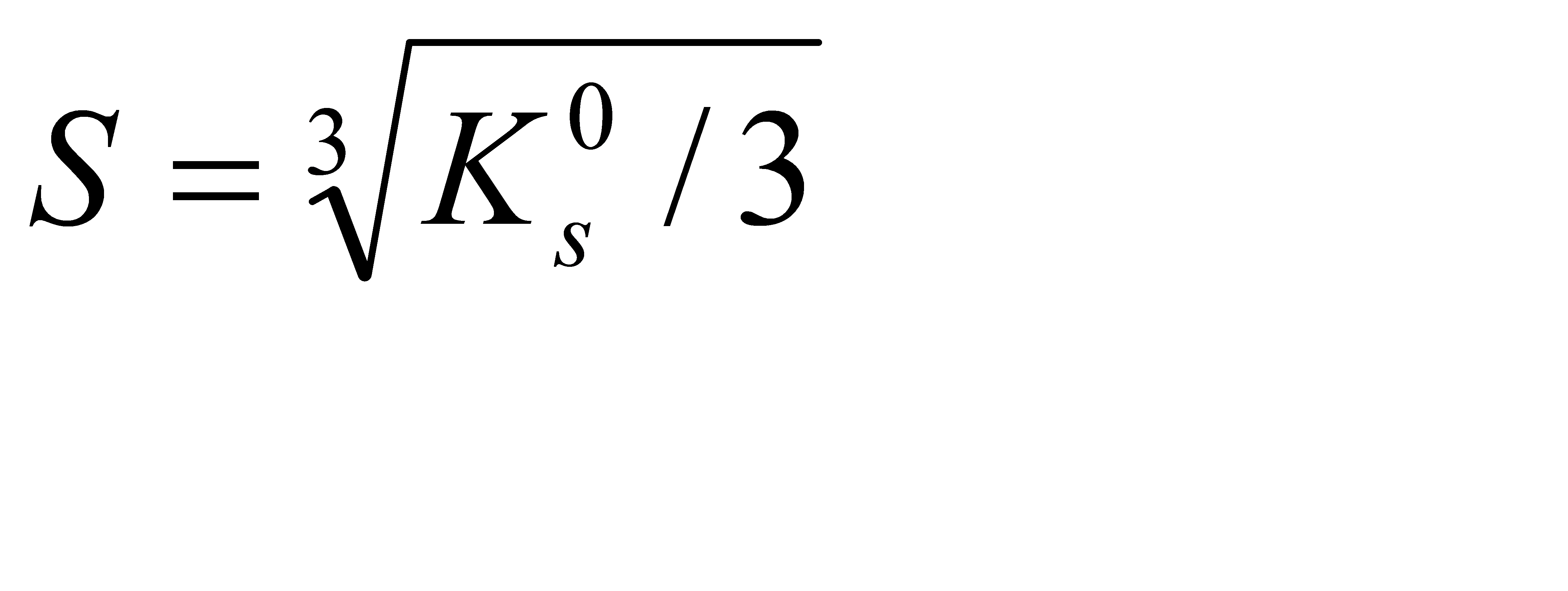 3) 3)  4) 4) 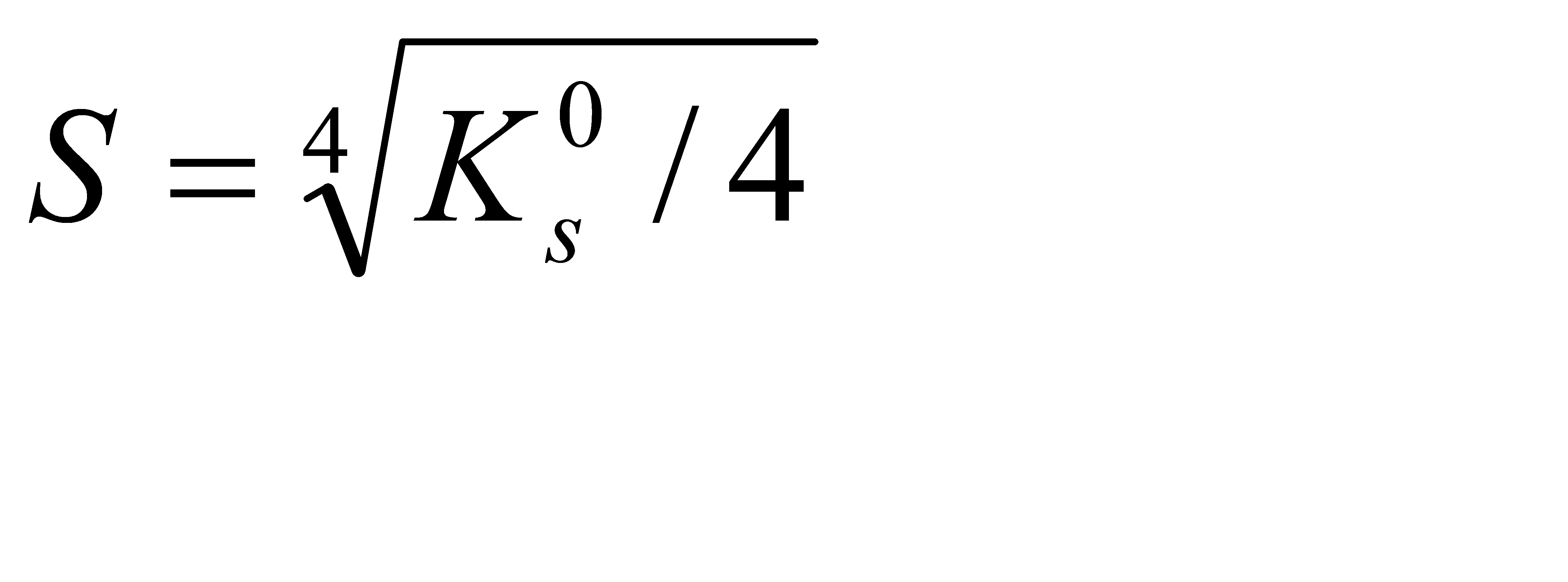 5) 5) 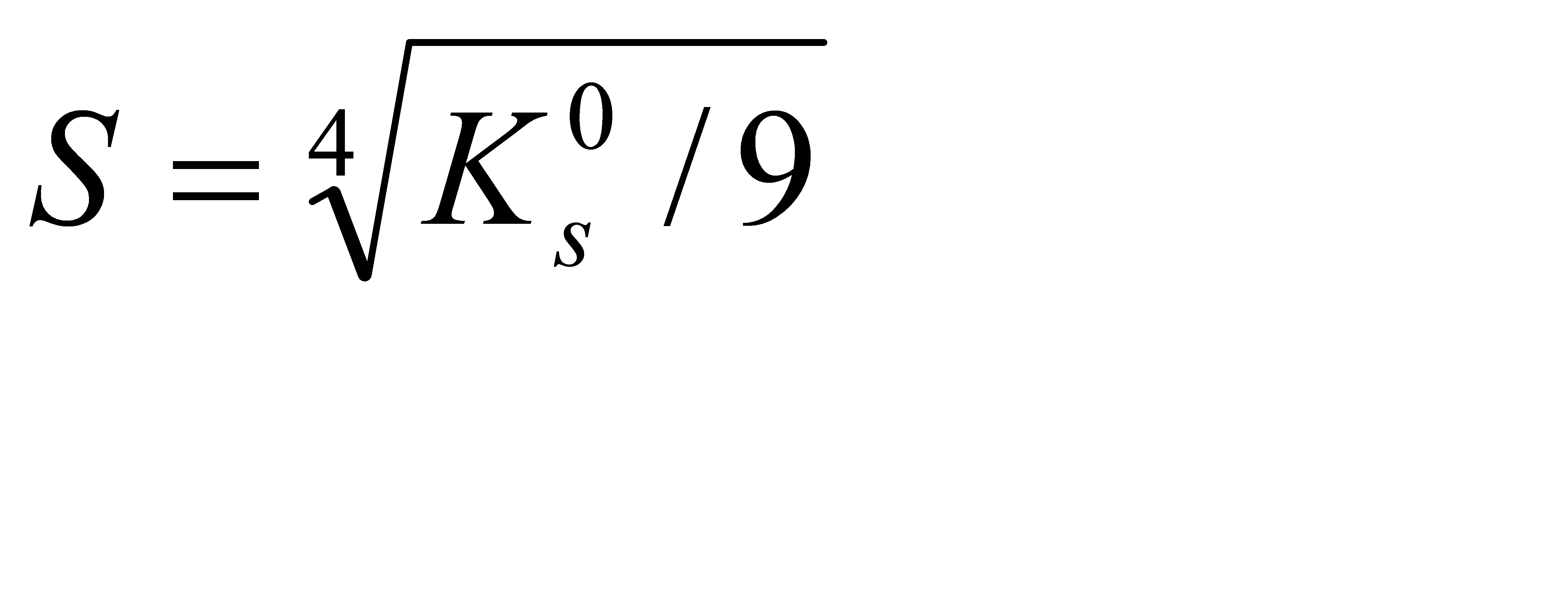 | |||
| При добавлении раствора серебра нитрата к разбавленному раствору калия хромата осадок серебра хромата образуется если: 1) С(AgNO3) > C(K2CrO4) 2) C(Ag+) = C(CrO42–) 3) C(Ag+)·C(CrO42–) = Ksº(Ag2CrO4) 4) C2(Ag+)·C(CrO42–) > Ksº(Ag2CrO4) 5) C(Ag+)·C(CrO42–) < Ksº(Ag2CrO4) | 4? | ||
| При добавлении раствора цинка нитрата к разбавленному раствору калия фосфата осадок цинка фосфата образуется если: 1) С(Zn(NO3)2) > C(K3PO4) 2) C2(Zn2+)·C3(PO43–) > Ksº(Zn3(PO4)2) 3) C(Zn2+)·C(PO43–) = Ksº(Zn3(PO4)2) 4) C3(Zn2+)·C2(PO42–) > Ksº(Zn3(PO4)2) 5) C3(Zn2+)·C2(PO42–) < Ksº(Zn3(PO4)2) | 4? | ||
| При добавлении раствора бария нитрата к разбавленному раствору калия фосфата осадок бария фосфата образуется если: 1) С(Ва(NO3)2) > C(K3PO4) 2) C(Ва2+)·C(PO43–) = Ksº(Ва3(PO4)2) 3) C3(Ва2+)∙C2(PO43–) < Ksº(Ва3(PO4)2) 4) C3(Ва2+)·C2(PO43–) > Ksº(Ва3(PO4)2) 5) C(Ва2+)·C(PO43–) > Ksº(Ва3(PO4)2) | 4? | ||
| При добавлении раствора свинца нитрата к разбавленному раствору калия иодида осадок свинца иодида образуется если: 1) С(Рb(NO3)2)> C(KJ) 2) C( Рb 2+)·C(J–) = Ksº( РbJ2) 3) C(Pb2+) ·C2(J–)<Ksº( РbJ2) 4) C( Рb 2+)· C2(J–)> Ksº( РbJ2) 5) C2 ( Рb 2+)· C (J–)> Ksº( РbJ2) | 4? | ||
| При добавлении раствора висмута нитрата к разбавленному раствору калия иодида осадок висмута иодида образуется если: 1) C(Bi3+)3 ·C (J–)>Ksº( BiJ3) 2) C( Bi 3+)·C(J–) = Ksº( BiJ3) 3) C (Bi3+)·C3(J–)<Ksº( BiJ3) 4) C (Bi 3+)· C3(J–)>Ksº(Bi J3) 5) C3 (Bi 3+)· C (J–)>Ksº(Bi J3) | 4? | ||
| При добавлении раствора свинца нитрата к разбавленному раствору калия хлорида осадок свинца хлорида образуется если: 1) С(Рb(NO3)2)> C(KСl) 2) C( Рb 2+)·C(Cl–) = Ksº( РbCl2) 3) C(Pb2+) ·C2(Cl–)<Ksº( РbCl2) 4) C(Рb2+)· C2(Cl–)> Ksº( РbCl2) 5) C(Рb2+)· C2(Cl–)> Ksº( РbCl2) | 4? |
Тема 2: «Равновесия комплексообразования»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
| Лиганды для комплекса [Ag(NH3)2]Cl: 1) NH3 2) [Ag(NH3)2]+ 3) N 4) Cl– 5) Ag+ | |||
| Внутренняя сфера комплекса [Ag(NH3)2]Cl: 1) [Ag(NH3)2]+ 2) NH3 3) N 4) Cl– 5). Ag+ | |||
| Внешняя сфера комплекса [Ag(NH3)2]Cl: 1) Cl– 2) [Ag(NH3)2]+ 3) N 4) NH3 5) Ag+ | |||
| Координационное число комплексообразователя для комплекса [Ag(NH3)2]Cl: 1) 2 2) 4 3) 6 4) 3 5) 1 | |||
| Центральный атом (ион) комплексообразователь для комплекса [Ag(NH3)2]Cl: 1) Ag+ 2) [Ag(NH3)2]+ 3) N 4) Cl– 5) NH3 | |||
| Тип комплексных соединений, к которому относится гексанитрокупрат натрия и свинца: 1) внутрикомплексное соединение 2) гидроксокомплекс 3) ацидокомплекс 4) ацидоаминокомплекс 5) хелатный комплекс | |||
| Тип комплексных соединений, к которому относится продукт реакции тиоцианат-ионов с солями кобальта: 1) внутрикомплексное соединение 2) аминокомплекс 3) ацидокомплекс 4) хелатный комплекс 5) гидроксокомплекс | |||
| Тип комплексных соединений, к которому относится диметилглиоксимат никеля: 1) катионного типа 2). анионного типа 3) внутрикомплексное соединение 4). ацидоаминокомплекс 5) гидроксокомплекс | |||
| Дентатность – это: 1) число координационных связей, образуемых атомом металла-комплексообразователя с лигандами; 2) число координационных связей, образуемых одним лигандом с одним атомом металла-комплексообразователя; 3) число связей, образуемых внешней и внутренней сферами комплекса; 4) донорно-акцепторная связь металл-комплексообразователь – лиганд; 5) нет правильного ответа. | |||
| Из перечисленных ниже соединений выберите внутрикомплексное соединение: 1) Na2Pb[Cu(NO2)6] 2) 8-оксихинолинат цинка 3) [PtII(NH3)2Cl2] 4) бис(этилендиамин)платина(II) хлорид 5) К[Al(OH)4] | |||
| . Координационное число – это: 1) донорно-акцепторная связь между металлом-комплексообразователем и лигандом; 2) число координационных связей, образуемых атомом металла-комплексообразователя с лигандами; 3) число связей, образуемых внешней и внутренней сферами комплекса; 4) число координационных связей, образуемых одним и тем же лигандом с одним атомом металла-комплексообразователя; 5) нет правильного ответа. | |||
| Максимальную дентантность, равную шести, может проявлять лиганд: 1) аммиак 2) ЭДТА 3) цитрат 4) салицилат 5) этилендиамин | |||
| Максимальную дентантность, равную двум, может проявлять лиганд: 1) цианид 2) цитрат 3) этилендиамин 4) хлорид 5) аммиак | 3? | ||
| К катионным комплексам относится 1) H[AuCl4] 2) [Ni(CО)4] 3) K3[Fe(CN)6] 4) [Fe(CO)5] 5) [Cu(NH3)4]SO4 | 5? | ||
| К анионным комплексам относится 1) [Zn(NH3)4](NO3)2 2) K4[Fe(CN)6] 3) [Ni(CО)4] 4) [Pt(NH3)2Cl2] 5) [Cu(NH3)4]SO4 |
Тема 3: «Окислительно-восстановительные равновесия»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
Уравнение Нернста для пары NO3–|NO 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
Уравнение Нернста для пары MnO4–|Mn2+: 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
Уравнение Нернста для пары BrO3–|Br-: 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
Уравнение Нернста для пары H3AsO4|HAsO2: 1)  2) 2)  3). 3).  4) 4)  | |||
Уравнение Нернста для пары BrO3–|Br2: 1)  2) 2)  3) 3)  4). 4).  5) 5)  | |||
Уравнение Нернста для пары ClO4–|Cl- 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
Уравнение Нернста для пары Cr2O72–|2Cr3+: 1)  2) 2)  3) 3)  4). 4).  5) 5)  | |||
Уравнение Нернста для пары IO3–|I-: 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
Уравнение Нернста для пары IO3–|I2: 1)  2) 2)  3) 3)  4) 4)  5) 5)  | |||
| Значение редокс потенциала системы Ag+/Ago снизится, если 1) добавить серебро 2) увеличить температуру 3) добавить AgNO3 4) добавить КCl 5) добавить воду | |||
| Значение редокс потенциала системы Ag+/Ago возрастет, если 1) добавить серебро 2) увеличить температуру 3) добавить AgNO3 4) добавить KCl 5) добавить воду | |||
| Значение редокс потенциала системы Cu2+/Cuo не изменится, если 1) добавить медь 2) увеличить температуру 3) уменьшить температуру 4) добавить Cu(NO3)2 5) добавить аммиак | |||
| Значение редокс потенциала системы MnO4– +8Н+/Mn2++ 4Н2О возрастет, если 1) уменьшить температуру 2) увеличить температуру 3) добавить MnCl2 4) добавить KCl 5) добавить воду | |||
| Значение редокс потенциала системы BrO3– +6Н+/Br -+ 3Н2О возрастет, если 1) добавить H2SO4 2) уменьшить температуру 3) добавить NaNO3 4) добавить KBr 5) добавить воду | |||
| Значение редокс потенциала системы MnO4– +8Н+/Mn2++ 4Н2О снизится, если 1) добавить KCl 2) увеличить температуру 3) добавить MnCl2 4) добавить KMnO4 5) добавить H2SO4 |
Тема 4: «Методы разделения и концентрирования веществ в аналитической химии»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
| Осадочная хроматография по классификации, основанной на механизме разделения веществ, относится к: 1) адсорбционной хроматографии 2) распределительной хроматографии 3) ионообменной хроматографии 4). гель-хроматографии 5) хемихроматографии | |||
| Метод бумажной хроматографии по классификации, основанной на технике эксперимента , относится к: 1) колоночной хроматографии 2) капиллярной хроматографии 3) фронтальной хроматографии 4) вытеснительной хроматографии 5) плоскостной хроматографии | |||
| Тонкослойная хроматография по классификации, основанной на механизме разделения веществ, относится к: 1) ионообменной хроматографии 2) распределительной хроматографии 3) гель-хроматографии 4) хемихроматографии 5) адсорбционной хроматографии | 5? | ||
| Метод бумажной хроматографии по классификации, основанной на механизме разделения веществ, относится к : 1) адсорбционной хроматографии 2) ситовой хроматографии 3) ионообменной хроматографии 4) осадочной хроматографии 5) распределительной хроматографии | |||
| Метод тонкослойной хроматографии по классификации, основанной на технике эксперимента, относится: 1) колоночной хроматографии 2) капиллярной хроматографии 3) фронтальной хроматографии 4) вытеснительной хроматографии 5) плоскостной хроматографии | |||
| Рассчитайте коэффициенты подвижности для аланина и фенилаланина по следующим хроматографическим данным: расстояние от линии старта до линии финиша составляет 50 мм, расстояние от линии старта до середины пятна аланина – 35 мм, расстояние от линии старта до центра пятна фенилаланина – 25 мм, расстояние от линии старта до центра пятна стандартного вещества – 40 мм. 1) 1,1; 1,6 2) 0,88; 0,63 3) 1,4; 2,0 4).0,70; 0,50 5) 2,0;1,4 | |||
| Смесь дипразина (I) и динезина (II) разделили в тонком слое сорбента, при этом получили следующие результаты: расстояние от линии старта до центра пятен (I) и (II) соответственно равны 58 мм и 76 мм. Расстояние от линии старта до линии финиша 110 мм. Рассчитайте коэффициенты подвижности для дипразина и динезина. 1) 0,76; 1,00 2) 1,31; 1,00 3) 1,72; 1,1,32 4) 0,53; 0,69 5) 1,90; 1,45 | 1,89 и 1,44 (5) | ||
| Рассчитайте коэффициенты подвижности для катионов Cu2+ и Mn2+ по следующим хроматографическим данным: расстояние от линии старта до линии финиша составляет 60 мм, расстояние от линии старта до середины пятна Cu2+ – 44 мм, расстояние от линии старта до центра пятна Mn2+– 19 мм, расстояние от линии старта до центра пятна стандартного вещества – 30 мм. 1) 1,47; 0,63 2) 0,88; 0,63 3) 1,00; 0,43 4) 0,73; 0,32 5)1,36; 3,16 | |||
| Рассчитайте относительные коэффициенты подвижности для аланина и фенилаланина по следующим хроматографическим данным: расстояние от линии старта до линии финиша составляет 80 мм, расстояние от линии старта до середины пятна аланина – 56мм, расстояние от линии старта до центра пятна фенилаланина – 32 мм, расстояние от линии старта до центра пятна стандартного вещества – 40 мм. 1) 1,0; 0,6 2) 0,7; 0,4 3) 0,7; 1,3 4) 1,4; 0,8 5) 0,7; 1,25 | |||
| Рассчитайте Rf и Rs для фенола по следующим хроматографическим данным: расстояние от линии старта до линии финиша составляет 50 мм, расстояние от линии старта до середины пятна фенола – 27 мм, расстояние от линии старта до центра пятна стандартного вещества – 20 мм. 1) 0,27; 0,20 2) 1,35; 0,54 3) 1,85; 2,50 4). 054; 1,35 5) 2,50;1,85 |
Тема 5: «Качественный анализ катионов и анионов»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на соль концентрированной серной кислоты выделяется газ с едким запахом. При проведении реакции с цинкуранилацетатом образуются желтые кристаллы тетраэдрической формы. При взаимодействии раствора соли с раствором серебра нитрата образуется белый творожистый осадок, растворимый в насыщенном растворе аммония карбоната. Определите состав соли. 1) NaCL 2) Na2SO3 3) NH4 NO3 4) KBr 5) NaNO3 | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на раствор соли раствора натрия гидроксида образуется белый осадок, растворимый в избытке реагента. При добавлении к раствору соли раствора бария хлорида наблюдают образование белого осадка, нерастворимого в соляной кислоте. При проведении капельной реакции с ализарином получается красное пятно на фильтровальной бумаге. Определите состав соли. 1) Al2(SO4)3 2) MnCl2 3) ZnSO4 4) Mn(NO3)2 5) Al(NO3)3 | 1??? | ||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на соль концентрированной серной кислоты выделяется газ с резким запахом. При действии на раствор соли натрия гидроксида и водорода пероксида образует бурый осадок. При действии на раствор соли азотной кислоты и твердого натрия висмутата появляется малиновое окрашивание. После осаждения катиона методом «содовой вытяжки» к полученному центрифугату после подкисления добавили раствор серебра нитрата. Образовался белый осадок, растворимый в концентрированном растворе аммиака. Определите состав соли. 1) MnCl2 2) MgCl2 3) SrCl2 4) Mn(NO3)2 5) NaNO2 | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на соль концентрированной серной кислоты выделяется бесцветный газ без запаха. При действии на раствор соли разбавленными кислотами и раствором NaOH осадка не наблюдали. При действии на раствор соли реактивом Несслера наблюдали образование бурого осадка. При добавлении к раствору соли раствора бария хлорида наблюдали образование белого осадка, растворимого в уксусной кислоте. Определите состав соли. 1) (NH4)2CO3 2) K2CO3 3) ZnSO3 4) Na2C2O4 5) NaCL | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При добавлении к отдельным порциям раствора соли раствора бария хлорида и раствора серебра нитрата в присутствии азотной кислоты не наблюдали образование осадков. Раствор соли с цинкуранилацетатом образует желтые кристаллы тетраэдрической формы, а с антипирином в кислой среде – красное окрашивание. Определите состав соли. 1) NaNO3 2) BaSO3 3) LiCl 4) NaNO2 5) NaCH3COO | 3?? | ||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При добавлении к отдельным порциям раствора соли разбавленных соляной и серной кислот, растворов NaOH, бария хлорида, серебра нитрата, осадки не образуются. При действии на раствор соли реактивом Несслера наблюдали выпадение бурого осадка. При проведении реакции с антипирином в кислой среде наблюдали образование красного окрашивания. Определите состав соли. 1) NH4NO3 2) КNO3 3) NaCl 4) NH4СН3СОО 5) NaNO2 | |||
| Для анализа дана соль темно-розового цвета, хорошо растворимая в воде. При взаимодействии раствора соли с аммиаком образуется синий осадок, растворимый в избытке реактива с образованием грязно-желтого раствора. После осаждения катиона методом «содовой вытяжки» к отдельным порциям центрифугата после подкисления добавили растворы бария хлорида и серебра нитрата. Образование осадков не наблюдали. При проведении реакции с антипирином в кислой среде раствор окрасился в красный цвет. Определите состав соли. 1) Co(NO3)2 2) CuCl2 3) Co(СН3СОО)2 4) FeSO4 5) MnCl2 | |||
| Для анализа дана соль зеленого цвета, хорошо растворимая в воде. При взаимодействии раствора соли с диметилглиоксимом образуется розово-красный осадок. После осаждения катиона методом «содовой вытяжки», к полученному подкисленному центрифугату добавили раствор серебра нитрата, наблюдали образование белого творожистого осадка, растворимого в насыщенном растворе аммония карбоната. Определите состав соли. 1) NiCl2 2) MnSO4 3) CuCl2 4) KBr 5) Ni(NO3)2 | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на раствор соли раствора натрия гидроксида образуется белый осадок, растворимый в избытке реагента. При проведении реакции раствора соли с дитизоном наблюдали окрашивание органического слоя в красный цвет. При добавлении к раствору соли хлорида железа(III) наблюдали окрашивание раствора в красно-коричневый цвет. Определите состав соли. 1) Zn(CH3COO)2 2) NaBr 3) Al(NO3)3 4) MgCl2 5) KSCN | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. Соль окрашивает пламя газовой горелки в бледно-фиолетовый цвет. При действии на соль концентрированной серной кислоты выделяется газ бурого цвета с резким запахом. При действии на раствор соли хлорной воды и хлороформа хлороформный слой окрашивается в оранжевый цвет. Определите состав соли: 1) KBr 2) CaCl2 3) SrCl2 4) KNO2 5) NaI | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. Соль окрашивает пламя газовой горелки в бледно-фиолетовый цвет. При действии на раствор соли хлорной воды и хлороформа хлороформный слой окрашивается в малиново-фиолетовый цвет. Определите состав соли. 1) KI 2) NH4 SCN 3) KBr 4) NaI 5) KSCN | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. Соль окрашивает пламя газовой горелки в карминово-красный цвет. При действии на соль концентрированной серной кислоты выделяется газ с едким запахом. При взаимодействии раствора соли с разбавленной серной кислотой наблюдали образование белого осадка. При добавлении к раствору соли раствора серебра нитрата образуется белый творожистый осадок, растворимый в насыщенном растворе аммония карбоната. Определите состав соли. 1) SrCl2 2) NaNO 2 3) MgCl2 4) Ca(NO3) 2 5) LiCl | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. При действии на соль концентрированной серной кислоты выделяется газ бурого цвета с резким запахом. При добавлении к раствору соли раствора аммония оксалата образуется белый осадок, нерастворимый в уксусной кислоте. При проведении реакции с дифениламином наблюдали окрашивание раствора в фиолетовый цвет. Определите состав соли. 1) Ca(NO3) 2 2) NaNO2 3) КBrО3 4) MgCl2 5) SrBr2 | |||
| Для анализа дана соль белого цвета, хорошо растворимая в воде. Соль окрашивает пламя газовой горелки в карминово-красный цвет. При действии на раствор соли соляной и серной кислотами, а также раствором натрия гидроксида образование осадков не наблюдали. При добавлении к раствору соли раствора бария хлорида образовался белый осадок, нерастворимый в соляной кислоте. Определите состав соли. 1) Li2SO4 2) Ca(NO3) 2 3) SrCl2 4) (NH4 )2CO3 5) LiNO3 | |||
| Для анализа получен бесцветный раствор без осадка. При добавлении к анализируемому раствору разбавленных минеральных кислот наблюдали выделение бесцветного газа, который при пропускании через известковую воду вызывал ее помутнение. При взаимодействии с раствором натрия и свинца гексанитрокупрата наблюдали образование кубических кристаллов черного цвета. При добавлении раствора бария хлорида образовался осадок, растворимый в соляной и уксусной кислотах. При добавлении подкисленного раствора перманганата обесцвечивание раствора не наблюдали. Анализируемый раствор содержит: 1) K+ CH3COO- ; 2) K+ CO32- ; 3) NH4+ CH3COO- ; 4) Na+ NO2 ; 5) K+ SO32- | |||
| Для анализа получен бесцветный раствор без осадка. При добавлении к анализируемому раствору натрия гидроксида и водорода пероксида выпал бурый осадок, нерастворимый в избытке щелочи и аммиака. При добавлении к подкисленному азотной кислотой анализируемому раствору нескольких крупинок натрия висмутата наблюдали окрашивание раствора в малиновый цвет. После операции «содовой вытяжки» к нейтрализованному уксусной кислотой раствору добавили раствор ВаCl2 – образовался осадок, нерастворимый в разбавленной соляной кислоте. Анализируемый раствор содержит: 1) Fe2+ SO32- ; 2) Mn2+ SO42- ; 3) Cd2+ SO42- ; 4) Mn2+ NO3- 5) Fe2+ NO3- | |||
| Для анализа получен бесцветный раствор без осадка. При добавлении к анализируемому раствору разбавленных минеральных кислот наблюдали образование белого осадка. Осадок, полученный при взаимодействии с серной кислотой, растворился при нагревании в насыщенном растворе аммония ацетата. При добавлении к исходному анализируемому раствору калия дихромата образовался осадок желтого цвета. При добавлении FeCl3 раствор окрасился в темно красный цвет, а при кипячении выпал хлопьевидный осадок. Анализируемый раствор содержит: 1) Ca2+ CH3COO- ; 2) Pb2+ CH3COO- ; 3) Ba2+ CH3COO-; 4) Ca2+ NO3- ; 5) Pb2+ NO3- | |||
| Для анализа получен бесцветный раствор без осадка. При добавлении реактива Несслера наблюдали выпадение бурого осадка. В реакции с нитратом серебра в присутствии азотной кислоты наблюдали выпадение белого осадка, нерастворимого в насыщенном растворе карбоната аммония. При добавлении FeCl3 раствор окрасился в кроваво- красный цвет. Анализируемый раствор содержит: 1) K+ CH3COO- ; 2) NH4+ SCN- ; 3) K+ CO32- ; 4) Na+ SCN- ; 5) Na+ I- | |||
| Для анализа дан бесцветный прозрачный раствор. С отдельными порциями раствора провели следующие испытания: - при действии раствора K[Sb(OH)6] образовались белые кристаллы чечевицеобразной формы, - при действии раствора цинкуранилацетата образовались кристаллы желтого цвета октаэдрической формы, - при действии нитрата серебра образовался белый осадок, который растворился в аммиаке. Анализируемый раствор содержит: 1) Na+ I– 2) Na+ Cl– 3) K+ Br– 4) Li+ Cl– 5) NH4+ NO3– | |||
| Для анализа дан бесцветный прозрачный раствор. С отдельными порциями раствора провели следующие испытания: - при действии 2 моль/л раствора соляной кислоты образовался белый осадок, - при действии 2 моль/л раствора серной кислоты образовался белый осадок, который растворился в щелочи, - с раствором хлорида железа(III) появилось красно-коричневое окрашивание, а при кипячении выпал хлопьевидный осадок. Анализируемый раствор содержит: 1) Na+ SCN– 2) Pb2+ CH3COO– 3) K+ NO2– 4) Ag+ NO3– 5) Li+ Cl– | |||
| Для анализа дан розовый прозрачный раствор. С отдельными порциями раствора провели следующие испытания: - при действии аммиака образовался синий осадок, который растворился в избытке реактива с образованием грязно-желтого раствора, - при действии KNCS в слабо кислой среде наблюдалось изменение окраски раствора в синий цвет, - при действии нитрата серебра образовался белый осадок, который растворился в аммиаке. Анализируемый раствор содержит: 1) Zn2+ Cl– 2) Со2+ Cl– 3) Cu2+ I– 4) Ni2+ CH3COO– 5) NH4+, NO3– | |||
| Для анализа дан желтый прозрачный раствор. С отдельными порциями раствора провели следующие испытания: - при действии раствора гексацианоферрата (II) калия образовался темно-синий осадок «берлинской лазури», - при действии раствора тиоцианата калия появилось кроваво-красное окрашивание, - при действии нитрата серебра образовался осадок, который полностью растворился в концентрированном аммиаке. В растворе могли присутствовать ионы: 1) Na+ Cl– 2) Fe3+ Cl– 3) K+ Br– 4) Al3+ NO3– 5) Cо2+ CH3COO– | |||
| Для анализа дан бесцветный прозрачный раствор. С отдельными порциями раствора провели следующие испытания: - действие натрия гексанитрокобальтата привело к образованию желтого осадка, - при действии нитрата серебра образовался желтый осадок, - при прибавлении хлорной воды и хлороформа органический слой окрасился в фиолетовый цвет. В растворе могли присутствовать ионы: 1) NH4+ I– 2) K+ I– 3) К+ Br– 4) NH4+ SCN– 5) Na+ CH3COO– |
Тема 6: «Гравиметрический анализ»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
| В качестве осаждаемой формы при гравиметрическом определении железа(III) используется: 1) Fe2O3 2) Fe(OH)3 3) Fe2(SO4)3 4) Fe(SCN)3 5) FeCl3 | |||
| В качестве осаждаемой формы при гравиметрическом определении сульфат-ионов используется: 1) CaSO4 2) BaSO4 3) SrSO4 4) PbSO4 5) FeSO4 | |||
| Укажите гравиметрическую форму для определения ионов бария : 1) BaCO3 2) BaO 3) BaSO4 4) BaF2 5) BaC2O4 | |||
| При гравиметрическом определении серной кислоты ее осаждают раствором: 1) Ca(OH)2 2) AgNO3 3) BaCl2 4) FeCl3 5) SrCl2 | |||
| При гравиметрическом определении ионов бария их осаждают раствором: 1) NaOH 2)AgNO3 3) H2SO4 4) HCl 5) NH3 .H2O | |||
| Оптимальная масса гравиметрической формы при получении кристаллической осаждаемой формы равна: 1) 0,1 г 2) 0,02 г 3) 0,03 г 4) 0,5 г 5) 1,0 г | |||
| Оптимальная масса гравиметрической формы при получении аморфных осадков равна: 1) 0,5 г 2) 0,02 г 3) 0,03 г 4) 0,1 г 5) 1,0 г | |||
| При гравиметрическом определении серной кислоты операция прокаливания осадка бария сульфата проводится: 1) в тигле в сушильном шкафу 2) в тигле в муфельной печи 3) в тигле в эксикаторе 4) в химическом стакане 5) в тигле над пламенем горелки | |||
| Укажите условие, не используемое при осаждении кристаллических осадков: 1) осаждение проводят из разбавленного анализируемого раствора разбавленным раствором осадителя 2) осаждение проводят из горячего анализируемого раствора горячим раствором осадителя; 3) раствор осадителя добавляют медленно , при постоянном перемешивании; 4) осаждение проводят в присутствии веществ, понижающих растворимость осадка; 5) осадок оставляют в маточном растворе для созревания | |||
| Укажите условие, не рекомендуемое при осаждении аморфных осадков: 1) осаждение проводят из концентрированного анализируемого раствора концентрированным раствором осадителя; 2) осаждение проводят из горячего анализируемого раствора горячим раствором осадителя; 3) осаждение проводят в присутствии электролитов-коагулянтов; 4) раствор осадителя добавляют медленно, при постоянном перемешивании; 5) осадок сразу фильтруют. |
Тема 7: «Химические титриметрические методы анализа»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ
| № ОС | Задание | Ответ | Номер компетенции |
| Укажите титрант метода ацидиметрии 1) раствор Н2SO4; 2) раствор КОН; 3) раствор Н3РО4; 4) раствор СН3СООН 5) раствор ЭДТА | |||
| Укажите титрант метода алкалиметрии 1) раствор Н2SO4; 2) раствор КОН; 3) раствор NH4OH 4) раствор СН3СООН 5) раствор ЭДТА | |||
| Укажите титрант метода иодометрии: 1) раствор Na2S2O3 2) раствор I2; 3) раствор KI; 4) раствор KIO3 5) раствор ICl | |||
| Укажите титрант метода иодиметрии: 1) раствор Na2S2O3 2) раствор I2; 3) раствор KI; 4) раствор KIO3 5) раствор ICl | |||
| Укажите реагент, который непосредственно взаимодействует с определяемым веществом в методе бромометрии: 1) Br2 2) I2; 3) KBr 4) КBrO3 5) ICl | |||
| Укажите, в каком случае реакция среды в точке эквивалентности будет нейтральной: 1) при титровании NH3 . H2O раствором HCl; 2) при титровании Na2B4O7 раствором HCl; 3) при титровании HCOOH раствором KOH; 4) при титровании Н2SO4 раствором KOH. 5) при титровании Na2CO3 раствором Н2SO4 | |||
| Укажите титрант метода комплексонометрии: 1) раствор ЭДТА; 2) раствор Hg(NO3)2.; 3) раствор K4[Fe(CN)6]; 4) раствор Hg(CN)2; 5) раствор КSCN; | |||
| При титровании аммиака раствором HCl среда в точке эквивалентности: 1) Сильнокислая; 2) Сильнощелочная; 3) Нейтральная 4) Слабощелочная 5) Слабокислая | |||
| Укажите титрант метода Мора: 1) раствор АgNO3; 2) раствор КSCN; 3) раствор Hg2(NO3)2; 4) раствор NaCl 5) раствор K4[Fe(CN)6 | |||
| Выберите стандартное вещество для стандартизации титранта НСl: 1) Na2S2O3; 2) Na2C2O4; 3) Na2Cr2O7; 4) Na2CO3.; 5) NH4OH | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации титранта KMnO4: 1) Na2S2O3; 2) Na2Cr2O7; 3) CaCO3; 4) Na2C2O4· 5) Na2B4O7 | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации титранта I2: 1) Na2В4O7·10Н2О; 2) Na2Cr2O7; 3) H2C2O4·2Н2О; 4) As2O3.; 5) CaCO3. | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации титранта Na2S2O3: 1) Na2В4O7·10Н2О; 2) Na2Cr2O7; 3) H2C2O4·2Н2О; 4) As2O3.; 5) CaCO3. | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации титранта NaNO2: 1) Na2В4O7·10Н2О; 2) I2; 3) H2C2O4·2Н2О; 4) Na2SO3 5) сульфаниловая кислота. | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации титранта ICl : 1) стандартный раствор Na2S2O3; 2) I2; 3) H2C2O4·2Н2О; 4) Na2SO3 5) сульфаниловая кислота. | |||
| Укажите, какое стандартное вещество или стандартизованный раствор можно использовать для стандартизации раствора ЭДТА: 1) раствор серебра нитрата; 2). раствор калия перманганата; 3). раствор натрия хлорида; 4). раствор магния сульфата; 5) раствор сульфаниловой кислоты. | |||
| Перманганатометрическое титрование натрия оксалата проводят: 1) при рН = 7 и нагревании раствора определяемого вещества до 700 С; 2) при рН = 10 и нагревании раствора определяемого вещества до 700 С; 3) при рН = 1 и нагревании раствора определяемого вещества до 700 С; 4) при рН = 1 и комнатной температуре; 5) при рН = 10 и комнатной температуре | |||
| Укажите характер индикатора, применяемого в методе броматометрии: 1) необратимый окислительно-восстановительный; 2) адсорбционный; 3) обратимый окислительно-восстановительный; 4) металлохромный; 5) осадительный | |||
| Укажите характер индикатора, применяемого в методе иодометрии 1) необратимый окислительно-восстановительный; 2) адсорбционный; 3) обратимый окислительно-восстановительный; 4) металлохромный; 5) осадительный. | |||
| Укажите характер индикатора, применяемого в методе иодиметрии 1) необратимый окислительно-восстановительный; 2) адсорбционный; 3) обратимый окислительно-восстановительный; 4) металлохромный;. 5) осадительный | |||
| Укажите характер индикатора, применяемого в методе перманганатометрии 1) необратимый окислительно-восстановительный; 2) индикатором служит сам титрант; 3) обратимый окислительно-восстановительный; 4) металлохромный. 5) осадительный | |||
| Укажите характер индикатора, применяемого в методе Мора: 1) необратимый окислительно-восстановительный; 2) адсорбционный; 3) обратимый окислительно-восстановительный; 4) металлохромный; 5) осадительный | |||
| При титровании уксусной кислоты раствором KOH среда в точке эквивалентности: 1) Сильнокислая; 2) Сильнощелочная; 3) Нейтральная 4) Слабощелочная 5) Слабокислая | |||
| Броматометрическое титрование Sb (III) проводят в условиях: 1) 1 моль/л раствора хлороводородной кислоты, при комнатной температуре раствора, проводят холостое титрование; 2) раствора натрия гидрокарбоната, при нагревании раствора определяемого вещества до 600 С; 3) 1 моль/л раствора хлороводородной кислоты, при нагревании раствора определяемого вещества до 600 С, проводят холостое титрование; 4) в нейтральной среде, при комнатной температуре. 5) в нейтральной среде, при нагревании до 600 С. | |||
| Иодометрическое титрование дихромат ионов проводят при следующих условиях: 1) в сильнокислой среде, в качестве индикатора используют крахмал, который добавляют в начале титрования; 2) в нейтральной среде, в качестве индикатора используют крахмал, который добавляют в конце титрования; 3) в кислой среде, в качестве индикатора используют крахмал, который добавляют в конце титрования; 4) в щелочной среде в качестве индикатора используют крахмал, который добавляют в конце титрования. 5) в нейтральной среде в качестве индикатора используют крахмал, который добавляют в начале титрования. | |||
| Определение натрия карбоната методом ацидиметрического титрования проводят: 1) при нагревании раствора определяемого вещества до 700 С, 2) прямым титрованием раствором кислоты с использованием последовательно двух индикаторов - метилового оранжевого и фенолфталеина, 3) прямым титрованием раствором кислоты с применением в качестве индикатора или метилового оранжевого или фенолфталеина, 4) обратным титрованием раствором кислоты с применением в качестве индикатора фенолфталеина; 5) прямым титрованием раствором кислоты с применением в качестве индикатора эозина и при комнатной температуре. |
Тема 8: «Физико -химические методы исследования»
Тестовые задания с выбором одного или нескольких правильных ответов
ВЫБЕРИТЕ ОДИН или нескольких правильных ответов
