Водородный показатель кислотности и щелочности водных растворов. Ионное произведение воды. Растворимость
Для выражения кислотности или щелочности раствора используют величину водородного показателя (рН), равную отрицательному десятичному логарифму концентрации ионов водорода [H+]:
рН = –lg[H+], где [H+] = СМ(Н+) моль/л.
По характеру среды растворы можно подразделить на: кислые(растворы, в которых [H+] >10-7 моль/л), щелочные(растворы, в которых [H+] < 10-7 моль/л)и нейтральные (растворы, в которых [H+] = 10-7 моль/л).
Таблица 16
Величина рН раствора, зависящая от характера среды раствора
| Характер среды (раствора) | Величина рН | Равновесная концентрация, [Н+], моль/л |
| кислая | < 7 | > 10-7 |
| нейтральная | ~ 7 | ~ 10-7 |
| щелочная | > 7 | < 10-7 |
Реакцию среды возможно определить при помощи специальных реактивов, или индикаторов, окраска которых меняется в зависимости от концентрации ионов водорода (таблица 17).
Для воды и разбавленных водных растворов при Т=const:
[Н+]∙[ОН-] = const = Kв, где Kв – ионное произведение воды.
Таблица 17
Важнейшие индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый оранжевый | красный (рН < 3,1) | оранжевый (3,1 < рН < 4,4) | желтый (рН > 4,4) |
| Метиловый красный | красный (рН < 4,2) | оранжевый (4,2 < рН < 6,3) | желтый (рН > 6,3) |
| Фенолфталеин | бесцветный (рН < 8,0) | бледно-малиновый (8,0 < рН < 9,8) | малиновый (рН > 9,8) |
| Лакмус | красный (рН < 5,0) | оранжевый (5,0 < рН < 8,0) | желтый (рН > 8,0) |
При Т = 298К (25°С) для чистой воды [Н+] = [ОН-]=10-7 моль/л, поэтому:
KW = Kв = 10-7·10-7 = 10-14 .
Сумма водородного и гидроксильного показателей в водных растворах при 25°С равна 14. Следует учитывать, что каковой бы ни была величина реакции раствора (рН), произведение концентраций [Н+]·[ОН-] остаётся неизменным. Величина ионного произведения воды может измениться только при изменении температуры, но не при увеличении [Н+] или [ОН-].
Гидролиз
Реакция взаимодействия между растворителем и растворённым веществом носит название сольволиза, а для водных растворов – гидролиза.
В общем случае гидролиз – разложение веществ водой. Вода – одно из активных веществ, взаимодействущих с различными классами соединений: солями, белками, жирами и т.д. При растворении большинства солей в воде происходит разложение их с нарушением равновесия диссоциации воды за счёт связывания ионов Н+ или ОН– воды, т.е. вода способна разлагать растворённые вещества, действуя на них как кислота или основание:
PCl3 + 3H2O = H3PO3 + 3HCl,
Al2S3 + 6H2O ↔ 2Al(OH)3 + 3H2S.
При этом изменяется кислотность растворов по сравнению с кислотностью растворителя. Соль гидролизуется.
Гидролиз соли – обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению равновесия между ионами водорода и гидроксида в растворе. Например, следующие реакции являются реакциями гидролиза солей:
KCN+H2O ↔ HCN+KOH
AlCl3+H2O ↔ Al(OH)Cl2+HCl
Гидролиз соли происходит лишь в случае образования малодиссоциируемых соединений (в приведённых реакциях HCN, Al(OH)Cl2).
Гидролизу подвергаются соли, образованные:
1) анионом слабой кислоты и катионом сильного основания;
2) анионом сильной кислоты и катионом слабого основания;
3) анионом слабой кислоты и катионом слабого основания.
Соли же, образованные анионом сильной кислоты и катионом сильного основания, не гидролизуются, а процесс нейтрализации в этом случае сводится к следующему:
Н++ОН- ↔ Н2О
Следует учитывать, что обратная реакция диссоциации воды на ионы протекает в крайне малой степени.
Слабыми кислотами являются: HNO2, H2SO3, H2O2, CH3COOH, H2SiO3, HF, H2CO3, HCN, H2S, H3PO4. Сильными кислотами являются: HNO3, H2SO4, HCl, HBr, HJ, НClO4, НMnO4. Cильными основаниями являются все щелочи (кроме NH4OH), например КОН, NaOH, Ba(OH)2, Ca(OH)2.
Рассмотрим подробнее основные три случая гидролиза солей:
1. Гидролиз соли, образованной анионом слабой кислоты и катионом сильного основания:
Например
H2CO3 + 2 NaOH = Na2СO3 + 2H2O
слабая сильное
кислота основание
H2S + 2 KOH = K2S + 2H2O
слабая сильное
кислота основание
В водных растворах таких солей с H2O будут взаимодействовать анионы слабой кислоты, которые образуются при диссоциации соли:
Na2СO3 ® 2 Na + + CO3 2−
Эти анионы будут присоединять к себе ионы Н+, отщепившиеся от молекул H2O, в результате этого образуется слабый электролит HСO3− – гидрокарбонат-анион, а в растворе станут накапливаться ионы ОН−, которые будут сообщать раствору такой соли щелочную реакцию.
HOH + CO32- 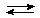 HСO3 − + OH –
HСO3 − + OH –
В результате этого рН растворов солей, образованных слабой кислотой и сильным основанием, будет > 7. А в самом растворе станут присутствовать кислая соль и щелочь.
В молекулярном виде уравнение гидролиза записывается следующим образом:
Na2СO3 + НОН 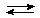 NaHСO3 + NaOH
NaHСO3 + NaOH
Взаимодействие ионов соли с H2O является обратимой реакцией и с течением времени в растворе устанавливается равновесие и при этом гидролизу подвергается только малая часть анионов соли. Чем слабее кислота, образующая соль, тем сильнее протекает гидролиз.
Если соль образована слабой многоосновной кислотой, то гидролиз может идти в несколько стадий или ступеней. Их число равно величине заряда анионов слабой кислоты. Например:
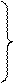
| |
|
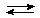 HS- + OH-
HS- + OH- молекулярное уравнение: Na2S + НОН 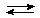 NaНS + NaОН
NaНS + NaОН
 |
|
НS- + НОН 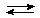 Н2S + ОН-
Н2S + ОН-
молекулярное уравнение: NaНS + НОН 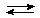 Н2S + NaОН
Н2S + NaОН
Следует отметить, что в таких случаях гидролиз протекает, главным образом, по первой стадии и в очень малой степени. По последующим стадиям он идет гораздо хуже и им можно пренебречь. Это связано с тем, что продукты, образующиеся на поздних стадиях гидролиза (Н2S), являются более сильными электролитами, чем продукты, образующиеся на первой стадии (НS-), и лучше диссоциируют на ионы.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой:
Например
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
слабое сильная
основание кислота
Zn(OH)2 + 2 HCl = ZnCl2 + 2 H2O
слабое сильная
основание кислота
В водных растворах таких солей с H2O будут взаимодействовать катионы слабого основания (т.е. ионы металлов или NH4+), образующиеся при диссоциации соли:
ZnCl2 → Zn 2+ + 2 Cl¯
Они будут присоединять к себе гидроксильные ионы, отщепившиеся от молекул H2O, в результате чего образуется слабый электролит (ZnОН+), а в растворе станут накапливаться ионы Н+, которые сообщат раствору такой соли кислую реакцию.
Zn 2+ + НОН 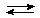 ZnОН+ + Н+
ZnОН+ + Н+
В результате этого рН растворов солей, образованных слабым основанием и сильной кислотой, будет < 7, а в самом растворе станут присутствовать основная соль и сильная кислота.
В молекулярном виде уравнение гидролиза в этом случае можно записать так:
ZnCl2 + НОН 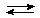 ZnОНCl + НCl
ZnОНCl + НCl
Чем более слабым электролитом является основание, образующее соль, тем сильнее протекает ее гидролиз.
Если соль образована многокислотным слабым основанием, то ее гидролиз может протекать в несколько стадий:
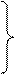 Cu(NO3)2 ® Cu2+ + 2 NO3 –
Cu(NO3)2 ® Cu2+ + 2 NO3 –
|
 Cu2+ + НОН
Cu2+ + НОН 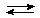 CuOH+ + Н+
CuOH+ + Н+ молекулярное уравнение: Cu(NO3)2 + НОН 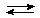 CuОНNO3 + НNO3
CuОНNO3 + НNO3
|
CuOH+ + НОН 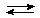 Cu(ОН)2 + Н+
Cu(ОН)2 + Н+
молекулярное уравнение: CuОНNO3 + НОН 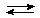 Cu(ОН)2 + НNO3
Cu(ОН)2 + НNO3
Однако и в этом случае гидролиз протекает в малой степени только по первой стадии. По последующим стадиям он будет идти крайне незначительно и им можно пренебречь.
3. Гидролиз соли, образованной слабой кислотой и слабым основанием:
Например
СН3СООН + NН4OН = СН3СООNН4 + Н2О
2 Al(OH)3 + 3 H2СO3 = Al2(СO3)3 + 6 Н2О
Такие соли лучше всего подвергаются гидролизу, так как в этом случае с Н2О взаимодействуют и катионы основания, и анионы кислоты:
СН3СООNН4 → СН3СОО‾ + NН4+
СН3СОО‾ + НОН 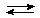 СН3СООН + ОН‾
СН3СООН + ОН‾
NН4+ + НОН 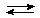 NН4ОН + Н+
NН4ОН + Н+
Причем в растворе одновременно образуются и ионы Н+ и ионы ОН‾. Среда в растворе такой соли может быть кислой, нейтральной или щелочной.
Если кислота и основание, образующие соль, являются слабыми электролитами примерно одинаковой cилы, то катионы основания и анионы кислоты будут в одной и той же мере взаимодействовать с молекулами Н2О. Число ионов Н+ и ОН¯ в растворе будет примерно равным. Они вступят в реакцию между собой (Н+ + ОН¯ = Н2О) и среда в растворе такой соли останется нейтральной.
Если же какой-то из электролитов (кислота или основание) будет слабее другого, то среда в растворе такой соли будет кислой или щелочной. Так, если кислота, образующая соль, является более слабым электролитом, чем основание, то анионы кислоты будут в большей степени взаимодействовать с Н2О, чем катионы основания. В результате этого ионов ОН¯ в растворе станет накапливаться больше, чем ионов Н+ и среда в нем будет щелочной. Если же основание, образующее соль, слабее, чем кислота, то среда в растворе такой соли, наоборот, будет кислой.
Соли, образованные и слабой кислотой, и слабым основанием, подвергаются гидролизу в гораздо большей степени, чем все остальные, т.к. образующие ионы Н+ и ОН¯ связываются в Н2О и равновесие в реакции гидролиза смещается в правую сторону.
В этом случае гидролиз часто протекает до конца не только по первой стадии, но и в значительной степени по последующим стадиям.
Для целого же ряда таких солей гидролиз является необратимым и приводит к полному разложению такой соли на соответствующую кислоту и основание:
 СО2
СО2
 Al2(СO3)3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2СO3
Al2(СO3)3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2СO3
Н2О
Al2S3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2 S↑
Такие соли в водных растворах вследствие этого существовать не могут. В таблицах растворимости в клеточках, соответствующим данным солям, часто ставится прочерк.
4. Соль, образованная сильной кислотой и сильным основанием, не гидролизуется:
Например
NaOH + HCl = NaCl + H2O
сильное сильная
основание кислота
2 KOH + H2SO4 = K2SO4 + 2 H2O
сильное сильная
основание кислота
Такие соли гидролизу не подвергаются и их водные растворы имеют нейтральную среду.
Гидролизу подвергается не вся соль, а лишь её часть, т.е. в растворе устанавливается равновесие между солью и образующими её кислотой и основанием. Поэтому часть вещества, подвергающаяся гидролизу, характеризуется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли, а также от её природы. Природа соли проявляется в величине константы гидролиза соли.
Константа гидролиза соли(Кг) характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени протекает гидролиз (при постоянстве Т и концентрации соли).
Константа гидролиза соли, образованной анионом слабой кислоты и катионом сильного основания, равна:
Кг= 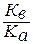 ,
,
где Ка – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
Константа гидролиза соли, образованной анионом сильной кислоты и катионом слабого основания, равна:
Кг= 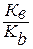 ,
,
где Кb – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
Константа гидролиза соли, образованной анионом слабой кислоты и катионом слабого основания, равна:
Кг= 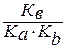
Зависимость степени гидролиза от концентрации соли проявляется в том, что с разбавлением раствора степень гидролиза растёт. Влияние температуры на степень гидролиза вытекает из рассмотренного ранее принципа Ле Шателье: степень гидролиза растёт с повышением температуры. Поэтому для ослабления гидролиза растворы необходимо хранить концентрированными и при низких температурах. Для солей, образованных анионом сильной кислоты и катионом слабого основания, фактором подавления гидролиза является подкисление раствора, а в случае соли, образованной анионом слабой кислоты и катионом сильного основания, таковым фактором является подщелачивание раствора.
Как было показано выше, процесс гидролиза может протекать ступенчато, например:
 Na2CO3+H2O↔NaHCO3+NaOH 1 ступень, Ка,2
Na2CO3+H2O↔NaHCO3+NaOH 1 ступень, Ка,2
CO32- +H2O↔HCO3- +OH-
NaHCO3-+H2O↔H2CO3+OH- 2 ступень, Ка,1
HCO3- +H2O↔H2CO3+OH-
Как видно из уравнения реакции гидролиза, на первой ступени образуется гидрокарбонат-ион, диссоциация которого характеризуется Ка,2 угольной кислоты, а во второй ступени происходит гидролиз кислой соли с образованием угольной кислоты, диссоциацию которой характеризует Ка,1 её диссоциации. Поэтому можно связать константу гидролиза по первой ступени Кг, 1 со второй константой диссоциации кислоты Ка, 2, а константу гидролиза по второй ступени Кг, 2 с первой константой диссоциации кислоты Ка, 1:
Кг, 1 = 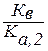 > Кг, 2 =
> Кг, 2 = 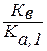
Гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Аналогично протекает гидролиз соли, образованной катионом слабого основания многовалентного металла.
Особенно глубоко протекает гидролиз соли, образованной анионом слабой кислоты и катионом слабого основания, т.к. константа гидролиза для этого случая обратно пропорциональна произведению констант диссоциации кислоты и основания, т.е. её значение крайне велико.
Согласно протонной теории кислот и оснований, гидролиз можно представить как частный случай кислотно-основного равновесия: протон переходит от молекулы воды к данному иону или от данного иона к молекуле воды. Примером может служить гидролиз иона аммония:
NH4++H2O↔H3О++NH3
