Фторирование фтором и высшими фторидами металлов
Прямое действие фтора на органические вещества приводит к бурной реакции, сопровождающейся вспышками и взрывами. В результате получаются фторид водорода и продукты разложения органических молекул (углерод, тетрафторметан). Такое направление реакции обусловлено ее высокой экзотермичностью, превосходящей энергию разрыва углерод-углеродных связей.
Более спокойно реакция протекает при разбавлении фтора (и паров органического вещества) инертным в данных условиях газом, воспринимающим часть выделяющегося тепла и выводящим систему из весьма широких пределов взрываемости. Таким газом-разбавителем на практике обычно служит азот. При фторировании в жидкой фазе можно применять устойчивые к действию фтора растворители (фторуглероды, при низкой температуре— тетрахлорметан). При наиболее распространенной газофазной реакции кроме разбавления азотом положительное влияние оказывает теплопроводящая насадка (например, из медной проволоки).
Механизм реакций фторирования сильно отличается от хлорирования. Причина этого состоит в очень слабой электрофильности молекулы фтора, вследствие чего происходят только радикально-цепные реакции. Для них не требуется посторонних инициаторов, а цепь зарождается самопроизвольно за счет взаимодействия фтора с углеводородом; дальнейшее развитие цепи протекает обычным образом:
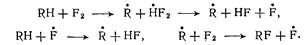
Другая особенность состоит в высокой активности и связанной с этим малой избирательности фтора при его атаке органической молекулы. Так, в отличие от хлорирования, при фторировании идут одновременно реакции замещения и присоединения, причем замещаются почти с равной вероятностью разные атомы водорода, в том числе в уже образовавшихся фторпроизводных. Кроме того, существенное развитие получает расщепление по С—С-связям; эти превращения можно ограничить, смягчая условия реакции.
По изложенным причинам фторирование ведут в промышленности главным образом для получения перфторпроизводных углеводородов (перфторуглероды), отличающихся очень высокой термической и химической стабильностью. Из них продукты фторирования средних фракций нефти применяют как термостойкие смазочные масла и гидравлические жидкости, а производные фракции С7—С10 — в качестве растворителей.
Технология процесса.
В промышленности существует несколько способов фторирования.
Каталитическое фторирование осуществляют в аппарате с медной стружкой, покрытой слоем серебра: в аппарат подают фтор и углеводород, разбавленные азотом. Роль меди обусловлена ее высокой теплопроводностью и состоит в аккумулировании выделяющегося тепла. Серебро, видимо, переходит под действием фтора в AgF2, который достаточно мягко фторирует углеводород. Однако происходит и прямое взаимодействие последнего с фтором, вследствие чего выход целевого продукта относительно мал—от 40 до 80—90%.
Металлофторидный процесс получил наибольшее распространение. Он основан на применении высших фторидов металлов (CoF3, MnF3), взаимодействующих с углеводородами сравнительно мягко и с не столь большим выделением тепла. Отработанную соль вновь регенерируют под действием фтора:
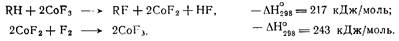
Этим общая теплота реакции F2 с ГH, составляющая 460 кДж/моль, распределяется на две стадии, из которых углеводород принимает участие только в одной, имеющей умеренный тепловой эффект. Вследствие этого получается больший выход продукта.
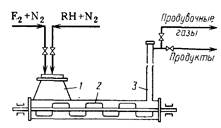

Реакционный аппарат (рис. 53) представляет собой горизонтальную стальную трубу с лопастной мешалкой, вращающейся со скоростью ~20 об/мин. Труба примерно наполовину заполнена фторидами кобальта. В левую ее часть, где находится загрузочный люк, поступают пары органического реагента, разбавленные 5—10-кратным избытком азота. С другого конца реактора отводят образующиеся продукты, которые вначале попадают в выводную трубу, где освобождаются от захваченных частиц фторида кобальта, и затем направляются на охлаждение и разделение.
Реакцию ведут до тех пор, пока 50% трифторида кобальта не превратится в дифторид. Температуру поддерживают неодинаковой по длине трубы: 150—200°С на входе и 300—380°С на выходе. Это объясняется тем, что углеводород фторируется достаточно быстро и во избежание деструкции желательна низкая температура. В то же время замещение последних атомов водорода протекает со значительным трудом, и для этого требуется более высокая температура. Оптимальное время контакта составляет 2—3 мин. После того как 50 % трифторида кобальта израсходуется, прекращают подачу углеводорода и продувают реактор азотом. Затем регенерируют трифторид кобальта, пропуская при 250°С свободный фтор, разбавленный азотом, опять продувают аппарат азотом с целью вытеснения остатков фтора и снова начинают реакцию. Таким образом, работа реактора является периодической и состоит из двух основных стадий (собственно реакции и регенерации) и двух операций продувки. Это — существенный недостаток данного метода.
Электрохимическое фторирование начало развиваться лишь в последнее время, но оно имеет ряд преимуществ по сравнению с только что описанными методами. Сущность его состоит в следующем: при электролизе безводного фторида водорода (с добавлением фторидов металлов для повышения электрической проводимости) выделяющийся на аноде фтор немедленно реагирует с растворенным или эмульгированным в жидкости органическим веществом. Благодаря протеканию реакций в жидкой фазе при перемешивании достигается хороший теплоотвод и существуют широкие возможности регулирования процесса. При этом не приходится предварительно получать и очищать молекулярный фтор, который все равно производят в промышленности методом электролиза. Наилучшие результаты электрохимическое фторирование дает при синтезе перфторзамещенных карбоновых кислот, простых и сложных эфиров, аминов, сульфидов и других соединений, растворимых в жидком фториде водорода.
