Концентрация растворов. Приготовление водных растворов
Для качественной характеристики растворов используют понятия «разбавленный раствор» и «концентрированный раствор». Разбавленный раствор содержит мало растворенного вещества, концентрированный – много растворенного вещества. Между концентрированным и разбавленным растворами нет резкой границы, она условна. Разбавленный раствор может быть насыщенным, если вещество практически не растворяется в воде (например, насыщенные растворы AgCl, BaSO4 и т.д.). В то же время концентрированный раствор (например, сахарозы) может быть ненасыщенным, так как растворимость сахарозы равна 179 г при 0°С в 100 мл воды.
Количественный состав растворов выражается концентрацией. Концентрацией раствора называется количество растворенного вещества в определённом количестве раствора или растворителя.
В химической практике наиболее употребительны следующие способы выражения концентраций.
1. Массовая доля растворённого вещества – это отношение массы растворённого вещества Х к общей массе раствора:
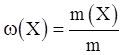 ,
,
где ω (Х) – массовая доля растворенного вещества Х, выраженная в долях единицы; m(X) – масса растворенного вещества Х, г; m – общая масса раствора, г. Массовую долю можно выражать также в процентах ( % ):
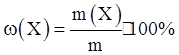 .
.
Если массовая доля растворенного хлорида натрия в растворе равна 0,03, или 3 %, то это означает, что в 100 г раствора содержится 3 г хлорида натрия и 97 г воды.
Зависимость между объемом (V) и массой раствора (m) выражается формулой
m = ρV,
где ρ – плотность раствора, г/мл; V – объем раствора, мл; m – масса, г.
2. Молярная концентрация выражается числом молей растворённого вещества, содержащимся в 1 л раствора (моль/л). Концентрация, выраженная этим способом, называется мольно-объёмной концентрацией или молярностью и обозначается буквой М. Так, 2 М H2SO4 означает раствор H2SO4 , в каждом литре которого содержится 2 моля, т.е. 2 . 98 = 196 г H2SO4 .
3. Нормальность выражается количеством эквивалентов, растворённых в 1 л раствора (моль/л). Концентрация, выраженная этим способом, называется эквивалентной концентрацией или нормальностью и обозначается буквой «Н». Так, 2 Н H2SO4 означает раствор H2SO4, в каждом литре которого содержится 2 эквивалента или 98 г H2SO4 .
4. Моляльная концентрация – количество моль растворённого вещества, приходящее на 1 кг растворителя ( моль/кг ). Обозначается буквой m. Концентрация выраженная этим способом, называется мольно-массовой концентрацией или моляльностью. Так, 2 m H2SO4 означает раствор серной кислоты, в котором на 1кг воды приходится 2 моля H2SO4 . Мольно-массовая концентрация раствора в отличие от его молярности не изменяется при изменении температуры.
5. Мольная доля – отношение количества моль данного вещества к общему количеству моль всех веществ, имеющихся в растворе. Концентрация, выраженная этим способом, обычно обозначается для растворителя N1, для растворенных веществ – N2, N3 и т.д. В случае раствора одного вещества в другом мольная доля растворенного вещества N2 равна
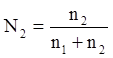 ,
,
где n1 и n2 – число молей растворителя и растворенного вещества соответственно.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 л раствора вещества 1 с нормальностью N1 реагирует с V2 л раствора вещества 2с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2.
Так как вещества реагируют в эквивалентных количествах, следовательно,
N1V1 = V2N2 или V1:V2 = N2:N1 .
Таким образом, объёмы растворов реагирующих веществ обратно пропорциональны их нормальностям.
6. Титр Т – масса вещества, содержащегося в 1 мл раствора, г/мл:
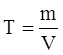 .
.
Титр связан с нормальностью соотношением
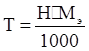 ,
,
где Мэ – молярная масса эквивалента вещества.
Плотность растворов.Плотность раствора – это отношение его массы к объему, выражается в единицах г/см3 и обозначается буквой r.
Плотность раствора изменяется при изменении его концентрации. Она может быть определена при помощи пикнометра, ареометра, гидростатических весов и др.
Для быстрого определения плотности жидкости служит ареометр. Ареометр представляет собой запаянную стеклянную трубку, нижний конец которой заполнен дробью или ртутью. Внутри верхней части трубки имеется шкала, отградуированная в единицах плотности. Плотность жидкости соответствует тому делению шкалы, до которого погружается ареометр при испытании. От плотности раствора можно перейти к процентному содержанию, если в таблицах не имеется цифры, точно отвечающей сделанному отсчету на шкале ареометра, а есть близкие величины (немного больше и немного меньше). В таком случае процентное содержание растворенного вещества вычисляют методом интерполяции (определение промежуточной величины по двум известным крайним).
Предположим, что имеется раствор серной кислоты с плотностью 1,200. По таблице находим, что для растворов серной кислоты с плотностью 1,174 и 1,205 процентная концентрация соответственно равна 24 и 28 %.
Считаем, что процентное содержание изменяется прямо пропорционально изменению плотности. Разница плотности равна 1,205 – 1,174 = 0,031, а разница в процентном содержании составляет 28% - 24% = 4%.
Находим разницу между плотностью нашего раствора и плотностью раствора кислоты с меньшей концентрацией. Она равна 1,200 – 1,174 = 0,026.
Увеличение плотности на 0,031 соответствует увеличению процентного содержания на 4%, а увеличение процентного содержания, соответствующее увеличению плотности на 0,026, находим из пропорции
0,031 – 4%
0,026 – х
х = 3,35%.
Прибавляем к процентному содержанию кислоты в растворе с меньшей плотностью 3,35% и получаем искомое процентное содержание
24% + 3,35% = 27,35%.
