Примеры решения типовых задач. Задача 1. Распределите электроны по уровням, напишите электронную формулу атома Ca.
Задача 1. Распределите электроны по уровням, напишите электронную формулу атома Ca.
Решение: заряд ядра атома определяем по порядковому номеру элемента; число уровней равно номеру периода, в котором находится элемент; максимальное число валентных электронов определяется номером группы, т.к. элемент расположен в главной подгруппе. На первых двух уровнях максимальное число электронов – 2 и 8 соответственно (определяем по формуле 2n2, где n – номер периода). Общее число электронов предпоследнего энергетического уровня просчитываем.
Итак, электроны в атоме кальция распределяются по уровням следующим образом: +20 )2 )8 )8 )2.
Электронная формула: 1s22s22p63s23p64s2 (валентные электроны).
Задача 2.Напишите электронную формулу элемента № 82.
Решение: № элемента 82, следовательно, у него 82 электрона. Воспользуемся принципами и схемой заполнения электронных состояний в атоме. Электронная формула атома Pb имеет вид:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2.
Задача 3.Напишите электронную структуру элемента с номером 24, укажите его семейство и приведите аналоги.
Решение: воспользуемся принципами и схемой заполнения электронных состояний в атоме. Электронная формула атома Cr имеет вид: 1s22s22p63s23p64s13d5. Поскольку последний электрон при заполнении перешел в d-состояние, то это d-элемент. Электронными аналогами его будут все элементы, имеющими конфигурацию ns1(n-1)d5. В случае хрома его электронным аналогом является молибден.
Задача 3. Распределите электроны по уровням, напишите электронную формулу атома Fe в основном и возбужденном состоянии, укажите квантовые состояния его валентных электронов и распределите их по квантовым ячейкам.
Решение: заряд ядра атома определяем по порядковому номеру элемента (+ 26); число уровней – по номеру периода (4). Так как железо расположено в побочной подгруппе, то валентные электроны его распределяются между s – подуровнем внешнего энергетического уровня и d – подуровнем предвнешнего уровня, общее число электронов равно 8 (номер группы). Так, если в 4s состоянии находятся 2 электрона, то в 3d-состоянии – 6 (номер группы минус 2). На первых двух уровнях максимальное число электронов – 2 и 8 соответственно (определяется удвоенным квадратом главного квантового числа – 2n2). Общее число электронов предпоследнего энергетического уровня атома железа просчитываем, оно равно 14.
Итак, в невозбужденном атоме железа электроны распределяются следующим образом: +26 )2 )8 )14 )2.
Электронная формула атома железа в невозбужденном состоянии имеет вид: 1s22s22p63s23p63d64s2 ( валентные электроны).
Порядок заполнения квантовых ячеек подуровня электронами определяется правилом Гунда по принципу наибольшего суммарного спина:
3d 4s
 |
В возбужденном атоме железа один s – электрон переходит на 4р – подуровень. В возбужденном состоянии электроны распределяются по квантовым ячейкам следующим образом:
Fе *: 1s22s22p63s23p63d64s14p1 или ... 3d64s14p1
3d 4s 4p1

Задача 4.Определите квантовые числа последнего состояния (электрона) в атоме железа.
Решение. Электронная конфигурация железа: 1s22s22p63s23p64s23d6.
 3d 4s
3d 4s
ml= -2; -1; 0; +1; +2
Следовательно, последний электрон приходит на 3d-орбиталь, ему соответствует следующий набор квантовых чисел: n=3, l=2, ml= -2, ms = -1/2.
Задача 2.Напишите электронные формулы ионов Mn2+, S2-, укажите число неспаренных электронов.
Решение:
1. Распределение электронов по энергетическим уровням у атома Mn (d-элемент): 1s22s22p63s23p63d54s2 (валентные электроны).
3d 4s
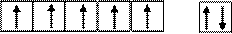
При образовании положительных ионов у d- элементов первыми всегда удаляются s-электроны внешнего слоя, т.е. для иона Mn+2 справедлива электронная формула: 1s22s22p63s23p63d54s0 (валентные электроны).
3d 4s

Число неспаренных электронов равно 5.
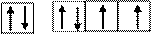
2. При образовании отрицательных ионов происходит дальнейшее заполнение энергетических подуровней согласно правилу Клечковского, то есть для атома серы S: 1s22s22p63s23p4 (валентные электроны).
3s 3p
Для иона S2– произойдет «достройка» 3р-подуровня: 1s22s22p63s23p6.
3s 3p
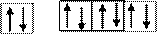
Число неспаренных электронов равно 0.
Задача 4. Укажите положение элемента в периодической системе (период, группу, подгруппу), если последний электрон в его атоме находится в состоянии: а) 3d6; б) 4p2. Ответ обоснуйте.
Решение:
а) последний электрон атома в d – состоянии, следовательно, это элемент побочной подгруппы. В атомах элементов побочных подгрупп последний валентный электрон попадает на d – подуровень предпоследнего энергетического уровня, из этого следует, что n=4. Величину главного квантового числа (4) определяет номер периода. Так как 4s-состояние заполняется электронами раньше, чем 3d, то общее число электронов, которые могут быть валентными, равно 4: 3d24s2. Значит, это элемент 4-го периода IV группы побочной подгруппы – титан (Ti).
б) электрон в атоме в p – состоянии, следовательно, это элемент главной подгруппы. В атомах элементов главных подгрупп валентные электроны расположены на внешнем энергетическом уровне, отсюда величина главного квантового числа 4 (номер периода). Так как p -состояние внешнего уровня заполняется электронами после s – состояния, то общее число валентных электронов 4, что определяет номер группы. Следовательно, это элемент 4-го периода IV группы главной подгруппы – германий.
Задача 5. Определите вид химической связи в веществах: CH4, Ar, Cа, RbF, Si, ZnSe. Какой тип кристаллической решетки они имеют в конденсированном состоянии? Укажите, какие частицы находятся в узлах их кристаллической решетки.
Решение: для кристаллов метана и аргона характерна молекулярная решетка. В узлах первой кристаллической решетки находятся неполярные молекулы CH4, между которыми действуют дисперсионная составляющая ван-дер-ваальсовых сил. Дисперсионное взаимодействие проявляется и в кристаллах между одноатомными молекулами аргона.
Кальций – металл, для него характерна металлическая решетка. Связь между катионами кальция, находящимися в узлах решетки, и обобществленными электронами – металлическая.
В соединении RbF типичная ионная связь, так как ΔЭОRbF = 4,1 – 0,86 = 3,24. Для кристаллов RbF характерна ионная решетка, в узлах которой находятся положительные ионы Rb+ и отрицательные ионы F-.
Кристаллический кремний (неметалл) имеет ковалентную кристаллическую решетку типа алмаза, в которой каждый атом кремния связан с четырьмя соседними атомами неполярной ковалентной связью.
Между атомами цинка и селена, находящимися в узлах кристаллической решетки, действует полярная ковалентная связь, так как ΔЭОZnSe = 2,4 – 1,7= 0,7.
Задача 6. Рассмотрите строение молекулы BCl3 с позиции метода валентных связей: укажите квантовые состояния валентных электронов в атомах, образующих связи в молекуле, форму и валентные углы между связями; нарисуйте модель молекулы BCl3 и определите полярна ли она.
Решение: определяем валентные электроны в атомах, образующих связи, и распределяем их по квантовым ячейкам: В…2s22p1. Атом бора в молекуле BCl3 образует три химические связи, следовательно, он находится в возбуждённом состоянии: B*….2s12p2. Происходит гибридизация sp2 электронных орбиталей с образованием трех гибридных электронных облаков. В образовании связи у хлора участвует p-электрон: Cl…3s23p5. Связи B–Cl образованы перекрытием гибридного электронного облака атома В и p-электронного облака атома Cl. Направленность гибридных электронных облаков трехвалентного атома В определяет направленность связей и форму молекулы BCl3. Связи B–Cl направлены под углом 1200, молекула BCl3 имеет форму плоского треугольника. Схема образования связей в молекуле BCl3:
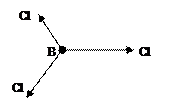
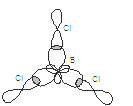
Векторы дипольных моментов связей μсв>0 направлены в сторону атома с большей электроотрицательностью. Суммарный дипольный момент молекулы равен 0, т.е. молекула неполярна, хотя все связи B-Cl полярны.
Задача 7. Почему комплексный ион [Cu(NH3)2]+ имеет линейное строение?
Решение: Линейное строение иона является следствием образования двух гибридных 4sp-орбиталей иона Cu+, которые акцептируют электронные пары молекул аммиака.
Задача 8. Комплексный ион [Zn(NH3)4]2+ имеет тетраэдрическое строение. Какие орбитали комплексообразователя используются для образования связей с молекулами аммиака?
Решение: Тетраэдрическое строение характерно для sp3-гибридных орбиталей. Ион Zn2+ имеет свободные 4s и 4p-орбитали, гибридизация которых приводит к образованию 4 sp3-орбиталей.
Задача 9. Почему ион [NiCl4]2- парамагнитен (тетраэдр), а ион [Ni(CN)4]4- диамагнитен (плоский квадрат)?
Решение: Ионы Cl- слабо взаимодействуют с ионами Ni2+. Электронные пары от Cl- поступают на орбитали с главным квантовым числом 4. При этом оставшиеся у иона никеля 3d-электроны остаются неспаренными и ион [NiCl4]2- – парамагнитен.
В [Ni(CN)4]4 - вследствие sp2d-гибридизации происходит спаривание электронов никеля и комплексный ион становится диамагнитен. Ион [NiCl4]2- – внешнеорбитальный и высокоспиновый, так как электронные пары от хлора поступают на свободные орбитали с более высоким квантовым числом 4.
Ион [Ni(CN)4]4- – внутриорбитальный и низкоспиновый, так как электронные пары акцептируются гибридной орбиталью, включающей «внутренние» 3d – подуровни атома никеля; все электроны спарены, при гибридизации образуется комплексный ион плоского строения.
Задача 10. Константа нестойкости иона [Ag(CN)2]- составляет 1·10-21. Вычислите концентрацию ионов серебра в 0,05 М растворе К[Ag(CN)2], содержащем, кроме того, 0,01 моль/л KCN.
Решение: Вторичная диссоциация комплексного иона протекает по уравнению: [Ag(CN)2]- ↔ Ag+ + 2CN- .
В присутствии избытка ионов CN-, создаваемого в результате диссоциации KCN (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов CN- , образующимся при вторичной диссоциации, можно пренебречь. Тогда [CN-] = C KCN = 0,01моль/л. По той же причине равновесная концентрация ионов [Ag(CN)2]- может быть приравнена общей концентрации комплексной соли (0,05 моль/л). По условию задачи: Kн = [Ag+] · [CN-]2 / [Ag(CN)2]-= 1·10-21
Отсюда выражаем концентрацию ионов Ag+:
[Ag+] = 1·10-21 · [Ag(CN)2]- / [CN-]2 .
Подставив значения концентраций ионов CN- и [Ag(CN)2]-, получим:
[Ag+] = 1·10-21 · 0,05/(0,01)2= 5·10-19 моль/л .
