Общая теория поглощения света молекулами
Световая волна состоит из взаимно перпендикулярных электрического и магнитного полей, амплитуды которых, по мере распространения в пространстве, изменяются по синусоиде. Энергия волны, Е, равна:
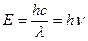 ,
,
где h – постоянная Планка, c – скорость света, l - длина волны и n - частота.
Когда волна сталкивается с молекулой вещества, она может либо рассеиваться (т.е. изменять направление распространения), либо поглощаться (т.е. передавать энергию молекуле). Относительная вероятность протекания того или иного процесса зависит от свойств той молекулы, с которой произошло столкновение. Если происходит поглощение электромагнитной энергии света, молекула переходит в возбужденное состояние. Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой или ближней УФ-области, называется хромофором. Обычно энергия возбуждения превращается в тепло в результате столкновения возбужденной молекулы с другой молекулой (например, молекулой растворителя). В некоторых случаях энергия вновь излучается (явление флуоресценции). Возбужденная молекула обладает набором дискретных квантованных энергетических состояний, описываемых законами квантовой механики. Эти состояния называют энергетическими уровнями молекулы. Главные энергетические уровни определяются возможным пространственным распределением электронов и называются электронными энергетическими уровнями; на них накладываются колебательные уровни, которые указывают на различные типы колебаний молекулы (например, растягивание или изменение углов различных ковалентных связей). Энергетические уровни обычно описываются схемой энергетических уровней (см. рис. 3.5). Самый низкий электронный уровень называется основным состоянием, а все другие – возбужденными.
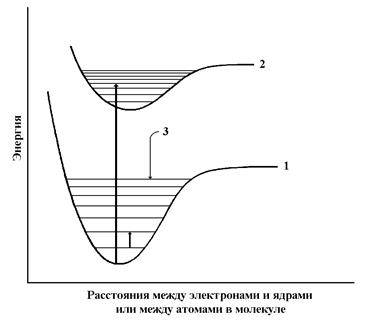
Рис. 3.5 Типичная схема энергетических уровней, показывающая основное состояние (1) и первое возбужденное состояние (2). Тонкими горизонтальными линиями показаны колебательные уровни (3). Длинная стрелка указывает на возможный электронный переход между основным состоянием и четвертым колебательным уровнем первого возбужденного состояния. Короткая стрелка означает переход с одного колебательного уровня на другой в пределах основного состояния.
Поглощение энергии происходит с наибольшей вероятностью только в том случае, если количество поглощенной энергии соответствует разности энергетических уровней. Это можно выразить следующим уравнением:
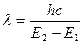 ,
,
где Е1 – энергетический уровень молекулы до поглощения, а E2 – энергетический уровень, достигаемый в результате поглощения.
Изменение энергетического состояния при испускании или поглощении кванта называется переходом. Упрощенно переход между электронными энергетическими уровнями соответствует энергии, необходимой для перемещения электрона с одной орбитали на другую. На схеме энергетических уровней переходы изображаются вертикальными стрелками. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Задача абсорбционной спектроскопии состоит в накоплении и анализе данных по поглощению. Если бы все переходы происходили только между самыми низкими колебательными уровнями основного состояния и первого возбужденного состояния, тогда спектр поглощения состоял бы из узких, дискретных линий. Однако, поскольку возможны переходы с основного состояния на любой колебательный и вращательный уровни первого возбужденного состояния, а линии имеют конечную ширину, то спектр проявляется в виде относительно плавной кривой. Для большинства молекул длины волн, соответствующие переходам между основным состоянием и любым колебательным уровнем первого возбужденного состояния, лежат в ультрафиолетовой и видимой области спектра. Возможны также низкие по энергии переходы между колебательными уровнями в пределах одного электронного уровня. Эти переходы происходят в результате поглощения излучения в инфракрасной области.
Вероятность перехода при одной длине волны характеризуется молярным коэффициентом поглощения при этой длине волны. Чтобы определить этот параметр рассмотрим, как он измеряется. Если свет интенсивности I0 проходит через раствор с толщиной слоя l и концентрацией вещества C, интенсивность прошедшего света I подчиняется закону Бугера-Ламберта-Бера:
I = I0×10 – elC, то есть 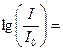 – elC или
– elC или 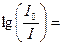 elC,
elC,
где e – молярный коэффициент поглощения (экстинкции), измеряемый в моль–1см–1, и равный поглощению раствора с концентрацией в 1 М при длине оптического пути в 1 см. Результаты измерения выражают чаще всего, как поглощение A ( 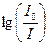 ). Когда l = 1 см, А называют Dl или оптической плотностью, индекс l указывает длину волны, при которой проводится измерение. Оптической плотностью удобно пользоваться, так как она равняется e∙С. В некоторых случаях, если С велико, e становится функцией С, и тогда можно сказать, что закон Бера нарушается. Это может быть результатом рассеяния света или структурных изменений вещества (например, димеризации, аггрегации или химических изменений) при высоких концентрациях.
). Когда l = 1 см, А называют Dl или оптической плотностью, индекс l указывает длину волны, при которой проводится измерение. Оптической плотностью удобно пользоваться, так как она равняется e∙С. В некоторых случаях, если С велико, e становится функцией С, и тогда можно сказать, что закон Бера нарушается. Это может быть результатом рассеяния света или структурных изменений вещества (например, димеризации, аггрегации или химических изменений) при высоких концентрациях.
Контрольные вопросы
1. Основные принципы строения сложных белков
2. Гемопротеиды: гемоглобин – важнейший представитель гемопротеидов
3. Методы выделения гемоглобина, качественная реакция на гемовую группу
4. Фосфорпотеиды: строение и роль в организме
5. Методика выделения казеина, обнаружение фосфорной кислоты в казеине
6. Абсорбционная спектроскопия
7. Методы количественного определения белка
Литература
1. Lowry O.H., Rosebrough N.J., Farr A.L., Randall A.L., Protein measurement with the Folin phenol reagent, J. Biol. Chem., 1951, 193, 265-275
2. Bradford М., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Anal. Biochem., 1976, 72, 248 – 254
3. Овчинников Ю.А., Биоорганическая химия, «Просвещение», М., 1987
4. Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993
5. Степанов В.М., Молекулярная биология: структура и функции белков, под ред. академика Спирина А.С., «Высшая школа», М., 1996
6. Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998
7. Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000
Ход работы
