Алкилирование аренов по Фриделю-Крафтсу
С-Алкилирование аренов можно проводить по Вюрцу-Фиттигу, Вюрцу-Гриньяру и т.д., но в промышленности чаще всего используется реакция Фриделя-Крафтса, которую можно представить в виде следующей схемы:
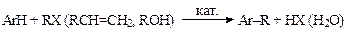
Механизмреакции алкилирования аренов по Фриделю-Крафтсу представляет собой обратимое электрофильное замещение (SE):
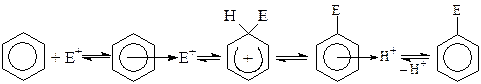
В кинетической области скорость реакции можно рассчитать по уравнению:
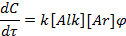
в котором учитывается строение субстрата (k), концентрации реагирующих веществ и функция катализатора (j).
Реакционная способность субстрата определяется устойчивостью s-комплекса. Как и в других реакциях SE (сульфирования, нитрования, галогенирования, нитрозирования и т. п.) электронодонорные заместители в ядре, стабилизирующие s-комплекс, ускоряют реакцию, а электроноакцепторные — дестабилизируют его и затрудняют реакцию.
Существование s-комплекса было доказано экспериментально (Ола, 1958 г.) при алкилировании мезитилена этилфторидом в присутствии BF3. При –80 °С образуется твердое оранжевое вещество, которое при –15 °С количественно превращается в конечный продукт:
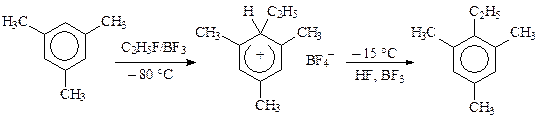
В связи с тем, что реакция обратима, направление реакции в мягких условиях определяется устойчивостью s-комплекса (кинетический контроль) и выполняются правила ориентации. При высокой температуре, большом количестве катализатора и продолжительном времени ведения процесса направление реакции определяется устойчивостью конечных продуктов (термодинамический контроль), что часто приводит к получению метазамещенных продуктов. Например, при метилировании толуола метилхлоридом при 0 °С образуется 27 % м-ксилола, при 55 °C— 87 %, а при 106 °С — 98 %.
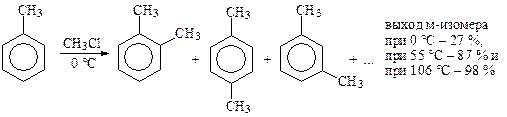
В качестве катализаторовв процессах алкилирования в основном применяют протонные и апротонные кислоты, оксиды, цеолиты и катиониты.
Протонные кислоты используются главным образом при алкилировании ароматических соединений спиртами и алкенами. Их активность как катализаторов падает в ряду HF > H2SO4 > H3PO4.
В каталитических процессах применяют преимущественно безводный фтороводород как в жидком, так и в газообразном состоянии. Его каталитические свойства определяются ярко выраженной кислотностью и способностью к образованию комплексных соединений.
Фтороводород не является окислителем, легко отделяется от реакционной массы и утилизируется. Его низкая вязкость обеспечивает хорошее перемешивание и быстрое расслаивание реакционной массы. Однако большая летучесть, токсичность и коррозионная активность затрудняют использование HF в промышленных масштабах.
Применение серной кислоты как катализатора процесса алкилирования осложнено ее высокой химической активностью.
Фосфорную кислоту применяют как в жидком виде, так и на твердом пористом носителе (пемзе, силикагеле, кварце, активированном угле, кизельгуре). Алкилирование в присутствии фосфорной кислоты протекает при повышенных температурах, но с высокой селективностью.
Высокой каталитической активностью обладают также пирофосфорная и полифосфорная кислоты, а также соли фосфорной кислоты: BPO4, Ca3(PO4)2, Na3PO4 и др.
Апротонные кислоты (кислоты Льюиса) используются чаще всего при алкилировании алкилгалогенидами и алкенами. По активности их можно расположить в следующий ряд: AlBr3 > AlCl3 > FeCl3 > BF3 > TiCl3 > ZnCl2 > TiCl4.
Галогениды алюминия представляют собой белые кристаллические вещества, растворимые во многих органических соединениях. Их растворы в эфире, ацетоне, спиртах являются активными катализаторами процессов алкилирования. Галогениды алюминия образуют димеры (Al2Hlg6), прочность которых падает от хлорида к иодиду. В связи с этим каталитическая активность бромида алюминия выше хлорида, так как активированный комплекс в реакции Фриделя-Крафтса образует мономерная форма.
Трифторид борапредставляет собой газ, растворяющийся в воде и некоторых органических растворителях. Он обладают комплексообразующей и кислотной активностью.
Оксиды металлов и бора (B2O3)в качестве катализаторов используют обычно после обработки борной кислотой, трифторидом бора и активации фтором. Наиболее активными оказались амфотерные оксиды (Al2O3, Cr2O3 и др.), модифицированные BF3.
Цеолитыимеют общую формулу M2/nО.Al2O3.xSiO2.yH2O, где М — металл, а n — его валентность. Каталитические свойства цеолитов можно менять. Для этого изменяют объем пор от 0,2 до 1,0 нм введением катионов Li+, Na+, K+, Ca2+ и других методом ионного обмена; меняют алюмосиликатный состав хSiO2:Al2O3, где х ≈ 3¸6; а также добавляют вещества, обладающие кислотными свойствами. При этом, чем больше величина х, тем активнее цеолит.
Катионитыпредставляют собой полимеры (чаще всего полистирольные), содержащие –SO3H, –COOH, –PO(OH)2 и другие группы.
Активность таких катализаторов определяется свойствами полимерной основы, степенью замещения кислотными группами (например, сульфирования), размерами катализатора, его пористостью, термической стабильностью и кислотностью.
Активность катализатора зависит также от строения субстрата, природы алкилирующего агента и условий реакции (температура, давление и т.д.). Например, трифторид бора является активным катализатором при алкилировании спиртами, алкенами, фторпроизводными, но в реакциях с другими алкилгалогенидами его активность мала.
Катализ может быть твердофазным и жидкофазным. Использование твердых гетерофазных катализаторов (оксидов, цеолитов, катионитов) предпочтительно, так как при этом упрощается технология процесса (отделение и регенерация катализатора); уменьшаются затраты на подготовку сырья, промывку реакционной массы и нейтрализацию кислых сточных вод; уменьшается коррозия оборудования; упрощается организация непрерывных процессов и т.д. В случае апротонных кислот, выбор того или иного вида катализа зависит от растворителя и свойств кислоты Льюиса. При наличии двух жидких фаз (кислотно-солевой и органической) реакция, в основном, проходит в кислотно-солевом слое.
При алкилировании с помощью алкилгалогенидов и алкенов обычно достаточно небольшого количества катализатора, а при использовании спиртов необходимо, по меньшей мере, эквимолярное количество кислоты Льюиса, так как вода, образующаяся в результате реакции, дезактивирует катализатор.
Основными недостаткамиреакции Фриделя-Крафтса являются полиалкилирование, изомеризация радикала, изомеризация и диспропорционирование продукта.
Полиалкилирование объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата:
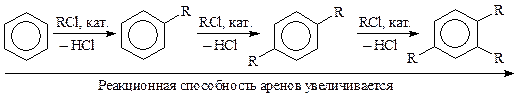
Для увеличения выхода моноалкиларена реакцию ведут в избытке субстрата при возможно более низкой температуре.
Изомеризация радикала вызывается превращением карбокатиона, образующегося в ходе взаимодействия галогенида с катализатором, в более стабильную частицу. Например, алкилирование бензола пропилбромидом в той или иной степени приводит к синтезу изопропилбензола, т.к. пропилкатион изомеризуется в более стабильный вторичный катион:
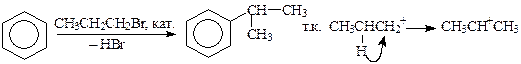
Чтобы избежать изомеризации радикала, следует тщательно подбирать условия проведения реакции (кислоту Льюиса, растворитель, время выдержки и температуру).
Изомеризация продукта реакции связана с обратимостью процесса и смещением равновесия в сторону более устойчивых веществ. Например, при нагревании п-ксилола с хлористым водородом и AlCl3, протон, выступая в качестве электрофила, атакует п-положение субстрата и вытесняет карбокатион. Продуктами взаимодействия нового электрофила (СН3+) с толуолом являются о-, м- и п-ксилолы, которые вновь подвергаются атаке протона и т.д. При этом большая часть углеводорода превращается в термодинамически более устойчивый м-ксилол, в котором метильные группы в наименьшей степени вытесняются протоном:
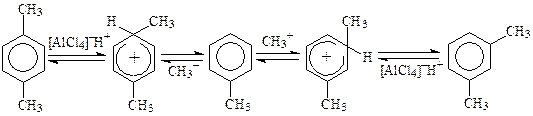
В ряде случаев использование в процессах алкилирования веществ, связывающих образующийся галогеноводород, предотвращает обратимость реакции, а, следовательно, и изомеризацию продукта.
Диспропорционирование продуктов алкилирования также связано с обратимостью реакции, поэтому одновременно с изомеризацией продукта может проходить и перемещение алкильных групп в более замещенный арен:
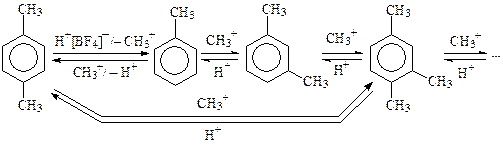
В приведенном выше примере метилкатион в первую очередь реагирует с более активным чем толуол ареном (например, п- или м-ксилолом), поэтому в реакционной массе накапливаются моно- и триалкилбензолы.
Изомеризация и диспропорционирование конечного продукта в кислой среде может служить доказательством обратимости процесса алкилирования.
